硅酸盐细菌的分离、鉴定及其生物学特性研究
胡 洲,吴毅歆,毛自朝,何月秋,*
(1.云南农业大学 农业生物多样性应用技术国家工程研究中心,云南 昆明650201;2.云南农业大学 农学与生物技术学院,云南 昆明650201)
目前,在世界范围内限制农业产量的主要因素之一就是土壤贫瘠,肥力下降,补充作物生长发育所必须的营养元素已成为获得稳产、高产不可或缺的重要措施[1]。钾是植物营养所必须的大量元素之一,植物在缺钾的情况下,产量低下、抗逆性差,且极易发生倒伏。
钾长石和云母等硅酸盐矿物,是组成地球表面岩石和土壤的主要成分(占60%以上),地壳中钾含量占2.35%,在所有元素中占第7 位,其中土壤含钾量占1.16%,而土壤中95%的钾存在于钾长石、云母这两大矿物中。土壤钾主要以矿物、固定钾、代换钾和水溶钾4 种形态存在,其中只有2%的代换钾和水溶性钾可被植物吸收利用[2]。
胶质类芽孢杆菌(以前称为硅酸盐细菌)是土壤中一类特殊的革兰氏阴性芽孢杆菌,能分解硅酸盐和铝硅酸盐组成的岩石矿物,具有溶磷、解钾及固氮能力[3-6],尤其能将土壤中的无效钾转变为速效钾,供植物吸收利用。吴洪生等[7]研究发现,在缺钾土壤中施用适当硅酸盐细菌制剂,可使土壤中速效钾增加128.6%,使土壤、磷矿粉和沙子等3 种基质平均速效钾含量比对照增加160.6%。刘五星等[8-9]研究发现胶质芽孢杆菌分解土壤矿物,使可溶性钾增加了11.97% ~13.4%,SiO2含量增加8.99% ~26.89%,认为矿物溶解能力与发酵液的粘度及其中有机酸有关。盛下放等[10-11]研究发现硅酸盐细菌发酵液中可溶性钾含量达到40 ~100 mg/L,而对照只有20 mg/L。由此可见,不同的硅酸盐细菌其解钾能力存在一定的差异,寻求和利用新的高效解钾菌是提高土壤有效钾含量和作物产量的重要对策。
1 材料与方法
1.1 土样
从全国不同作物根际附近、深5 ~20 cm 处取得土样,用无菌袋密封带回实验室分离硅酸盐细菌。
1.2 培养基
⑴硅酸盐细菌培养基:蔗糖5.0 g,Na2HPO42.0 g,MgSO4·7H2O 0.5 g,CaCO30.1 g,FeCl3·6H2O 5.0 mg,琼脂18.0 ~20.0,pH 7.5 ~8.5,蒸馏水1 L。
⑵无氮培养基(阿须贝(Ashby)培养基):甘露醇10.0 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO35.0 g,CaSO4·2H2O 0.1 g,琼脂18.0 g,蒸馏水1 L,pH 7.0。
⑶种子培养液:可溶性淀粉5.0 g,酵母膏1.0 g,K2HPO42.0 g,MgSO4·7H2O 0.5,CaCO30.1 g,FeCl3·6 H2O 5 mg,pH 7.5 ~8.5,蒸馏水1.0 L。
⑷发酵培养液:蔗糖10.0 g,MgSO4·7H2O 0.5 g,(NH4)2SO40.2 g,NaCl 0.1 g,CaCO30.1 g,钾长石粉5.0 g,pH 7.2,蒸馏水1 L。
⑸牛肉膏蛋白胨培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,pH 7.4 ~7.6,蒸馏水1 L。
1.3 试剂
细菌的生理生化鉴定试剂参照文献[12]。
1.4 硅酸盐细菌的分离
在无菌条件下,称取10 g 土样溶于90 mL 的无菌水充分振荡并梯度稀释成10-2、10-3、10-4倍的土壤悬液,然后每个稀释度各取100 μL 均匀涂布于硅酸盐细菌培养基平板上,37 ℃倒置培养3 d。挑选无色、透明、半玻璃状并富有弹性的菌落,进一步纯化直至获得纯培养为止。最后将所获得的纯培养菌株转入终浓度为25%的甘油中并密封保存于-80 ℃冰箱。
1.5 细菌鉴定
1.5.1 菌落形态鉴定 用灭菌的牙签从活化后的菌株斜面上轻轻刮取少量菌体细胞,加到10 mL 的无菌水中混匀,梯度稀释成10-2、10-3和10-4倍菌悬液。分别取10-3和10-4倍的菌悬液0.1 mL 涂布于硅酸盐细菌培养基平板上,然后倒置于隔水式303A-5S 电热恒温培养箱中培养3 ~5 d,待菌落长出后观察形态。
1.5.2 菌体特征观察 挑取在硅酸盐细菌培养基平板上活化后的各株菌落进行革兰氏染色、芽孢染色、荚膜染色,在M60 -2 -0058 e 蔡司正置显微镜下观察其菌体形态,具体染色方法参照文献[13]。
1.5.3 菌体的生理生化鉴定 以硅酸盐细菌培养基为基础培养基,参照常用细菌系统鉴定手册[13]对解钾能力较强的K1 和K3 进行生理生化试验,包括过氧化氢酶试验、柠檬酸盐利用试验、葡萄糖氧化发酵试验、甲基红试验、V-P 测定、淀粉水解试验、吲哚试验、明胶液化试验和耐盐性等,参照菌株为P.mucilaginosus VKPM B -7519,由本实验室提供。
1.5.4 菌株的16S rDNA 序列测定及系统发育树构建 细菌DNA 提取参照Kim 和Rainey[14-15]报道的方法。利用Iversen 等[16]报道的细菌通用引物P0(5' -GAGAGTTTGATCCTGGCTCAG -3')和P6(5' -CTACGGCTACCTTGTTACGA-3')扩增16S rDNA,PCR 反应也按其介绍的程序。
为进一步明确硅酸盐细菌的所属种类,细菌DNA 的提取参照Kim 和Rainey[16-17]报道的方法。利用Iversen 等[16]所报道的细菌16S rDNA 通用引物P0(5' -GAGAGTTTGATCCTGGCTCAG-3')和P6(5'-CTACGGCTACCTTGTTACGA-3')进行扩增。扩增产物经纯化、克隆后,由华大基因公司完成测序。
序列比对用软件BioEdit7.01 中的CLUSTAL W 多序列比对程序进行,系统发育树由MEGA 5.0 软件构建,方法为最大相似性(maximum likelihood),模型为Tamura-Nei model[17],bootstrap 分析重复1 000 次。
1.6 解钾能力的测定
挑选在无氮培养基上生长良好的菌株分别接种于50 mL 种子培养液中于37 ℃180 r/min 下扩大培养2 d,作为种子液。用移液枪取50 mL 种子液按4%的接种量加入50 mL 发酵培养液中,以不接任何菌液的发酵培养基为空白对照组,每个处理设3 个重复,于28 ℃150 r/min 下培养6 d。培养结束后,将发酵液用30%的H2O2消煮至荚膜消失,在6 000 r/min 离心10 min,将上清液定容至50 mL 容量瓶中,在M410 火焰亮度计上用空白溶液调节仪器零点,以标准溶液系列中的最高浓度的标准溶液调节仪器满刻度至40 分度处测量其他标准溶液,记录仪器示值。具体操作参照土壤理化分析实验指导书[18]。
1.7 盆栽试验
将采集来的土样自然风干,过8 目筛,装入试验用塑料钵,每钵装土500 g。玉米种子用30% H2O2的消毒,于37 ℃恒温培养基箱中浸种24 h,催芽后播种于温室内。选取解钾能力较强菌株K1、K3、K4、K5、K6 发酵液(浓度为3 ×10-5cfu/mL)和无菌水各100 mL 分别施入各自塑料盆土壤中,每个处理3 次重复,以原土样作为空白对照。每盆播6 粒“会单4 号”玉米种子,一周后间苗,每盆留4 株。每天定量浇水管理。其他管理条件一致。25 d 后调查玉米根长、株高、叶宽和鲜质量,采用SPSS17.0 进行单因素方差分析和多重比较。
2 结果与分析
2.1 分离结果
在硅酸盐细菌培养基平板上,挑取圆形、透明、粘稠并有一定弹性的菌落,经过多次划线纯化分离,共获得了8 株(K1、K2、K3、K4、K5、K6、K7、K8)疑似胶质类芽孢杆菌。
2.2 菌株鉴定结果
2.2.1 形态特征 分离得到的8 株菌落均呈无色、透明,半玻璃状,边缘整齐,表面光滑,富有弹性且易拉成丝。菌体革兰氏染色呈阴性,杆状或短杆状,荚膜肥厚。该菌在37 ℃培养下,1 ~2 d 菌落直径约2 mm,3 ~5 d 菌落直径约5 mm。但其在牛肉膏蛋白胨培养基上生长不良。这些特征与对照菌株及胶质类芽孢杆菌特征相似[19]。
图1 K1 的菌落形态Fig.1 Colony morphology of P.mucilaginosus k1
图2 K3 的菌落形态Fig.2 Colony morphology of P.mucilaginosus k3
2.2.2 生理生化试验 在所有8 个菌株在生理生化试验中,反应结果与胶质类芽孢杆菌基本一致,表1 只列出了解钾能力较强的K1 和K3 菌株和参照菌株P.mucilaginosus VKPM B-7519 的反应型。
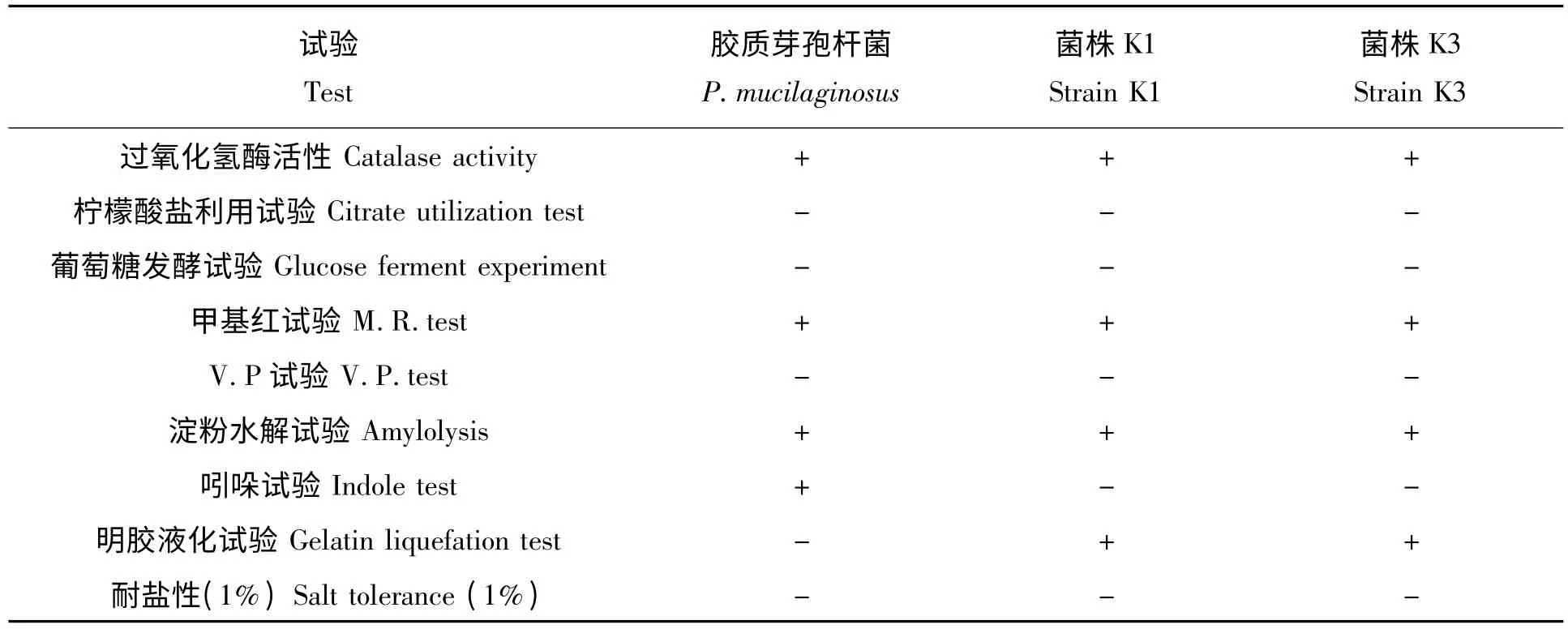
表1 硅酸盐细菌的生理生化特征Tab.1 Physiological and biochemical tests of silicate bacteria
2.2.3 菌株的16S rDNA 序列检测及系统发育树构建 利用引物P0 和P6 扩增菌株K1 和K3 的16S rDNA 基因,目的片段大小与预期一致,经测序,片段长度均为1 410 bp。K1 和K3 菌株的16S rDNA 基因已提交到GenBank,序列号分别为:KC762937 和KC762938。将序列分别与GenBank 序列相比对,结果表明,K1 和K3 菌株与类芽孢杆菌属(Paenibacillus)的菌株序列同源性最高。从MEGA 5.0 构建的系统发育树(图3)来看,菌株K1 和K3 与所有的P.mucilaginosus 菌株聚为一支。依据16S rDNA 基因序列再次将K1 和K3 归入P.mucilaginosus。因此,根据形态特征、生化反应特点及16S rDNA 基因序列,K1 和K3 菌株归属于胶质类芽孢杆菌(Paenibacillus mucilaginosus)。
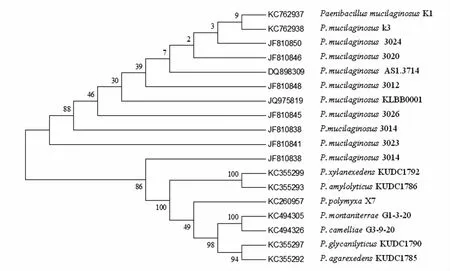
图3 菌株K1 和K3 的系统发育学地位Fig.3 The phylogenetic dendrogram of strains K1 and K3
2.2.4 菌株的解钾能力 摇瓶培养后,8 个菌株解钾能力的测定结果(表2)表明,它们的解钾能力存在较大差异,其中K3 的解钾能力最强,培养液中可溶性钾的含量达25.13 μg/mL,较对照组增加了56.57%;其次为K1,可溶性钾的含量达23.78 μg/mL,较对照组增加了48.16%;其余几株的解钾能力都比较低。因各菌在培养基中的生长量相当,都在10 万CFU/mL 数量级上,所以,可溶性钾含量的提高未能反映菌量的增加,而是反映了解钾能力存在很大差异。
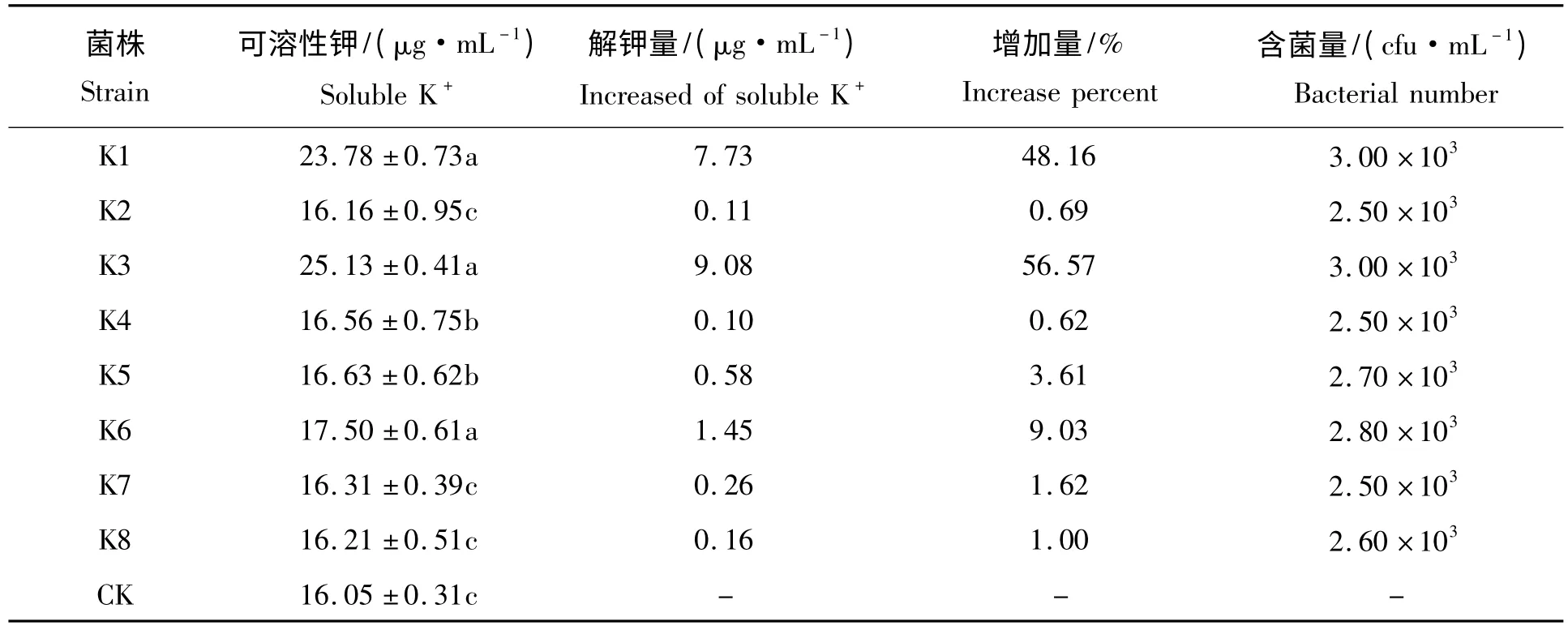
表2 硅酸盐细菌解钾能力的比较Tab.2 The comparison of the ability of the silicate bacteria to release K
2.3 促生长作用
在盆栽试验中,出苗期玉米的根长、株高、叶宽和鲜质量等性状测定的结果见表3。与对照相比,K3 处理对玉米促生长作用极显著,根长、株高、叶宽和鲜质量的净增率分别达到了72.51%、22.81%、14.06%和198.51%。在根长和株高方面,菌株K1、K3、K5、K6 处理显著地高于对照,但菌株K4 与对照没有显著差异;在鲜质量方面,各菌株处理亦显著地高于对照,但K5、K6 处理间没有显著差异;然而,各菌株处理的玉米叶片宽度与对照间无显著差异。
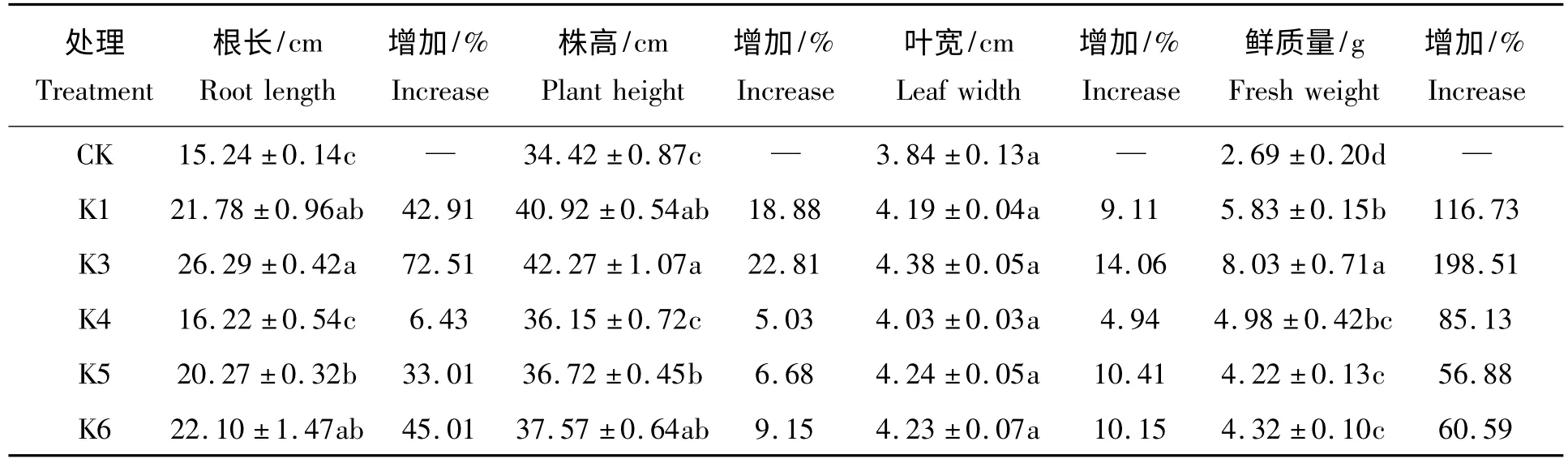
表3 硅酸盐细菌对玉米苗期的促生长效果Tab.3 Growth-promoting effect of the silicate bacteria on corn seedlings
3 结论与讨论
(1)本次试验在不同土壤中分离得到8 株类似于硅酸盐细菌的芽孢杆菌。通过菌落形态、表型和生理生化鉴定,以及对钾长石解钾能力的测定,结合16S rDNA 序列分析,将K1 和K3 初步鉴定为胶质类芽孢杆菌(Paenibacillus mucilaginosus)。这些菌株在硅酸盐细菌培养基和无氮培养基上的菌落形态与何琳燕等[20]的描述一致,表现出特有的生理生化性质,贺积强等[21]也对40 株来自紫色土的硅酸盐细菌进行了包括形态、生理生化特征等52 个表型性状的测试,均认为硅酸盐细菌具有生物多样性。这将为未来硅酸盐细菌作为生物钾肥提供基础材料。
(2)本试验中供试的胶质类芽孢杆菌具有一定的解钾能力,不同菌株的解钾能力存在差异。菌株K3 的解钾能力最强,培养液中可溶性钾的含量为:25.13 μg/g,较对照组增加了56.57%;其次菌株K1可溶性钾的含量为:23.78 μg/g,较对照组增加了48.16%。据相关资料显示,在缺磷源和钾源的培养基中胶质芽孢杆菌不能生长或者只能少量生长,而以不溶性磷灰石作为唯一磷源或以含钾矿物作为唯一钾源时,菌数分别比无磷对照增加5 000 ~12 600 倍,比无钾对照增加3.6 ~16.5 倍,同时进行定量分析发现磷释出率为0.12% ~0.18%,比空白对照水溶磷增加233% ~250%,而水溶钾增加65% ~87%(重量法)[22-23]。由此可见,胶质类芽孢杆菌的确具有一定的解钾能力,筛选出具有较强解钾能力的菌株将有利于微生物钾肥的研究。
(3)早在20 世纪50 年代,胶质类芽孢杆菌(过去称为硅酸盐细菌)菌剂(生物钾肥)对作物的增产效果在前苏联已有广泛研究[24]。本次试验通过对玉米盆栽实验发现,与对照组相比,K3 处理组对苗期玉米的影响最大,根长、株高、叶宽和鲜质量的净增率分别达到了72.51%、22.81%、14.06% 和198.51%,表现出显著的差异性。在其他工作者的研究结果中也发现硅酸盐细菌在玉米、苹果、辣椒上具有明显的促生效果。也有相关报道发现胶质类芽孢杆菌对各种喜钾作物如甘薯、烟草、棉花、水稻等有明显的增产作用[25-26]。由此可见,胶质类芽孢杆菌的确具有增产、促生长效果,但菌株K1 和K3 究竟适用于哪些作物,或对作物是否存在选择性?还有待下一步验证。
[1]Elsheikh M A,Eltilib A M,Elsheikh A E.A Note on the effect of phosphate rock,triple superphosphate,Bradyrhizobium and their combinations on the available soil phosphorus in Shambat clay soil[J].Journal of Agricultural sciences,2005,13(3):488 -493.
[2]连宾.硅酸盐细菌的初步研究与应用[M]//微生物肥料的生产应用及其发展.北京:中国农业科技出版社,1996:166-168.
[3]B·T 亚历山罗夫.硅酸盐细菌[M].叶维青,译.北京:科学出版社,1995:110 -111.
[4]湖南省益阳地区农科所.钾细菌肥料[M].北京:农业出版社,1978,66 -67.
[5]李元芳.硅酸盐细菌肥料的特性和作用[J].土壤肥料,1994,6(2):48 -49.
[6]连宾,Donald L S,傅平秋.硅酸细菌在工农业生产中的应用及其作用机理[J].贵州科学,2000,18(1):43 -54.
[7]吴洪生,陈佳宏,刘正柱.钾细菌制剂对土壤钾素的影响探讨[J].中国生态农业学报,2003,11(3):92 -94.
[8]刘五星,徐旭士,杨启银.胶质芽孢杆菌对土壤矿物的分解作用及机理研究[J].土壤,2004,36(5):547 -550.
[9]刘五星,杨启银,徐旭士.一株胶质芽孢杆菌的解钾能力[J].南京师范大学学报:自然科学版,2003,26(2):118-120.
[10]盛下放,黄为一.硅酸盐细菌nbt 菌株解钾机理初探[J].土壤学报,2002,39(6):863 -871.
[11]Malinovskaga I M,Kosenko L V,Votselk S K,et al.The role of Bacillus mucilaginosus polysaccharide in degradation of silicate minerals[J].Mikrobiologiya,1990,59(1):70 -78.
[12]陈金春,陈国强.微生物学实验指导[M].北京:清华大学出版社,2005:96.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43 -66,353 -358.
[14]Kim S B,Yoon J H,Kim H,et al.A Phylogenetic analysis of the genus Saccharomonospora conducted with 16SrRNA gene sequences[J].International Journal of Systematic Bacteriology,1995,45(2):351 -356.
[15]Rainey F A,Nanmi W R,Kroppenstedt R M,et al.The genus Nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage:proposal of Nocardiopsis farm. nov.[J]. International Journal of Systematic Bacteriology,1996,46(4):1088 -1092.
[16]Xie G L,Soad A,Swings J,et al.Diversity of gram negative bacteria antagonistic against major pathogens of rice from rice seed in the tropic environment[J].Journal of Zhejiang University-Science,2003,4(4):463:468.
[17]Tamura K,Dudley J,Nei M,et al.MEAG4:molecular evolutionary genetics analysis (MEGA)software version 4.0 Mol Biol Evol,2007,24(8):1596 -1599.
[18]全国农业技术推广中心.土壤理化分析实验指导书[M].北京:北京林业大学,2002:64 -68.
[19]赵艳,张晓波,郭伟.不同土壤胶质芽孢杆菌生理生化特征及其解钾活性[J].生态环境学报,2009,18(6):2283-2286.
[20]何琳燕,盛下放,陆光祥.不同土壤中硅酸盐细菌生理生化特征及其解钾活性的研究[J].土壤,2004,36(4):434-437.
[21]贺积强,李登煜,张小平,等.紫色土硅酸盐细菌的表型特征及溶磷解钾能力[J].应用与环境生物学报,2003,9(1):71 -77.
[22]陈廷伟.胶质芽孢杆菌分类名称及特性研究[J].土壤肥料,2002(4):5 -10.
[23]Hu X F,Chen J H,Guo J F.Two phosphate - and potassium -solubilizing bacteria isolated from Tianmu Mountain,Zhejiang,China[J].Word Journal of Microbiology & Biotechnology,2006,22:983 -990.
[24]刘五星,杨启银,徐旭士.硅酸盐细菌肥料的研究进展[J].天津农业科学,2003,9(4):39 -42.
[25]Xin L,Wu Z Q,Li W D,et al.Growth promoting effect of a transgenic Bacillus mucilaginosus on tobacco planting[J].Appl Microbiol Biotechnol,2007,74(5):1120 -1125.
[26]盛下放,黄为一.硅酸盐细菌的解钾作用及对棉花的增产效果[J].土壤,2001,33(3):163 -165.

