实时xCELLigence细胞分析系统在药物心脏毒性筛选中的应用
王淑颜,汪溪洁,马 璟
(中国医药工业研究院上海医药工业研究院国家上海新药安全评价研究中心,上海 201203)
心脏毒性是药物研发过程中需重点考虑的风险因素之一,1998-2008年,在美国有33%的药物因其心脏毒性而被撤市[1],这不仅给患者的用药安全带来极大的风险,也给制药公司带来了巨大的经济损失。
实时xCELLigence细胞分析系统(real time xCELLigence analysis system,RTCA)是一种基于电子阻抗的实时细胞检测系统,通过细胞与检测板底部电极的相互作用,可在近似生理环境下连续几天至几周实时、无标记、非侵入性动态地记录细胞增殖、细胞毒性和细胞形态的变化,为全面了解细胞的活性和运动性提供了一个更加精确、敏感的检测平台,可在新药研发的早期,合成出少量先导化合物阶段进行心脏毒性的评价,具有良好的应用前景。本文对RTCA的基本原理和其在药物心脏毒性筛选中的应用作一综述。
1 实时细胞分析系统的基本原理
RTCA是一种基于非标记性、非侵入性、动态实时细胞分析检测技术。1984年,Giaever和Keese[2]首次报道了利用电子阻抗技术无标记地检测细胞反应。在过去的20多年里,许多报道描述了使用此技术来监测细胞活动,包括细胞的黏附、传播和活化[3],细胞形态和由多种因素造成的形态改变[4-5],细胞迁徙[6]和细胞对毒性化合物的反应[7-8],此技术在细胞生物领域得到了广泛的应用。如Kustermann等[9]运用RTCA监测NIH3T3小鼠成纤维细胞的毒性和增殖能力,来鉴别细胞抑制剂、细胞毒药物和非毒性药物。Irelan等[10]利用此技术定量的检测细胞的质量特性及功能,Ke等[11]监测HeLa细胞的生存能力等。2011年,由美国艾森生物和罗氏共同推出了xCELLigence RTCA Cardio(以下简称Cardio),它可以记录体外培养的心肌细胞搏动的频率、节律、振幅、搏动持续时间以及搏动频率的不规则指数等指标。对药物引起的心肌细胞毒性有了更全面的认识,这种新的研究手段,用特征性的心肌细胞搏动图谱反映心律失常,这是传统电生理学研究方法所不能实现的。
RTCA由4部分组成,即电子微量滴定板、细胞实时监测阻抗记录单元、实时细胞分析单元和实时细胞数据处理及阻抗转换为细胞指数单位[12-14]。该系统将微电极细胞传感器芯片整合到表面适于细胞贴附与生长检测板的底部。微电极阻抗主要是由点及周边离子环境所决定,当电场加在上面时即可测得一个基线阻抗。细胞的有无以及贴壁程度的改变都会影响电极传感器表面电子和离子的通过。无细胞时,检测孔底部排列的微电极阵列的阻抗分布近似均匀;加入细胞后,细胞和电极表面接触黏附,影响电极溶液间的离子环境,导致阻抗的升高,细胞越多,阻抗增加越高,这种阻抗的变化即可通过算法换算成细胞指数表示。细胞在上述表面上的贴壁或生长可引起各个阵列的电极结构的阻抗变化,细胞贴壁程度紧密与否也会使电阻抗发生变化。因此,黏附在电极表面的细胞越多,细胞指数越大(图1)。同样,细胞与电极表面黏附越紧密伸展,电阻抗增加越大。测得的电极间的阻抗反映关于电极上细胞生物状态的重要信息。当细胞的生物状态发生变化时,系统即可实时并自动获取模拟电信号,并转变成数字信号进行进一步分析。因此,电阻抗即为细胞指数值,反映细胞生长、伸展、形态变化、死亡和贴壁程度等一系列生理状态[15]。
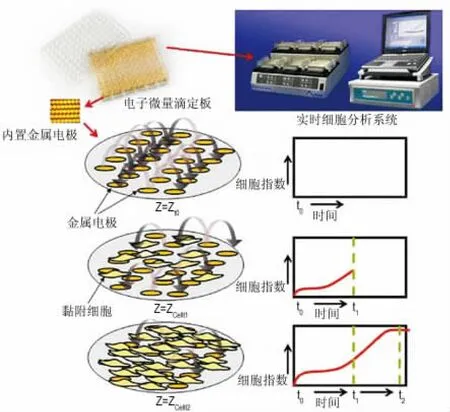
图1 实时细胞分析系统(RTCA)原理图.
基于上述原理,将心肌细胞接种于含有微电极的培养板上,当心肌收缩和舒张时,引起阻抗变化,将阻抗变化换算成细胞指数,在10 kHz时,细胞指数 =(样本阻抗-基线阻抗)/15,即可观察心肌细胞搏动频率、节律幅度以及活性的变化。Cardio将所得的数据应用软件分析系统分析其心率变异性(heart rate variability,HRV)。HRV 的 Poincaréplots是以RR间期序列{RRi}(i=1,2,……,N)中的相邻两点(RRi,RRi+1)为坐标在图中用散点标记出逐拍心跳。大量的散点形成一个相对密集的散点区域,其不同形态反映了不同的心率变异信息[16]。通常情况下,Poincaréplots所用的3个指数为:SD1,即短轴表示RR间期短时变化的标准差;SD2,即长轴表示RR间期长时变化的标准差;R,即轴率(R=SD1/SD2)。抗组胺类药物特非那定其潜在的hERG通道阻滞作用,引起QT间期延长,导致尖端扭转型室性心动过速(图2A,B)而被撤出市场。特非那定并不引起明显的振幅变化(图2C),却引起明显的搏动幅度的峰值时间的下降(图2D)所示。给予特非那定0.1μmol·L-1后,和对照组相比,SD1 由12.6 下降到6.2 ms,SD2 由101.5 下降到49.4 ms;而给予特非那定10μmol·L-1后,SD1和SD2分别增长到21.2和172.9 ms(图2E)。通过以上指数证实,高浓度的特非那定使人诱导性多能干细胞诱导心肌细胞(human induced pluripotent stem cell-derived cardiomyocyte,hiPSC-CM)的搏动信号极其不规则[17]。由此可见,Cardio可以检测潜在的QT间期延长、心脏冲动形成和传导异常导致的心律失常,预测药物对心肌细胞潜在的毒性。
2 实时细胞分析系统在药物心脏毒性筛选中的应用
心律失常是药物导致心脏毒性的主要原因,由于心肌细胞膜上钠、钾、钙离子的定向性和选择性运动产生电荷、协调心肌细胞的收缩,所以,任何干扰这些离子通道的药物均有可能导致心律异常[18]。传统的电生理学研究方法操作复杂,不能对心肌细胞进行长时间持续性的动态监测,且对非离子通道药物可能引起的心脏毒性无法监测;而体内动物实验成本高、周期长、工作量大以及需用的化合物量大无法完成高通量检测。
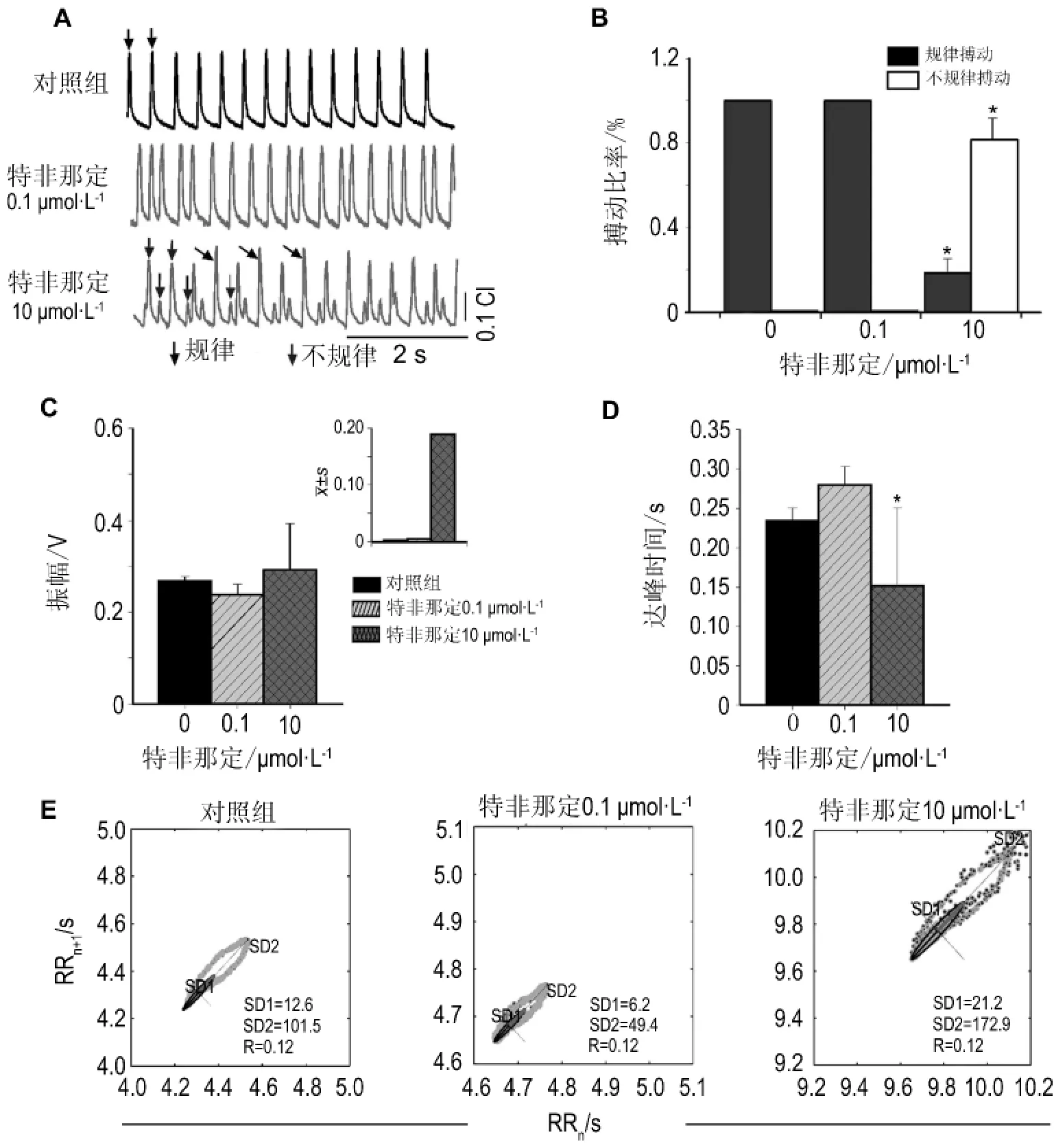
图2 特非那定对人诱导性多能干细胞诱导分化的心肌细胞(hiPS-CM)活性变化的影响[12].A:搏动曲线;B:搏动比率;C:Poincaréplots分析的搏动信号振幅的分布;D:自发性心肌细胞搏动幅度的达峰时间;E:达峰时间.
Cardio将基于阻抗的实时细胞分析技术运用到心脏毒性的检测领域,相对于传统体外、体内实验方法,它可以在近似生理的细胞环境下持续短时或长时的监测心肌细胞的搏动情况、生理状态以及活力改变,快速获得更多有效及重要的数据,从而保证了实验的持续性、重复性和数据的质量。有效避免假阴性,具有高的特异性和灵敏性,相对简单的操作。能更多使用生理学相关细胞而非基因工程细胞进行实验,结果的可信性更高,通量更大,且可长时间监测。因此,该系统可在早期检测离子通道及非离子通道药物的心肌细胞调节作用,预测药物潜在的心脏毒性,为药物心脏毒性的安全性评价及优化提供了崭新的平台。
2.1 Cardio检测的各种指标与心脏毒性的关系
心率是Cardio监测的主要指标,传统上心率是指心脏每分钟搏动的次数,在此是指心肌细胞每分钟搏动的次数。心率与药物的心脏毒性有着密切的关系,因为心率增加可引起多种疾病。Inoue等[19]报道,随着心率的升高,高血压的发病率不断增加。有研究表明,静息心率可作为冠心病的预测因子,INVEST研究表明,高血压伴有冠心病的老年患者,基础心率比较高,用维拉帕米或阿替洛尔治疗后,静息心率过高或者过低,均增加死亡风险[20]。心率增加还可引起多种严重的心脏疾病,如心肌梗死[21]、心房颤动[22-23]及心力衰竭[24]等。
节律也是Cardio监测的主要指标之一。体内试验中,节律是指心电监测仪上呈现出的心脏搏动的节奏和规律;在Cardio监测的体外实验中,节律是指心肌细胞搏动的节奏和规律。节律异常的表现形式多种多样,早后除极是最常见的节律紊乱,也是诱发尖端扭转型室性心动过速的主要因素[25]。而慢性心力衰竭与心肌细胞的节律和收缩性有着密切的关系[26]。
Cardio系统还可以测得心肌细胞搏动的幅度,这个测量指标在心肌细胞搏动图谱上被定义为一个负峰值和下一个正峰值之间的距离。2个正峰值之间的时间被称之为心肌细胞的搏动间期,这两个指数均与心肌细胞的兴奋-收缩耦联间期相对应。该系统还可以测得3个与时间相关的参数,在心肌细胞搏动图谱上被称之为上升时间、达峰时间和衰减时间,呈现出心肌细胞搏动的时间特征。由Cardio及Poincaréplots分析系统提供的关于HRV即逐次心跳的RR间期间存在的微小差异或涨落现象的数据,为药物心脏毒性的评价,提供了更加精确的信息。HRV受心脏交感神经和副交感神经等多种因素的影响,交感神经活动增强时HRV减小,副交感神经活动增加时HRV增加。多种心脏疾病于交感神经和副交感神经的紧张性和均衡性有关系,如急性心肌梗死、心力衰竭患者的交感神经张力升高,副交感神经张力下降[27]。
2.2 Cardio在心脏毒性评价中的应用
Cardio系统是药物临床前早期筛选的一个重要工具,能将心肌细胞对引起心律失常的药物的响应用特征性的搏动图谱呈现,进而检测时间分辨率。该系统结合心肌细胞的物理搏动特性,可以非常简便地检测此类药物的作用。同时,通过动态监测保证了心肌细胞瞬时响应及长时效应的获取。该方法通过实时记录分析药物的心率、节律及HRV的变化,更加精确,敏感地评价药物的心脏毒性,有效地降低传统终点法和单一离子通道等检测方法的假阴性率,减少了药物心脏毒性给制药公司带来的经济损失。Cardio可用于原代培养心肌细胞、胚胎干细胞诱导心肌细胞(embryonic stem cellderived cardiomyocyte,ESC-CM)、hiPSC-CM、小鼠 iPSC-CM(miPSC-CM)的研究,检测药物对心肌细胞的毒性作用。如表1所示,最近,Jonsson等[28]利用Cardio系统检测多种已知作用的化合物对hiPSC-CM和mESC-CM的作用,并得到精确的结果,证明了该系统可以全面精确地检测化合物的心脏毒性。如L-型Ca2+通道阻滞剂氨氯地平在第2次给药后引起人iPSC-CM搏动消失,在第1次给药后引起小鼠ESC-CM搏动消失,这说明给药浓度太高,而出现急性毒性。T-型Ca2+通道阻滞剂米贝地尔在2次给药后基本不影响人iPSC-CM的搏动情况;在第1次给药后抑制2个平行剂量组大鼠ESC-CM的搏动,在第2次给药后抑制了所有(6个平行剂量组)大鼠ESC-CM的搏动。hERG通道抑制剂E-4031,在第1次给药后引起人iPSC-CM搏动的次数由基础值44±1降为22±3,降低了45%并伴有5个平行剂量组的搏动不规则,在第2次给药后2个平行剂量组出现搏动不规则,2个平行剂量组搏动的振幅<0.02CI;大鼠ESC-CM的搏动次数在第1次给药后由177±5降为161±8,降低了9%并有2个平行剂量组搏动不规则,在第2次给药后,降为153±10,降低了15%且搏动不规则消失。这7种化合物分别作用于不同的靶点,给予不同浓度的药物后,Cardio均能精确地检测出它们对hiPSC-CM和mESC-CM心率的影响。同时,Nguemo等[17]应用 Cardio和 Poincaréplots分析系统评价了异丙肾上腺素、卡巴胆碱、特非那丁、索他洛尔和多柔比星的心脏毒性,并联合了膜片钳技术进行了验证。Cardio可以在近似生理环境下同时监测药物对多个离子通道作用,以及药物物之间的相互作用,且具有高通量性、高特异性和高敏感性。
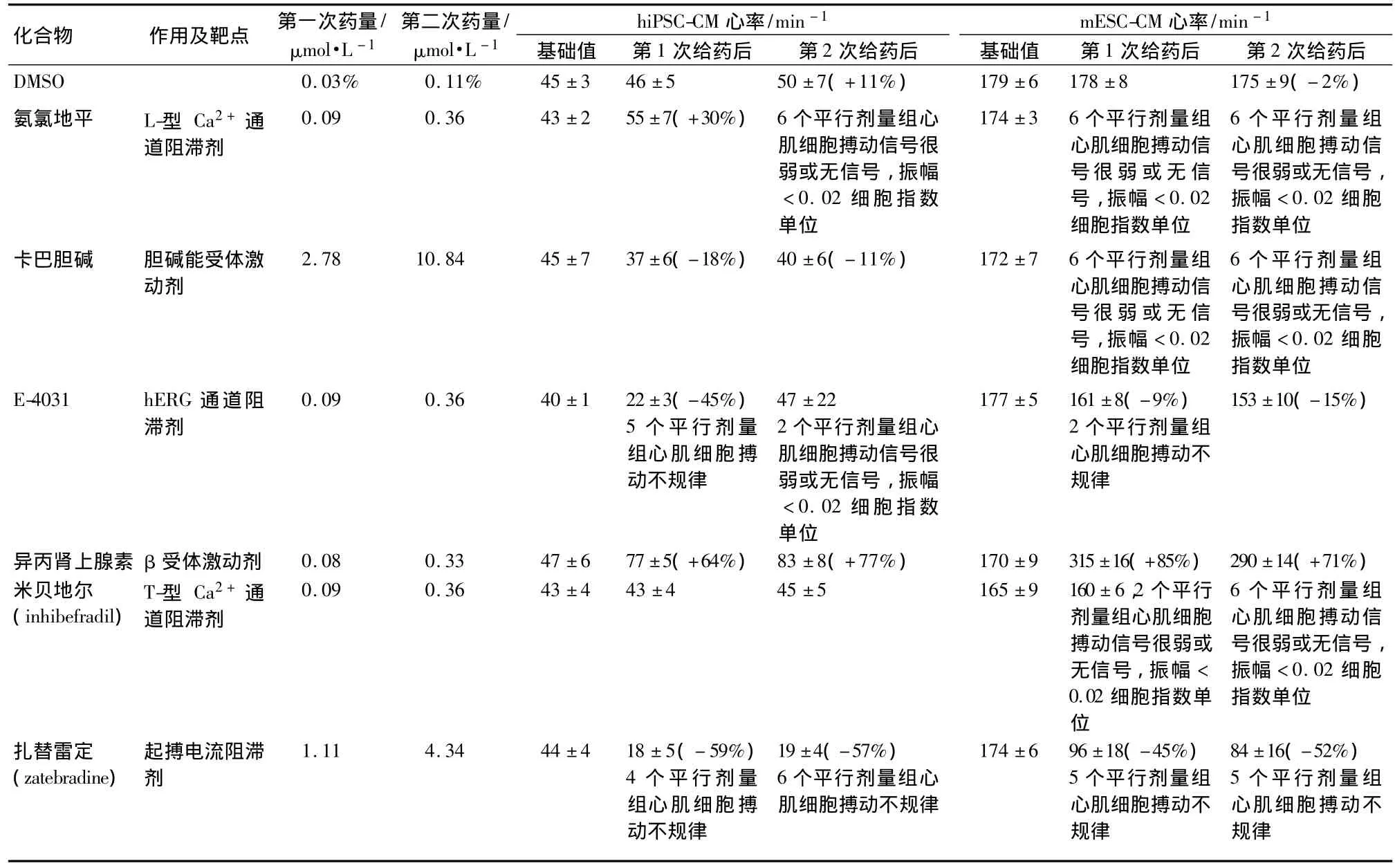
表1 两种浓度的7种化合物对hiPSC-CM和大鼠胚胎干细胞诱导心肌细胞(mESC-CM)心率的影响[28]
Abassi等[29]利用Cardio预测药物(离子通道调节剂、hERG通道抑制剂、诱发尖端扭转心率失常的药物等)的临床前心脏毒性。如运用Cardio记录mESC-CM给予L-型钙离子通道阻滞剂伊拉地平(isradipine)、hERG通道抑制剂E4301、钠离子通道抑制剂河豚毒素、β-受体激动剂异丙肾上腺素后,24 h心肌细胞的搏动情况。第1小时每分钟记录1次,第2小时每5 min记录1次,第3~24小时每15 min记录1次,每次记录时间为20 s。Cardio软件分析获得数据,计算搏动的次数、节律、幅度以及搏动持续时间等,为评价药物的早期心脏毒性提供大量的信息。该系统敏感、定量地检测出了影响心脏调节功能的物质,包括一些被传统电生理学方法所遗漏的药物。另外,该系统还被广泛地应用于细胞形态学改变、凋亡、死亡和G蛋白耦联受体激动作用的监测[30]。
综上所述,Cardio可以在早期敏感而准确地检测出药物潜在的心脏毒性,该心肌细胞分析系统已迅速地被药物企业及生物技术公司接受。当前辉瑞、罗氏和GSK等国外大型制药公司都以开始使用此技术进行药物和候选化合物常规心脏毒性的筛选研究,并进行了联合验证,准备向FDA和ICH推荐此技术,希望能把该技术列为和hERG技术同等重要的地位。美国FDA在2012年10月购买了Cardio实时心肌细胞分析系统,这正是该系统被制药领域认可的延伸表现。
3 展望
近年来,越来越多的技术应用于药物心脏毒性筛选和评价中。Cardio作为一个新兴的技术,具有高敏感性、高通量、低成本和高效率等优点,通过在近似生理环境下,实时记录分析心肌细胞的搏动情况、形态改变等,可以早期预测和评价药物潜在的心脏毒性,降低新药研发的风险。但该方法也存在局限性,Cardio无法清楚解释药物是通过何种途径(如钾、钠、钙离子通道,心肌细胞坏死等)诱发心脏毒性,尚不能取代传统的电生理学研究方法。如能将Cardio技术与电生理学技术、分子生物学技术及组学技术等有机地结合运用,相互补充,取长补短,必将能更加全面深入地预测和评价各种离子通道和非离子通道药物引起的心脏毒性,从而更加有效地降低新药研发的风险。
[1]MacDonald JS,Robertson RT.Toxicity testing in the 21st Century:a view from the pharmaceutical industry[J].Toxicol Sci,2009,110(1):40-46.
[2]Giaever I, Keese CR. Monitoring fibroblast behavior in tissue culture with an applied electric field[J].Proc Natl Acad Sci USA,1984,81(12):3761-3764.
[3]Kowolenko M,Keese CR,Lawrence DA,Giaever I.Measurement of macrophage adherence and spreading with weak electric fields[J].J Immunol Methods,1990,127(1):71-77.
[4]Giaever I, Keese CR. A morphological biosensor for mammalian cells[J].Nature,1993,366(6455):591-592.
[5]Wang HS, Keese CR, Giaever I, Smith TJ.Prostaglandin E2alters human orbital fibroblast shape through a mechanism involving the generation of cyclic adenosine monophosphate[J].J Clin Endocrinol Metab,1995,80(12):3553-3560.
[6]Keese CR,Bhawe K,Wegener J,Giaever I.Real-time impedance assay to follow the invasive activities of metastatic cells in culture[J].Biotechniques,2002,33(4):842-844,846,848-850.
[7]Xiao C,Lachance B,Sunahara G,Luong JH.Assessment of cytotoxicity using electric cell-substrate impedance sensing:concentration and time response function approach[J].Anal Chem,2002,74(22):5748-5753.
[8]Xiao C,Luong JH.On-line monitoring of cell growth and cytotoxicity using electric cell-substrate impedance sensing(ECIS)[J].Biotechnol Prog,2003,19(3):1000-1005.
[9]Kustermann S,Boess F,Buness A,Schmitz M,Watzele M,Weiser T,et al.A label-free,impedance-based real time assay to identify drug-induced toxicities and differentiate cytostatic from cytotoxic effects[J/OL].Toxicol in Vitro(2012-08-28),http://dx.doi.org/10.1016/j.tiv.2012.08.019
[10]Irelan JT,Wu MJ,Morgan J,Ke N,Xi B,Wang X,et al.Rapid and quantitative assessment of cell quality,identity,and functionality for cellbased assays using real-time cellular analysis[J].J Biomol Screen,2011,16(3):313-322.
[11]Ke N,Wang X,Xu X,Abassi YA.The xCELLigence system for real-time and label-free monitoring of cell viability[J].Methods Mol Biol,2011,740:33-43.
[12]Solly K,Wang X,Xu X,Strulovici B,Zheng W.Application of real-time cell electronic sensing(RT-CES)technology to cell-based assays[J].Assay Drug Dev Technol,2004,2(4):363-372.
[13]Atienza JM,Yu N,Kirstein SL,Xi B,Wang X,Xu X,et al.Dynamic and label-free cell-based assays using the real-time cell electronic sensing system[J].Assay Drug Dev Technol,2006,4(5):597-607.
[14]Ryder AB,Huang Y,Li H,Zheng M,Wang X,Stratton CW,et al.Assessment of Clostridium difficile infections by quantitative detection of tcdB toxin by use of a real-time cell analysis system[J].J Clin Microbiol,2010,48(11):4129-4134.
[15]Che Y.Microelectronic cell sensor chip based on the resistance[J].ChinJ Mod Appl Pharm(中国现代应用药学),2008,25(8):783-786.
[16]Huo CY,Zhuang JJ,Huang XL,Hou FZ,Ning XB.Heart rate variability analysis based on modified Poincaréplot[J].Acta Phys Sin(物理学报),2012,61(19):1-8.
[17]Nguemo F,Šari'c T,Pfannkuche K,Watzele M,Reppel M,Hescheler J.In vitro model for assessing arrhythmogenic properties of drugs based on high-resolution impedance measurements[J].Cell Physiol Biochem,2012,29(5-6):819-832.
[18]Anson BD,Kolaja KL,Kamp TJ.Opportunities for use of human iPScells in predictive toxicology[J].Clin Pharmacol Ther,2011,89(5):754-758.
[19]Inoue T,Iseki K,Iseki C,Kinjo K,Ohya Y,Takishita S.Higher heart rate predicts the risk of developing hypertension in a normotensive screened cohort[J].Circ J,2007,71(11):1755-1760.
[20]Kolloch R,Legler UF,Champion A,Cooper-Dehoff RM,Handberg E,Zhou Q,et al.Impact of resting heart rate on outcomes in hypertensive patients with coronary artery disease:findings from the International verapamil-SR/trandolapril study(INVEST)[J].Eur Heart J,2008,29(10):1327-1334.
[21]Fox K,Ford I,Steg PG,Tendera M,Ferrari R;BEAUTIFUL Investigators.Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction(BEAUTIFUL):a randomised,double-blind,placebo-controlled trial[J].Lancet,2008,372(9641):807-816.
[22]Van Gelder IC,Groenveld HF,Crijns HJ,Tuininga YS,Tijssen JG,Alings AM,et al.Lenient versus strict rate control in patients with atrial fibrillation[J].N Engl J Med,2010 ,362(15):1363-1373.
[23]Groenveld HF, Crijns HJ, Rienstra M, Van den Berg MP,Van Veldhuisen DJ,Van Gelder IC,et al.Does intensity of rate control influence outcome in persistent atrial fibrillation?Data of the RACE study[J].Am Heart J,2009,158(5):785-791.
[24]Böhm M,Swedberg K,Komajda M,Borer JS,Ford I,Dubost-Brama A,et al.Heart rate as a risk factor in chronic heart failure(SHIFT):the association between heart rate and outcomes in a randomised placebo-controlled trial[J].Lancet,2010,376(9744):886-894.
[25]Picard S,Goineau S,Guillaume P,Henry J,Hanouz JL,Rouet R.Supplemental studies for cardiovascular risk assessment in safety pharmacology:a critical overview[J].Cardiovasc Toxicol,2011,11(4):285-307.
[26]Undrovinas A,Maltsev VA.Late sodium current is a new therapeutic target to improve contractility and rhythm in failing heart[J].Cardiovasc Hematol Agents Med Chem,2008,6(4):348-359.
[27]Hao M.Analysis and clinical significance of heart rate viability[J].Med Equip(医疗装备),2008,6:31-34.
[28]Jonsson MK,Wang QD,Becker B.Impedance-based detection of beating rhythm and proarrhythmic effects of compounds on stem cell-derived cardiomyocytes[J].Assay Drug Dev Technol,2011,9(6):589-599.
[29]Abassi YA,Xi B,Li N,Ouyang W,Seiler A,Watzele M,et al.Dynamic monitoring of beating periodicity of stem cell-derived cardiomyocytes as a predictive tool for preclinical safety assessment[J].Br J Pharmacol,2012,165(5):1424-1441.
[30]Schwarzenberger T,Wolf P,Brischwein M,Kleinhans R,Demmel F,Lechner A,et al.Impedance sensor technology for cell-based assays in the framework of a high-content screening system[J].Physiol Meas,2011,32(7):977-993.

