泊洛沙姆对再生丝素蛋白凝胶化结构及形态的影响
邓春闽,钟天翼,许亚娟,岳晓晓,明津法,左保齐
(现代丝绸国家工程实验室,江苏苏州215123;苏州大学纺织与服装工程学院,江苏苏州215006)
丝素蛋白(SF)是由家蚕丝腺内皮细胞合成、分泌而成的一种天然蛋白质,可从蚕丝中提取,富含甘氨酸、丙氨酸、丝氨酸等20种氨基酸[1]。丝素具有优良的物理机械性能[2]、降解性能[3],用作生物材料时对机体无毒性、致敏性和刺激作用,降解产物不会引起炎症反应[4],与人体组织有优良的生物相容性,被认为是一种有望在医用材料领域开发利用的天然高分子材料。
在一定条件下,由于亲疏水、氢键、静电等多种因素共同作用,再生丝素蛋白(RSF)溶液容易发生凝胶化,其分子结构由无规卷曲转变为β-折叠结构[5]。该凝胶柔软、可塑,对于气体、低分子物质或某些高分子物质具有选择透过性,是制备人工皮肤、隐形眼镜、药物缓释载体、酶固定化载体、细胞培养支架等生物医用材料的良好载体[6-8]。再生丝素蛋白溶液的凝胶化过程因受丝素浓度、温度、pH值、金属离子和剪切作用等因素影响,在人生理条件下凝胶速度较慢,限制了其在生物医学领域的应用。
泊洛沙姆(Poloxamer)作为聚氧乙烯-聚氧丙烯醚嵌段共聚物,是一种新型的高分子非离子表面活性剂,其亲油基为聚氧丙烯,亲水基为聚氧乙烯,相对分子质量分布范围为1 000~7 000。非离子型表面活性剂在水溶液中不电离,其亲水基主要是由具有一定数量的含氧基团(醚基或羟基)与水构成氢键从而实现溶解,正是这一特点决定了非离子型表面活性剂在某些方面比离子型优越。而且泊洛沙姆作为一类优良的药物制剂新辅料,无毒,对皮肤粘膜无刺激性、过敏性,对人体十分安全,现已广泛用于制药工业,主要作乳化剂、稳定剂、增溶剂和分散剂。组成泊洛沙姆的聚氧乙烯﹣聚氧丙烯的比例及各自相对分子质量的不同,可以使其拥有不同的亲油水平衡值,即不同的亲疏水性。由于再生丝素蛋白溶液的凝胶化涉及亲疏水作用,而泊洛沙姆具有可调的亲疏水性,所以选择泊洛沙姆来调控再生丝素蛋白溶液的凝胶化转变,可扩大丝素水凝胶在生物医用方面的应用。
本研究主要通过泊洛沙姆与再生丝素蛋白溶液共混,加快丝素溶液的凝胶化转变速度,并对由不同相对分子质量的泊洛沙姆和共混比例形成的RSF-Poloxamer水凝胶的结构和形态进行了分析,探讨了泊洛沙姆的亲疏水性对再生丝素蛋白溶液凝胶化的影响。
1 实验
1.1 实验材料
无水碳酸钠(Na2CO3)(化学纯,上海兴达化学试剂厂);溴化锂(LiBr·H2O)(化学纯,上海恒信化学试剂有限公司);桑蚕丝(浙江湖州);不同相对分子质量的泊洛沙姆:泊洛沙姆P188(相对分子质量1 800,聚氧乙烯80%),泊洛沙姆P338(相对分子质量3 300,聚氧乙烯80%),泊洛沙姆P407(相对分子质量4 000,聚氧乙烯70%)(Sigma,美国)。
1.2 RSF-Poloxamer水凝胶
用质量分数0.5%的碳酸钠溶液对桑蚕丝脱胶,浴比1︰20,在沸水中煮30 min,然后用去离子水洗涤,如此反复进行3次。
将脱胶的桑蚕丝溶于LiBr︰C2H5OH=40︰60溶液中,恒温(80±2)℃水浴搅拌溶解获得再生丝素溶液,经冷却以后,将丝素溶液注入8 000~14 000的透析袋中,用自来水流动透析1 d,再用去离子水透析2 d,得到纯丝素水溶液。最后将丝素水溶液质量分数调控到3%。
将不同相对分子质量的泊洛沙姆与再生丝素水溶液分别以 3种质量比 1︰3、1︰1、3︰1共混均匀,37℃静置至形成水凝胶。将制备好的RSF-Poloxamer水凝胶置于冰箱中冷冻1 d。然后再将冷冻样品放入台式冷冻干燥机(LGJ,北京四环科学仪器厂),-50℃下冷冻干燥3 d后,取出干燥凝胶准备测试。
1.3 主要测试方法
采用美国Nicolet5700型的红外光谱仪进行测试,波数范围为2 000 cm-1~1 000 cm-1,光谱分辨率为4 cm-1,得到凝胶的分子结构;采用荷兰PANalytical公司的X Pert-Pro MPD全自动X射线衍射仪(CuKα射线,管电压40 kV,管电流40 mA,扫描速度2 °/min,衍射角度2θ为5°~45°)测得凝胶的结晶结构;采用美国TA公司热分析仪(高纯氮气保护,氮气流量20.0 mL/min,温度范围 50.00 ~600.00 ℃,升温速率10.00℃/min)测定样品的热性能变化。采用日本日立公司S4800扫描电镜观察凝胶的横纵截面形态。
2 结果与讨论
2.1 泊洛沙姆对再生丝素溶液凝胶化时间的影响
纯丝素溶液在实验条件下(37℃)要2周以上才能形成水凝胶,从泊洛沙姆对再生丝素溶液凝胶化时间的影响(表1)可以明显看出,泊洛沙姆与再生丝素共混后极大地加速了再生丝素的凝胶化转变,并且共混溶液中泊洛沙姆的相对分子质量越小,所占的共混比例越大,其凝胶化时间越短。同时,结果还表明,可以通过调节泊洛沙姆的相对分子质量和共混比例这两个因素来控制RSF-Poloxamer水凝胶的凝胶速度,有望在短时间内快速形成水凝胶。

表1 不同相对分子质量和共混比例组成的RSF-Poloxamer溶液的凝胶化时间Tab.1 Gelation time of RSF-Poloxamer solution with different relative molecular masses and blending ratios
泊洛沙姆属于非离子型表面活性剂,亲水亲油平衡值(HLB值)表示表面活性剂亲水或亲油能力的大小。HLB值越大,其亲水性越强,HLB值越小,其亲油性越强。亲水亲油转折点为HLB=10时,小于10时为亲油性,大于10为亲水性。根据HLB=7+4.02 log(1/[CMC]),(CMC 为表面活性剂的临界胶束浓度),可以得出泊洛沙姆的HLB值(表2)。

表2 不同泊洛沙姆的HLB值Tab.2 HLB quantitative values of different poloxamers
由表2可见,泊洛沙姆的HLB值均大于10,所以都属于亲水性,且P188亲水性最强,这与其相对分子质量较小有关。比较RSF-Poloxamer水凝胶的凝胶化时间规律可以得出:泊洛沙姆的相对分子质量越小,其亲水性越强,促进再生丝素溶液凝胶化的转变越快。
2.2 分子构象研究(FTIR)
红外光谱法具有操作简单、重复性好、精度较高等优点,同时又可以对结构进行深入研究,在聚合物材料的应用研究中受到学者的广泛关注[9]。图1A、B、C分别为泊洛沙姆P188、P338和P407与再生丝素溶液共混形成RSF-Poloxamer水凝胶后的红外光谱图。
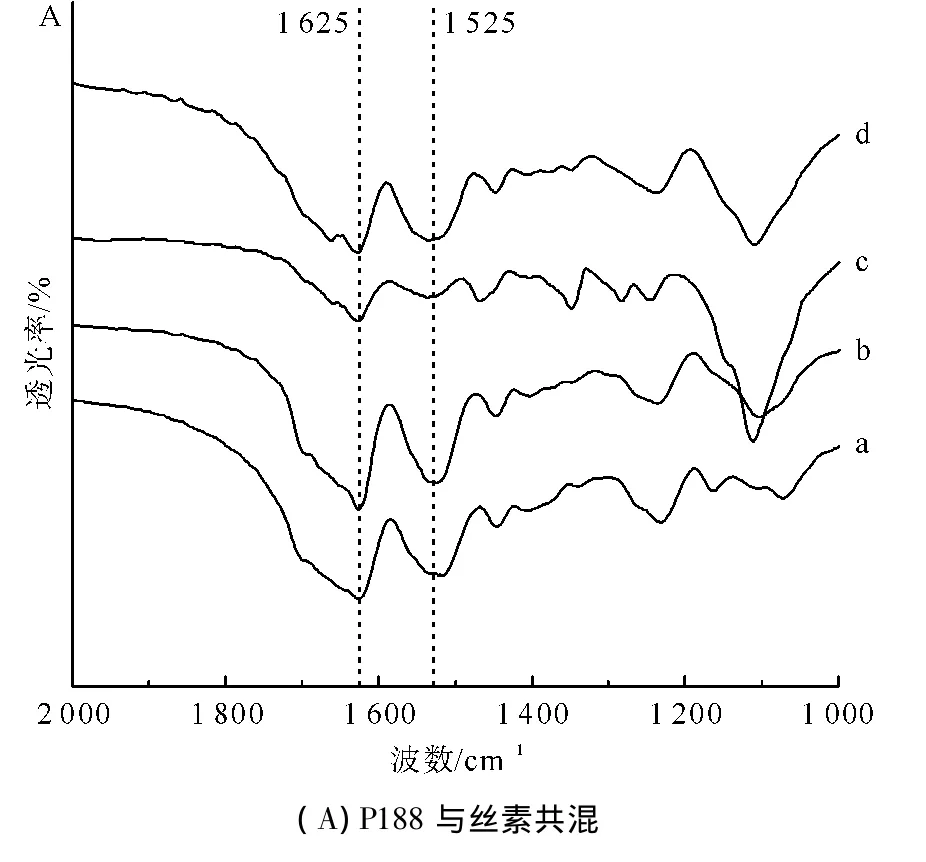
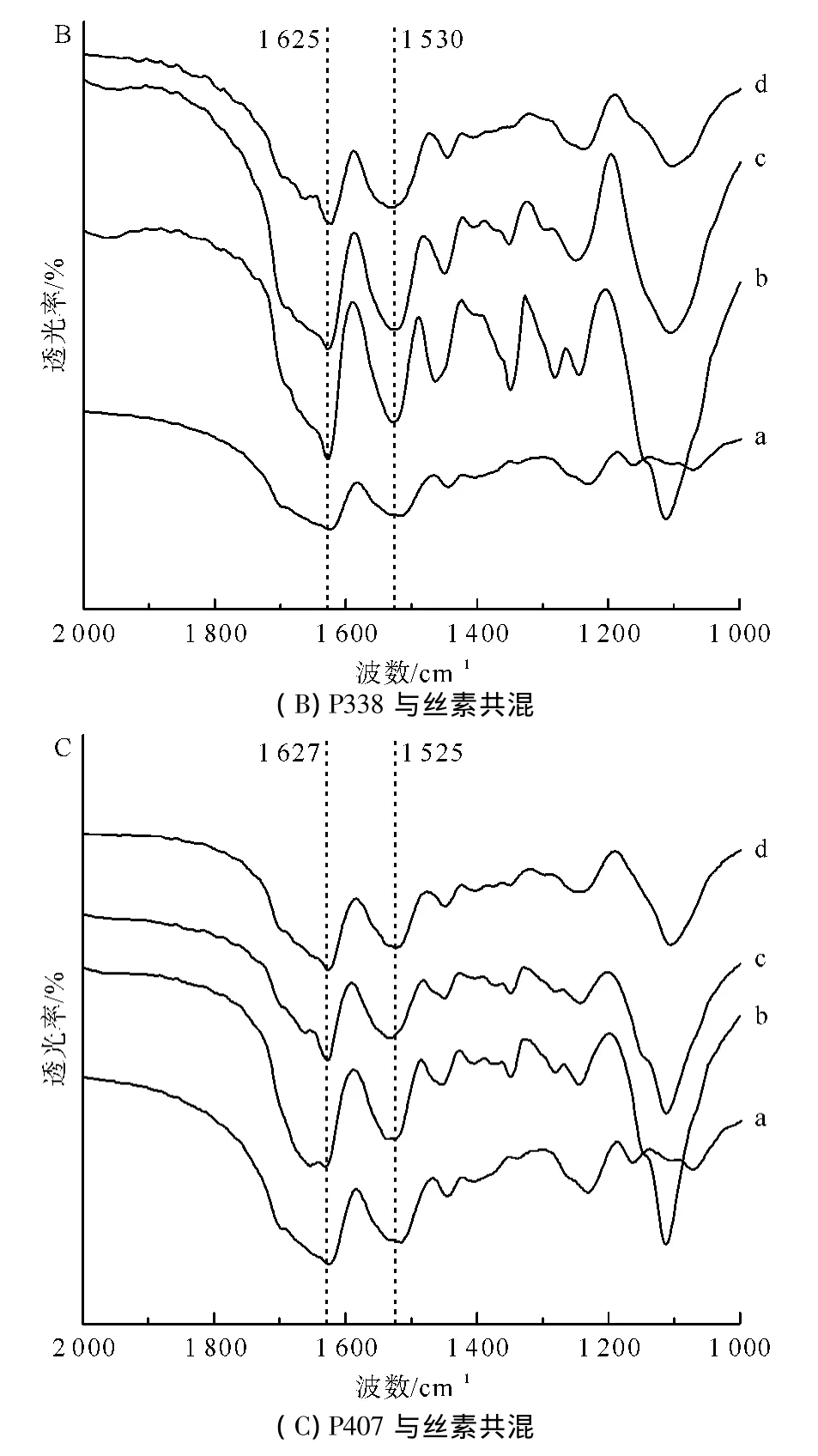
图1 不同相对分子质量和共混比例组成的RSF-Poloxamer水凝胶与纯丝素水凝胶的对比红外光谱图Fig.1 Comparison of infrared spectrogram of RSF-Poloxamer hydrogel with different relative molecular masses and blending ratios and pure silk fibroin hydrogel
丝素的酰胺I区(1700~1600 cm-1)散射峰和酰胺Ⅱ区(1600~1500 cm-1)散射峰指认目前已比较成熟,纯丝素水凝胶酰胺I和酰胺Ⅱ的特征峰分别在1625cm-1和1517cm-1,蛋白质二次结构都归属于β-折叠构象,可见纯丝素水凝胶以β-折叠构象为主。RSF-Poloxamer水凝胶的酰胺I和酰胺Ⅱ的特征峰分别在1625cm-1和1525cm-1左右,其蛋白质二次结构也主要归属于β-折叠构象。对比纯丝素水凝胶,其酰胺I的特征峰位置几乎没有改变,但酰胺Ⅱ的特征峰位置则略往高波数偏移,说明不同相对分子质量和共混比例的泊洛沙姆对丝素二次结构的改变很小,在RSF-Poloxamer水凝胶中,丝素分子仍然是以β-折叠构象为主。这个结果也表明,泊洛沙姆只是加快了再生丝素溶液凝胶化中的结构转变过程,并没有或者很少改变其最终形成水凝胶后的结构。
2.3 结晶结构分析(XRD)
图2A、B、C分别为泊洛沙姆P188、P338和P407与再生丝素溶液共混形成SF-Poloxamer水凝胶后的XRD谱图。
一般认为丝素的结晶结构分为:无定形结构、Silk I和SilkⅡ结构。其中Silk I的主要衍射峰为12.2、19.7、24.7°和 28.2°,而 Silk Ⅱ的主要衍射峰为 9.1、18.9、20.7°和 24.0°。
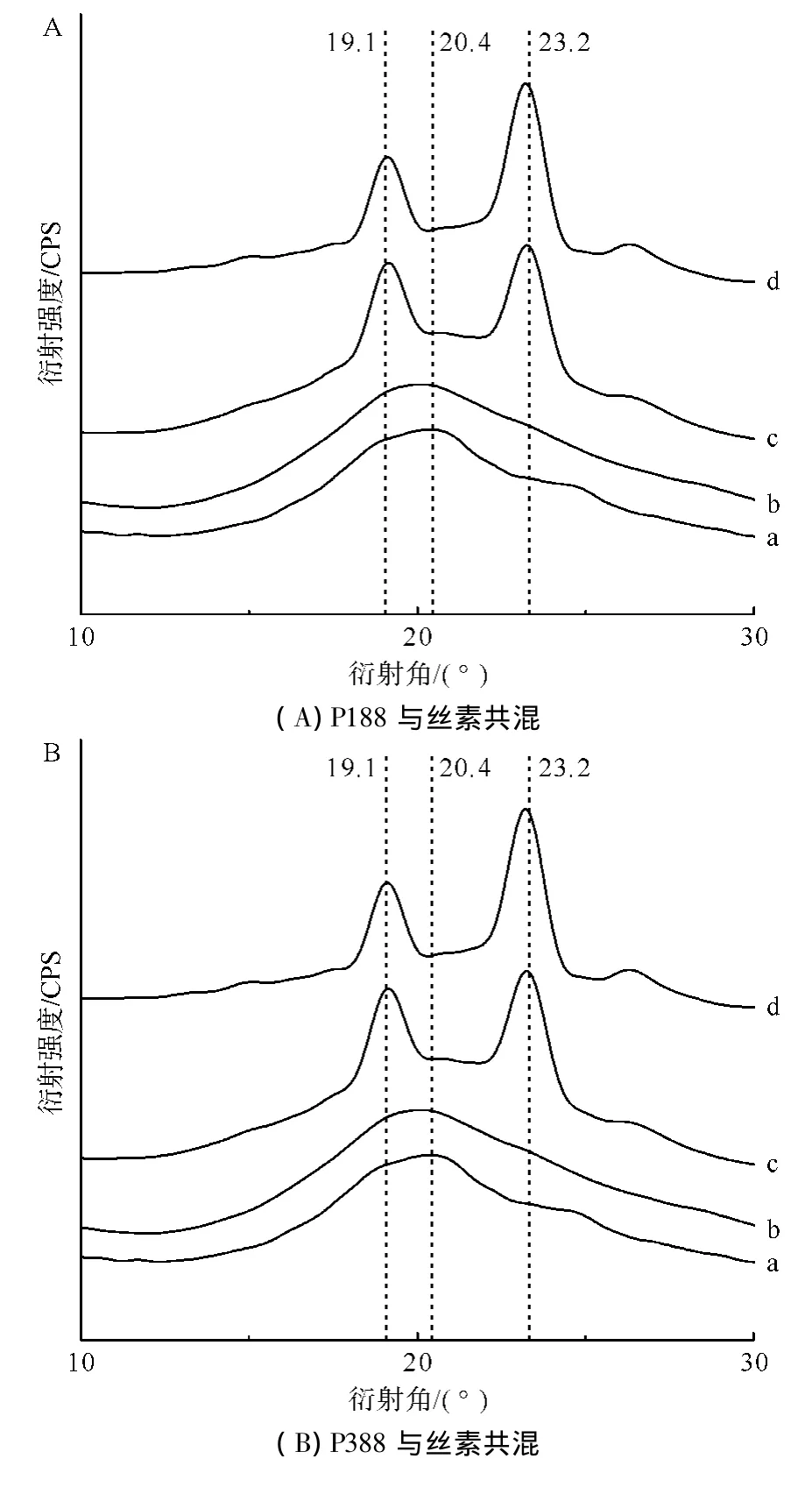
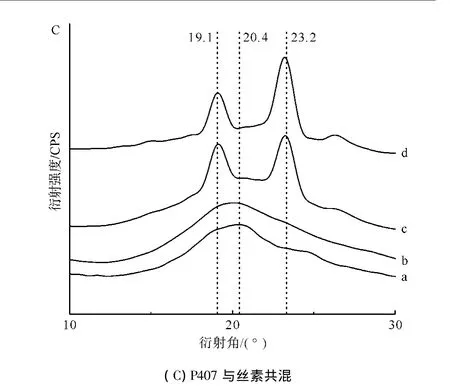
图2 不同相对分子质量和共混比例组成的RSF-Poloxamer水凝胶与纯丝素水凝胶的XRD谱图Fig.2 XRD spectrograms of RSF-Poloxamer hydrogel with different relative molecular masses and blending ratios and pure silk fibroin hydrogel
如图2所示,纯丝素水凝胶的主要衍射峰在20.7°,属于SilkⅡ结晶衍射峰;当泊洛沙姆与丝素共混形成RSF-Poloxamer水凝胶后,其共混水凝胶的图谱则表现为纯丝素与泊洛沙姆各自衍射峰的叠加。当泊洛沙姆含量较低时,即与再生丝素溶液1︰3混合时,这种叠加不明显。但随着泊洛沙姆含量的增加,这种衍射峰的叠加变得更加明显,均在 19.1°、23.2°处出现了明显的特征衍射峰,并且与泊洛沙姆相对分子质量的大小无关,说明这是泊洛沙姆的特征结晶峰。同时,这也表明了RSF-Poloxamer共混水凝胶中存在着丝素与泊洛沙姆两种结晶结构,两者只是单纯的共混并且相分离。
2.4 热性能分析(DTA)
图3A、B、C分别为泊洛沙姆P188、P338和P407与再生丝素溶液共混形成RSF-Poloxamer水凝胶后的DTA谱图。
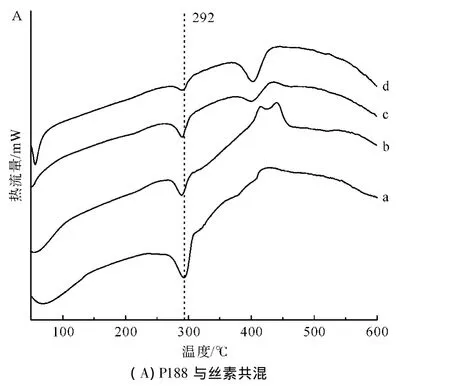
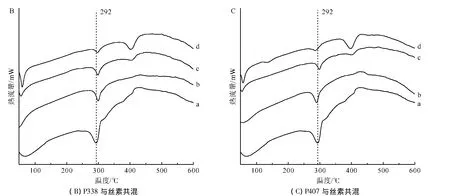
图3 不同相对分子质量和共混比例组成的RSF-Poloxamer水凝胶与纯丝素水凝胶的DTA谱图Fig.3 DTA spectrograms of RSF-Poloxamer hydrogel with different relative molecular masses and blending ratios and pure silk fibroin hydrogel
如图3所示,纯丝素凝胶在292℃有一个明显的热分解峰,主要归因于纯丝素水凝胶内大量β-折叠构象的缘故。当泊洛沙姆与再生丝素共混形成RSFPoloxamer水凝胶后,其热分解峰仍然在292℃左右,基本没有太大变化,说明了共混水凝胶中丝素还是含有大量的β-折叠构象。这与红外光谱测试的结果是一致的:泊洛沙姆只是加快了再生丝素溶液凝胶化中的结构转变过程,并没有或者很少改变其最终形成水凝胶后的结构。
2.5 形态结构与分析(SEM)
如图4所示为丝素溶液分别和泊洛沙姆P188、P338、P407以不同比例共混后形成的SF-Poloxamer水凝胶冷冻干燥后的扫描电镜图。A、B、C为P188与再生丝素以 1︰3、1︰1、3︰1 质量比共混;D、E、F 为P388 与再生丝素以3︰1、1︰1、1︰3 质量比共混;G、H、I为 P407 与再生丝素以3︰1、1︰1、1︰3 质量比共混。

图4 丝素溶液分别和泊洛沙姆P188、P338、P407以不同比例共混后形成的RSF-Poloxamer水凝胶冷冻干燥后的SEM照片Fig.4 SEM photograph of frozen and dried RSF-Poloxamer hydrogel prepared by silk fibroin solution respectively blending with Paloxamers P188,P338 and P407 in different ratios
从图4可以看出,虽然含有不同泊洛沙姆及共混比例的RSF-Poloxamer凝胶形态均有不同的变化,但是其总体都呈现为片层状结构,一般认为这是由于其凝胶化过程中大量丝素分子由无规卷曲转变为β-折叠结构所致,这与结构测试的结果是一致的。同时,随着共混比例中泊洛沙姆的增加,RSF-Poloxamer凝胶的片层结构变得越来越规整。
3 结论
1)将不同相对分子质量泊洛沙姆与丝素溶液以不同比例混合形成RSF-Poloxamer凝胶,并用FTIR、XRD、DTA、SEM对水凝胶进行了结构表征。结果表明,泊洛沙姆可以明显加速再生丝素蛋白溶液的凝胶化过程,并且对其形成水凝胶后的结构和形态影响很小。
2)RSF-Poloxamer凝胶可以通过调节泊洛沙姆的相对分子质量和共混比例这两个因素来控制RSFPoloxamer水凝胶的凝胶速度,有望在短时间内快速形成水凝胶,从而扩宽了丝素水凝胶的应用范围。
[1]AKIRA M.Mechanisms of silk fibroin sol-gel transitions[J].The Journal of Physcical Chemistry B,2006,110(43):21630-21638.
[2]宁丽,薛淼,黄海宁,等.皮肤再生膜的生物相容性系列研究[J].中国修复重建外科杂志,2000,14(1):44-48.NING Li,XUE Miao,HUANG Haining,et al.Study on biocompatibility of skin reproductive membrane[J].Chinese Journal Reparative and Reconstructive Surgery,2000,14(1):44-48.
[3]LI M Z,MASAYO O,NORIHIKO M.Enzymatic degradation behavior of porous silk fibroin sheets[J].Biomaterials,2003,24(2):357-365.
[4]王洪,严力军,杨述华,等.丝状支架韧带材料机械强度和体外降解性研究[J].中华实验外科杂志,2006,23(7):881-883.WANG Hong,YAN Lijun,YANG Shuhua,et al.Studies on mechanical strength and degradation in vitro of silk matrix for tissue engineered ligaments[J].Chinese Journal of Experimental Surgery,2006,23(7):881-883.
[5]朱良均,胡国樑,姚菊明,等.丝素蛋白在胶凝时的分子结构,结晶性的探讨[J].蚕业科学,1998,24(4):226-229.ZHU Liangjun,HUGuoliang,YAOJuming,et al.Studies on the molecular structure and crystallinity of fibroin protein during gelation[J].Science of Sericulture,1998,24(4):226-229.
[6]MINOUR N,TSUKADA M,NAGURA M.Physic-chemical properties of silk fibroin membrane as a biomaterial[J].Biomaterials,1990,11:430-434.
[7]OPDAHL A,KIM S H,KOFFAS T S,et al.Surface mechanical properties of pHEMA contact lenses:viscoelastic and adhesive property changes on exposure to controlled humidity[J].Journal of Biomedical Materials Research:Part A,2003,67(1):350-356.
[8]NOWAK A P,BREEDVELD V,PAKSTISL,et al.Rapidly recovering hydrogel scaffolds from self-assembling diblock copolypeptide amphiphiles[J].Nature,2002,417:424-428.
[9]周文,陈新,邵正中.红外和拉曼光谱用于对丝蛋白构象的研究[J].化学进展,2006,18(11):1514-1522.ZHOU Wen,CHEN Xin,SHAO Zhengzhong.Conformation studies of silk proteins with infrared and roman spectroscopy[J].Chemistry Progress,2006,18(11):1514-1522.

