高糖高脂饮食诱导大鼠胰岛素抵抗模型和评价
王继勇,高云丽,左 洛,何 敏,陈 聪,李小军
(1武汉理工大学化学工程学院,武汉430070;2中南民族大学药学院,武汉430074)
目前糖尿病的发病率呈持续上升状态,且多以 II型糖尿病为主,而胰岛素抵抗(insulin resistance,IR)是II型糖尿病的重要病理生理基础[1].胰岛素抵抗是机体在外围组织对胰岛素摄取和清除葡萄糖能力受损[2,3],导致代偿性胰岛素分泌增多.目前,国内外对于胰岛素抵抗模型建立的方法有自发型[4],诱导型、转基因型[5]等,其中诱导型动物模型又分为高糖饮食诱导[6]、高脂饮食诱导[7]、药物与饮食联合诱导[4].据链脲佐菌素(STZ)致糖尿病机理[8]和 STZ 造模的特点[9],本文采用高糖高脂饮食结合小剂量STZ诱导II型糖尿病胰岛素抵抗,通过体重、空腹血糖、葡萄糖耐量、胰岛素水平、胰岛素抵抗、肝糖原含量等指标评价高糖高脂饮食及STZ对胰岛素抵抗大鼠的影响.
1 材料与方法
1.1 材料和仪器
SPF级雄性 Wistar大鼠,120~150 g,5~6周(湖北省实验动物研究中心,00070294).按照质量比:普通饲料50.0%,淀粉22.5%,蛋白质 11.5%,脂肪10.0%,纤维 2.5%,维生素 0.75%,矿物质2.75%,高温焙干[10]配制高脂高糖饲料.三诺安稳血糖仪与血糖试纸(长沙三诺生物传感技术股份有限公司),NAVIGATORTMXL电子天平(奥豪斯仪器常州有限公司),胰岛素测定试剂盒(北京北方生物技术研究所),肝糖原测定试剂盒(南京建成生物技术研究所),Eppendorf.AG Centrifuge 5804R 22331 Hamburg(德国 Eppendorf公司),GAMMA-5射线仪(South Korea SHINJIN MEDICS.INS),低温大容量多管离心机(上海安亭科学仪器厂),STZ(美国Sigma公司),葡萄糖、水合柠檬酸、二水合柠檬酸三钠(国药集团化学试剂有限公司).
1.2 实验动物分组
饲养环境温度22~25℃,湿度30%~40%.大鼠适应性饲养3 d后,随机分为3组,每组8只:①正常组,普通饮食;②高糖高脂组,20%果糖水结合高糖高脂饮食;③高糖高脂+STZ组,20%果糖水结合高糖高脂饮食.
1.3 大鼠空腹血糖(FBG)测定和口服葡萄糖耐量试验(OGTT)
大鼠饲养6周后,禁食不禁水14~16 h,尾部采血,测定空腹血糖,记为OGGT实验0 min的血糖值,随后各组大鼠口服2g/kg的葡萄糖溶液,测30,60,120 min的血糖值,作 OGTT的时间-血糖关系图.
1.4 胰岛素抵抗模型
将0.1 mol/L的柠檬酸溶液与0.1 mol/L的柠檬酸钠溶液按1︰1.32比例混合,调节pH至4.4,配成0.1 mol/L柠檬酸缓冲液,高温灭菌,4℃保存.将STZ溶解于0.1 mol/L的柠檬酸钠缓冲液,配制成浓度为1.2%的STZ溶液.大鼠饲养8周后,禁食不禁水16 h,高糖高脂+STZ组腹腔注射30 mg/kg的STZ溶液,正常组和高糖高脂组注射等剂量的柠檬酸缓冲液.糖尿病大鼠模型的标准为:禁食不禁水14~16 h,检测各组大鼠空腹血糖和葡萄糖耐量,空腹血糖>7.0mmol/L或120min血糖值>11.1mmol/L.故确定胰岛素抵抗模型标准为空腹血糖 <7.0mmol/L或120min 血糖值 <11.1mmol/L,但高于正常值.
1.5 大鼠实验末期 FBG测定及OGTT
大鼠饲养10周后,各组大鼠禁食不禁水14~16 h,尾部采血,测定空腹血糖.由于腹腔注射30 mg/kg STZ的正常大鼠与正常大鼠120 min血糖无显著性差异[11].故本实验中仅分析正常组、高糖高脂组和高糖高脂+STZ组的葡萄糖耐量情况,具体测定方法同上1.3.
1.6 大鼠胰岛素水平及胰岛素抵抗指数评价
大鼠饲养10周后,各组大鼠禁食不禁水14~16 h,尾部采血1~1.5 mL于含有EDTA抗凝剂的离心管,放于冰水浴中.4℃静置30 min,3500 r/min离心15 min,分离上清,-20℃保存.按照碘[125I]胰岛素放射免疫分析药盒说明书测定各组大鼠血浆胰岛素水平,按照公式[12]胰岛素抵抗指数(HOMAIR)=空腹血浆胰岛素×空腹血糖/22.5,计算胰岛素抵抗指数.
1.7 大鼠肝糖原含量测定
大鼠饲养10周后,各组大鼠禁食不禁水14~16 h,颈椎脱臼处死,解剖取肝脏,计算肝脏指数.取各组大鼠部分肝脏(weight≤100 mg),迅速放入冰冷的生理盐水漂洗,吸干水分称重,按样本重量:碱液体积=1︰3加入试管,沸水浴20 min,冷却,加蒸馏水(蒸馏水体积=96×肝脏重量),混匀,沸水浴5 min,冷却,于620 nm波长下,空白管调零,测各管吸光度(OD).按照公式:肝糖原含量(mg/g组织)=测定管OD值/标准管OD值×标准管含量×100×10×1.11,计算大鼠肝糖原含量.
1.8 统计分析
2 结果与分析
2.1 造模结果
按1.4对高糖高脂+STZ组注射STZ 48 h后,8只大鼠中7只造模成功,1只死亡,2周后造模成功大鼠均处于胰岛素抵抗状态.
2.2 大鼠体重变化
各组大鼠造模前皮毛有光泽,精神良好,造模后高糖高脂+STZ组毛发暗黄,精神萎靡,摄食量加大,饮水增多,排尿增多,体重下降,体重变化情况见图1.由图1可见,注射STZ前(1~8周),各组大鼠体重增加较快.高糖高脂组和高糖高脂+STZ组与正常组相比,均有显著性差异(p<0.01),故高脂饲料饮食可使大鼠体重增加,导致肥胖.注射STZ后,高糖高脂+STZ组体重较高糖高脂和正常组增加缓慢,说明STZ在一定程度上阻碍大鼠体重增加.
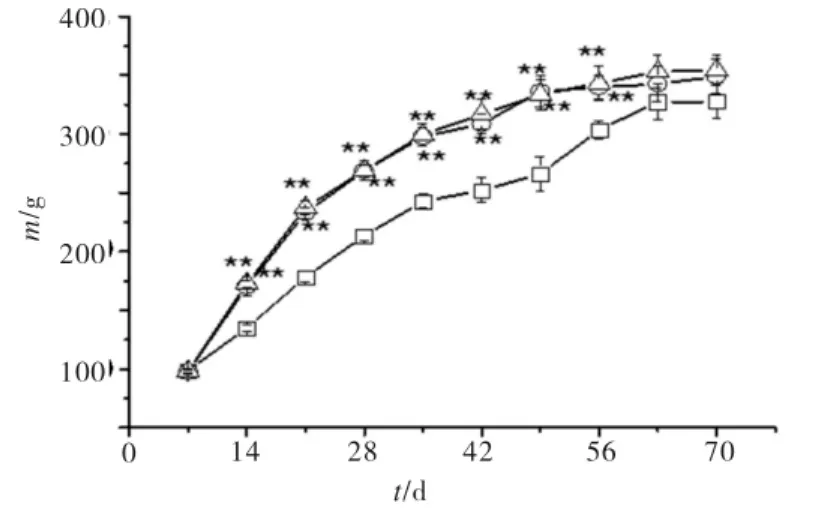
图1 大鼠体重变化图Fig.1 Body weight changes of rats
2.3 大鼠空腹血糖变化
大鼠空腹血糖变化见图2.由图2可见,注射STZ前(1~8周),各组大鼠空腹血糖均维持在正常范围(3.2~8.1mmol/L),无显著性差异,但高糖高脂组和高糖高脂+STZ组FBG略高于正常组.故高糖高脂饮食虽不能造成严重的空腹血糖受损,但在一定程度上使胰岛代偿功能低下,有糖尿病病症的倾向.第9周注射STZ 48 h后,高糖高脂+STZ组中FBG均在10.0 mmol/L以上,高糖高脂+STZ组较正常组和高脂高糖组有显著性差异(p<0.01);注射STZ 2周后,大鼠FBG虽降至6.4 mmol/L,但较正常组和高脂高糖组仍有显著性差异(p<0.01),可见,小剂量的STZ 2周后大鼠糖调节失常,处于高血糖状态.
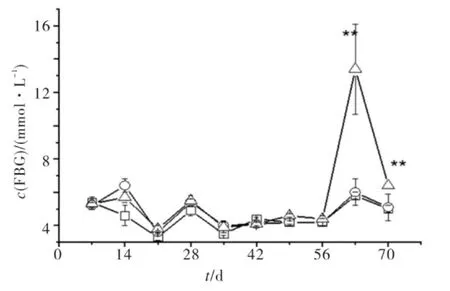
图2 动物空腹血糖变化Fig.2 Fasting blood glucose changes of rats
2.4 大鼠口服葡萄糖耐量测定
注射STZ前,注射STZ 48 h和2周后,大鼠口服葡萄糖耐量测定结果见图3.
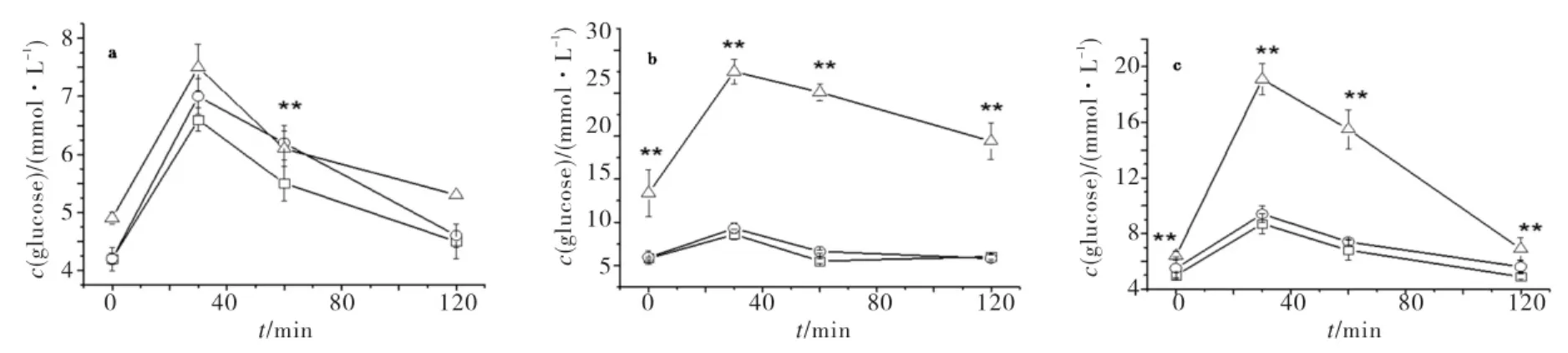
图3 不同时间大鼠注射口服葡萄糖耐量结果Fig.3 OGTT results in rats at different time
由图3可见,整个过程中高糖高脂组的葡萄糖耐量较正常组受损,但无显著性差异.注射STZ前(图3a)各组大鼠在口服葡萄糖30 min后,血糖均明显升高,较0 min有显著性差异(p<0.01);60 min时血糖明显降低,120 min时,虽血糖值稍高于0 min(0.4 mmol/L),但已降至正常范围,且无显著性差异.注射STZ 48 h后(图3b),高糖高脂+STZ组较正常组和高糖高脂组在两组OGTT实验中血糖明显增高,葡萄糖耐量异常显著(p<0.01).注射STZ 2周后(图3c),高糖高脂+STZ组在各个时间点血糖值均明显下降约(50±10)%,糖耐量异常有所恢复,因为小剂量的STZ未完全摧毁胰岛β细胞,仍具有分泌能力,随着β细胞功能的逐渐恢复,糖耐量能力也逐渐恢复,保持在胰岛素抵抗状态.
2.5 大鼠肝糖原含量和血浆胰岛素测试
大鼠肝糖原含量和血浆胰岛素测试结果见表1.由表1可见,正常组、高糖高脂组和高糖高脂+STZ组的肝糖原含量无显著性差异.故高糖高脂和STZ对大鼠肝糖原的合成无太大影响.3组的胰岛素水平和胰岛素抵抗指数亦无统计学差异.可见高糖高脂饮食对大鼠胰岛β细胞分泌胰岛素的功能影响较小,小剂量STZ在一定程度上使该功能略有降低.
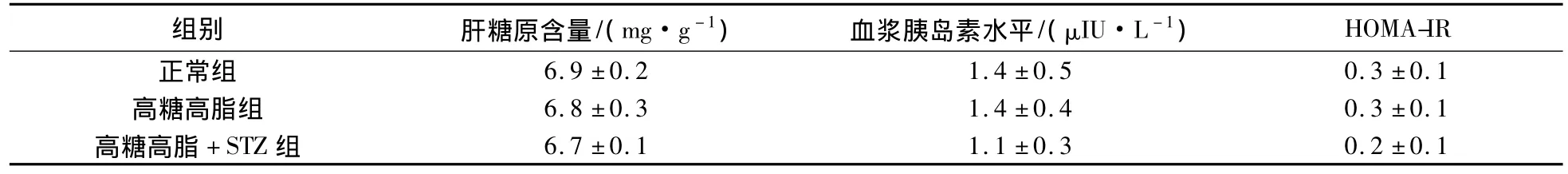
表1 各组肝糖原含量、空腹血浆胰岛素水平、胰岛素抵抗指数的测定Tab.1 Determination of the hepatic glycogen contents,fasting plasma insulin level,insulin resistance in each group
正常组、高糖高脂组和高糖高脂+STZ组的胰腺病理切片(20×)见图4.由图4可见,模型组的胰岛较正常组均出现不同程度萎缩(蓝圈标记为胰腺岛所在位置).
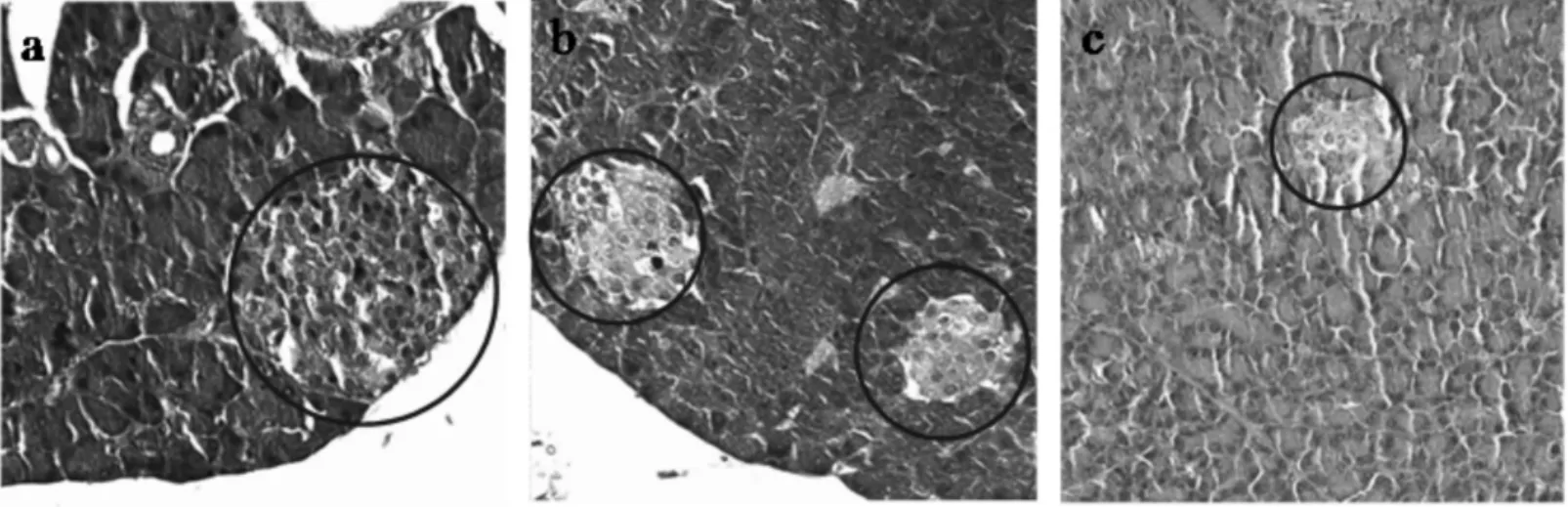
图4 各组胰腺病理切片图Fig.3 Pathological section diagrams from rat pancreas of different groups
3 讨论
本研究表明:注射STZ前,高糖高脂组和高糖高脂+STZ组大鼠的体重明显升高(p<0.05);空腹血糖有不同程度的升高,但无显著性差异;糖耐量略有异常;故短期高糖高脂饮食使大鼠体重增加,血糖升高,由于高糖高脂对胰岛β细胞分泌胰岛素的功能有阻碍,使其分泌胰岛素能力下降.
注射STZ 48 h后,高糖高脂+STZ组的大鼠体重较高糖高脂组增加缓慢,空腹血糖急速上升,糖耐量异常改变,可见STZ可在短时间内破坏胰岛β细胞,使其分泌胰岛素能力骤降,引起血糖骤升.注射STZ 2周后,高糖高脂+STZ组大鼠血糖值较注射STZ 48 h虽均大幅度降低,但较正常组仍有差异(p<0.05);糖耐量异常程度好转.实验后期,高糖高脂+STZ组大鼠的肝糖原、胰岛素水平和胰岛素抵抗指数与高糖高脂组相比无太大差异,与正常组相比虽略有下降,但无显著性差异.可见短时间内高糖高脂饮食可使空腹血糖升高,但对胰岛β细胞影响不大,小剂量的STZ可在短时间内抑制胰岛β细胞分泌胰岛素的能力,作用迅速但可自行修复,胰岛素敏感性指数虽然降低,但并未影响到肝脏糖代谢功能.
综上所述,高糖高脂饮食虽对大鼠血糖、糖耐量、肝糖原及胰岛素无显著影响,但它可使血糖升高,糖耐量异常,胰岛素减少,肝糖原合成减少.高糖高脂饮食8周,腹腔注射30 mg/kg STZ后,继续高糖高脂2周可形成胰岛素抵抗动物模型.
[1]Stren M P.Diabetes and cardiovascular disease:the"common"hypothesis[J].Diabetes,1995,44:369-374.
[2]Sowers J R,Frohlich E D.Insulin and insulin resistance:impact on blood pressure and cardiovascular disease[J].Med Clin North Am,2004,88(1):63-82.
[3]李 蕾,李之俊,魏安奎,等.胰岛素抵抗动物模型和运动干预模型的建立和评价[J].武汉体育学院学报,2009,43(8):51-54.
[4]刘 微,李 冀,谢 田,等.胰岛素抵抗动物模型的研究进展[J].中医药信息,2008,25(6):9-11.
[5]喻 嵘,成细华,胡 伟,等.骨骼肌特异性胰岛素样生长因子1及胰岛素双受体功能缺失鼠糖尿病发病及其相关炎症因子的变化[J].中国临床康复,2007,11(45):9075-9078.
[6]张 闽,杨 晔,刘 敏,等.果糖诱导的高血压伴胰岛素抵抗大鼠血清脂联素肿瘤坏死因子α浓度的变化[J].心肺血管病杂志,2007,26(1):48-50.
[7]赵永松,李玉光,赵晓云.高脂饮食对大鼠胰岛素抵抗及氧化损伤指标的影响及意义[J].山西医药杂志,2007,36(8):675-677.
[8]Elsner M,Guldbakke B,Tiedge M,et al.Relative importance of transport and alkylation for pancreatic beta-cell toxicity of streptozotocin[J].Diabetologia,2000,43(12):1528-1533.
[9]Saini K S,Thompson C,Winterford C M,et al.Streptozotocin at low doses induces apoptosis and at high doses causes necrosis in a murine pancreatic beta cell line[J].J Biochem Mol Biol Int,1996,39(6):1229-1236.
[10]王俊贤,李小军,刘跃辉,等.高糖、高脂诱导大鼠肝脏胰岛素抵抗评价[J].中国药师,2012,15(6):747-751.
[11]文晓红.链脲佐菌素致胰岛破坏及其与高血糖关系的实验研究[D].重庆:重庆医科大学,2008:25.
[12]Gannon M C,Niewoehner C B,Nuttall F Q.Effect of insulin administration on cardiac glycogen synthase and synthase phosphatase activity in rats fed diets high in protein,fat or carbohydrate[J].J Nutr,1985,115(2):243-251.

