响应面法优化Enterobacter sp.SYA2乳糖酶发酵工艺
张卫兵,文鹏程,刘芳宁,艾对元,贠建民,张 炎,梁 琪
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
β-半乳糖苷酶(EC 3.2.1.23)又称β-D-半乳糖苷半乳糖水解酶,能够催化β-D-半乳糖苷键发生水解,还具有转半乳糖苷活性,在乳品、医药、分析、环境保护等方面都具有广阔的应用前景,尤其有利于“乳糖不耐受症”[1]。乳糖酶来源广泛,可以从多种微生物、植物和动物体中获得。利用微生物发酵法获取乳糖酶的方法具有操作方便、生产效率高、适用于工业化生产等优点[2]。培养基的成分对于微生物发酵产酶有重要的影响,通常用于发酵培养基优化的方法有单因素实验、正交实验和均匀设计等[3]。Plackett-Burman法适用于从众多的过程变量中快速、有效地筛选出最为重要的几个因素[4]。Williams将其与随机平衡实验、部分因子实验相比较,认为Plackett-Burman法在筛选实验重要因子方面更为有效和准确[5],另外还具有数据处理简单、可适用于任意多个实验因子等优点。Box-Behnken设计是一种适用于2~5个因素的响应面优化方法,采用该法可以建立连续变量响应面模型和回归方程,同时可对影响因变量的各因子水平及其交互作用进行优化与评价,可快速有效地确定多因子系统的最佳条件,该法已经广泛的应用于各类培养基以及发酵条件的优化实践中[6-8]。本实验以实验室前期从甘肃省天祝牧区牦牛乳酸奶中分离的产乳糖酶菌株Enterobacter sp.SYA2[9]为研究对象,对Enterobacter sp.SYA2 的发酵条件和产酶的培养基进行了优化,以期为进一步扩大发酵实验奠定基础。
1 材料与方法
1.1 材料与仪器
Enterobacter sp.SYA2 本实验室分离并保藏于中国普通微生物菌种保藏管理中心,保藏号CGMCC No:5251;邻硝基苯酚(ONP) 南京化学试剂有限公司,分析纯;5-溴-4-氯-3-吲哚-β-D半乳糖苷(X-gal) 西安舟鼎国生物技术公司,色谱纯;邻硝基苯β-D-半乳吡喃糖苷(ONPG) 科宏达生物技术有限公司,色谱纯;种子培养基:乳糖10g/L、蛋白胨 10g/L、酵母膏 3g/L、NaCl 4g/L,p H6.5;基础发酵培养基:乳糖 15g/L、蛋白胨 20g/L、酵母膏 3g/L、NaCl 4g/L、K2HPO41g/L,MnCl20.5g/L,pH6.5。
SW-CJH-1FD净化工作台 苏州净化设备厂;HG303-4电热恒温培养箱 南京实验仪器厂;PB203-N电子天平 上海精密科学仪器厂;pHS-25数显pH计 上海精密科学仪器厂;SUPRA 22K低温高速离心机 韩国HANSON技术公司;UV-2450紫外可见分光光度计 日本岛津公司;JY96-ПN超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 粗酶液制备 将活化好的菌种接种于发酵培养基中,在一定条件下培养后取发酵液20mL,4℃、6000r/min离心20min,收集菌体并用0.1mol/L磷酸盐缓冲溶液(pH 6.5)洗涤两次,加入0.1mol/L磷酸盐缓冲溶液(pH 6.5)至20mL,超声破碎15min,4℃、12000r/min离心20min,上清液为粗酶液。
1.2.2 乳糖酶活力的测定 以ONPG为酶作用底物,参照文献[10]并做适当修改。标准曲线:取6个100mL 容量瓶,标号为 1、2、3、4、5、6,分别移取 ONP储备液 0.0、4.0、8.0、12.0、16.0、20.0mL,各试管中加入25.0mL的Na2CO3溶液,再用磷酸盐缓冲液定容至刻度,摇匀,溶液 ONP的浓度分别是 0.00、0.04、0.08、0.12、0.16、0.20mmol/L。以 1 号试管为空白管,于420nm处测定OD值。以ONP物质的量浓度为横坐标,稀释液的吸光度为纵坐标制作标准曲线。样品测定:取0.5mL稀释后的粗酶液,37℃下水浴5min,加入已预热至37℃的含5mmol/L ONPG磷酸盐缓冲液(pH6.5)1.5mL,37℃下水浴反应10min,然后立即加入3.0mL 0.5mol/L Na2CO3终止反应,于420nm下测定OD值,测定3次取平均值。空白为0.5mL加热失活的酶液和1.5mL含5mmol/L ONPG磷酸盐缓冲液(pH6.5)。一个酶活力单位定义(U)为:在37℃每分钟水解释放1μmolONP所需的酶量。

式中,X为乳糖酶活力(U/mL);C为标准曲线中对应的ONP的浓度(1μmol/mL);N为粗酶液稀释倍数。
1.2.3 发酵条件的优化
1.2.3.1 发酵温度对酶活的影响 将菌种接种于种子培养基中,37℃摇床培养12h制备种子液,然后将种子液按体积分数3%接种于装液量为50mL/250mL三角瓶中,分别在 25、28、31、34、37、40℃下培养 24h,摇床转速为175r/min,培养后收集菌体并测定酶活。
1.2.3.2 摇床转速对酶活的影响 摇床转速分别调节为 100、125、150、175、200、225r/min,其他条件不变,37℃振荡培养24h后收集菌体处理后测定酶活。
1.2.3.3 装液量对酶活的影响 基础发酵培养基装液量分别为20、30、40、50、60mL,其他条件不变,摇床转速150r/min、37℃振荡培养24h后收集菌体处理并测定酶活。
1.2.3.4 种子接种量对酶活的影响 将种子液分别以1%、3%、5%、7%、9%、11%接种于基础发酵培养基中,其他条件不变,摇床转速150r/min、37℃振荡培养24h后收集菌体并处理并测定酶活。
1.2.3.5 种龄对酶活的影响 分别将培养6、8、10、12、14、16h的种子液以5%的接种量接种于基础发酵培养基中,其他条件不变,摇床转速150r/min、37℃振荡培养24h后收集菌体处理并测定酶活。
1.2.4 发酵培养基优化 以乳糖酶酶活为响应值,在单因素基础上采用两步法进行优化:首先利用Plackett-Burman实验设计筛选出对响应目标影响显著的因素;然后利用Box-Benhnken设计进行优化实验,通过实验数据拟合得到二阶响应模型,最终确定最佳发酵培养基,并进行验证。
1.2.4.1 重要因素筛选实验 应用Design-Expert软件设计Plackett-Burman实验,对基础发酵培养基中的6个组分乳糖、蛋白胨、酵母膏、NaCl、K2HPO4、MnCl2和pH进行筛选。每个变量分别设定高低两个水平,实验因素水平见表1。
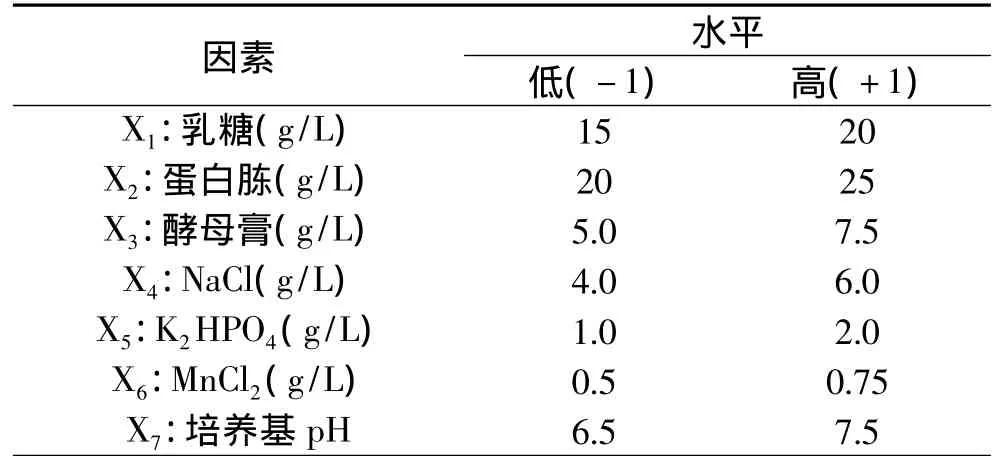
表1 Plackett-Burman实验因素水平表Table 1 Level and code of variables for Plackett-Burman design
1.2.4.2 最陡爬坡实验 以Plackett-Burman实验筛选出的对发酵产酶影响显著的因素为实验因子,根据因素的正负效应确定爬坡方向和变化步长,进行实验设计,具体见表5。
1.2.4.3 Box-Benhnken设计及响应面分析 以Plackett-Burman实验筛选得到的对发酵产酶影响显著的因素作为设计因子,以最陡爬坡实验得出的最佳浓度为中心点,应用Design-Expert软件设计Box-Benhnken实验并进行响应面分析。
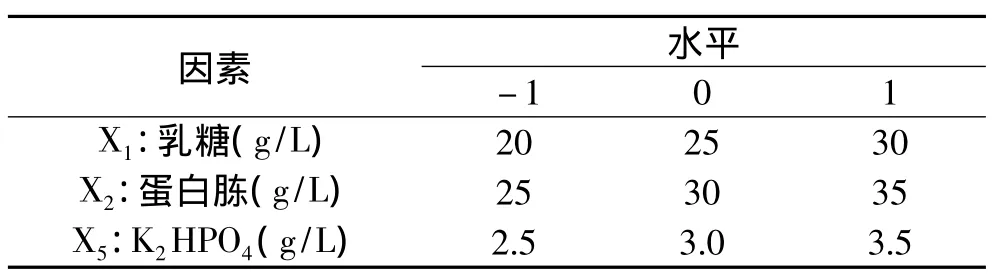
表2 Box-Behnken实验因素与水平Table 2 Main fermentation conditions and levels for Box-Behnken design
2 结果与分析
2.1 发酵条件优化
2.1.1 发酵温度对Enterobacter sp.SYA2产酶的影响
温度是保证微生物生长和产酶的重要条件之一,它会影响发酵液的物理性质、菌株的代谢和生长速度等。
由图1可以看出,在25~37℃的范围内,酶活随着温度升高逐渐升高,37℃时酶活达到最高,37℃以后酶活逐渐降低,所以Enterobacter sp.SYA2发酵的温度应控制在37℃左右。Hsu等人[11]研究表明,37℃为长双歧杆菌(Bifidobacterium longum)CCRC15708最佳生长和产酶温度。Batra[12]从喜马偕尔邦的温泉采样分离出的凝结芽孢杆菌(Bacillus coagulans)RCS3,发酵温度为50℃时,产酶能力最好。

图1 温度对Enterobacter sp.SYA2产酶的影响Fig.1 Effect of temperature on production of Lactose from Enterobacter sp.SYA2
2.1.2 摇床转速对Enterobacter sp.SYA2酶活的影响
转速提高溶氧,同时能促进培养基中大分子物质的分散,促进菌体对其利用,降低高蛋白物质的黏度对菌体生长的抑制作用[13-14]。由图2可知,静止培养时,菌体几乎不生长,酶活为零;随着转速的升高,乳糖酶活不断升高,当超过150r/min后,乳糖酶活力逐渐下降。因此,该菌株发酵的最佳转速为150r/min。
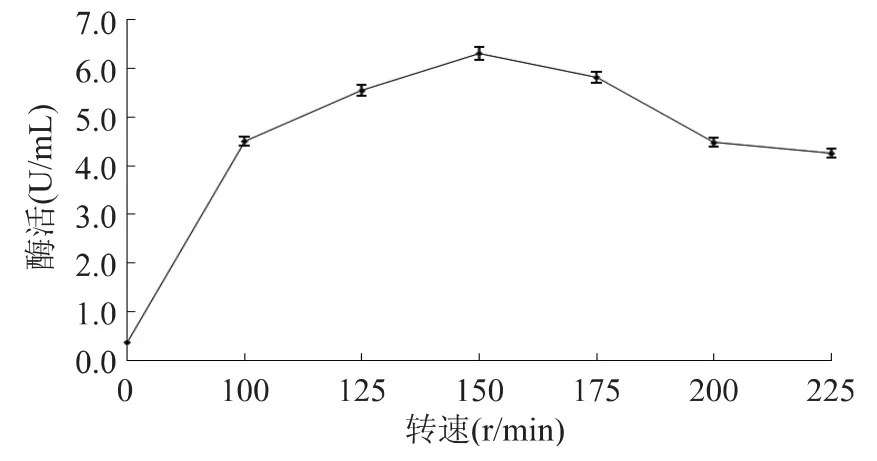
图2 转速对Enterobacter sp.SYA2产酶的影响Fig.2 Effect of rotation speed on production of Lactose from Enterobacter sp.SYA2
2.1.3 装液量对Enterobacter sp.SYA2酶活的影响 发酵时装液量直接影响着培养基中溶解氧量,进而影响产酶量。当装液量较低时,由于发酵液中溶氧量增加,从而抑制了微生物代谢;但当装液量过高时,溶氧量过低,不利于微生物生长代谢。250mL三角瓶中不同装液量对乳糖酶活力的影响见图3。结果显示,当250mL三角瓶中装液量为50mL时,酶活力最高,为7.24U/mL。
2.1.4 接种量对Enterobacter sp.SYA2酶活的影响接种量过小,会增长延滞期,对培养不利。接种量过大,菌体生长过快,代谢产物积累过多,从而造成菌体过早的衰老,停滞期越短,培养基消耗快,不利于产物的合成[15]。
由图4可以看出,随着接种量的增加,酶活力逐渐上升,当接种量为5%时,发酵液酶活为8.04U/mL,达到最大值,进一步加大接种量,产酶水平呈下降趋势。
2.1.5 菌龄对Enterobacter sp.SYA2酶活的影响 由图5可知,种龄对乳糖酶活影响较大,随着菌龄的增加,酶活先升高后降低,当种子菌龄为8h时,酶活力最高,为9.02U/mL。
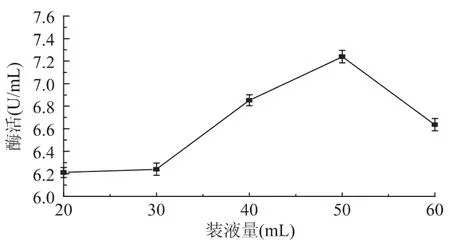
图3 装液量对Enterobacter sp.SYA2产酶的影响Fig.3 Effect of liquid volume in flask on production of Lactose from Enterobacter sp.SYA2

图4 接种量对Enterobacter sp.SYA2产酶的影响Fig.4 Effect of inoculum size on production of Lactose from Enterobacter sp.SYA2

图5 菌龄对Enterobacter sp.SYA2产酶的影响Fig.5 Effect of cell age on production of Lactose from Enterobacter sp.SYA2
2.2 培养基优化
2.2.1 重要因素筛选实验 Plackett-Burman实验设计及结果如表3所示,实验结果分析见表4。
由表4可以看出,在α=0.05的显著水平上,蛋白胨、乳糖、K2HPO43个因素对乳糖酶活的影响显著,且影响均为正效应,影响程度为:蛋白胨>乳糖>K2HPO4,对这3个因素进一步优化。其余4个因素对发酵产脂肪酶的影响不显著,NaCl为正效应,在后续优化实验中取其高水平编码对应的浓度;酵母膏、MnCl2和培养基p H均为负效应,在后续实验中取其低水平编码对应的浓度。
2.2.2 最陡爬坡实验及结果 根据Plackett-Burman实验结果设计,按一定的梯度增加蛋白胨、乳糖和K2HPO4在发酵培养基中的浓度。实验设计及结果见表5。
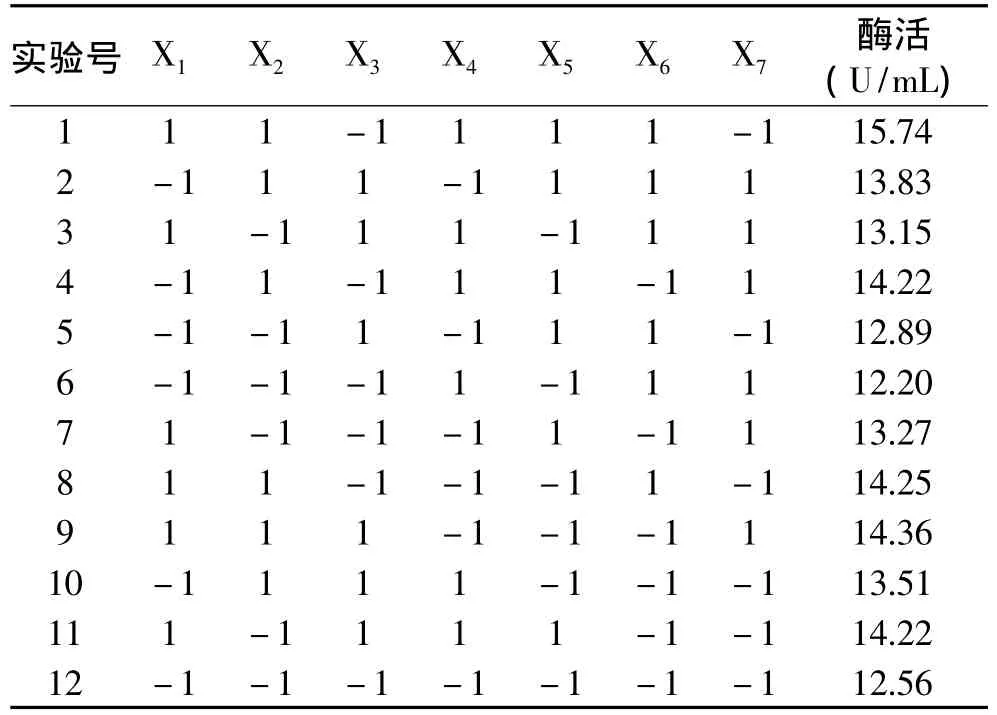
表3 Plackett-Burman实验设计及结果Table 3 Plackett-Burman test design and results
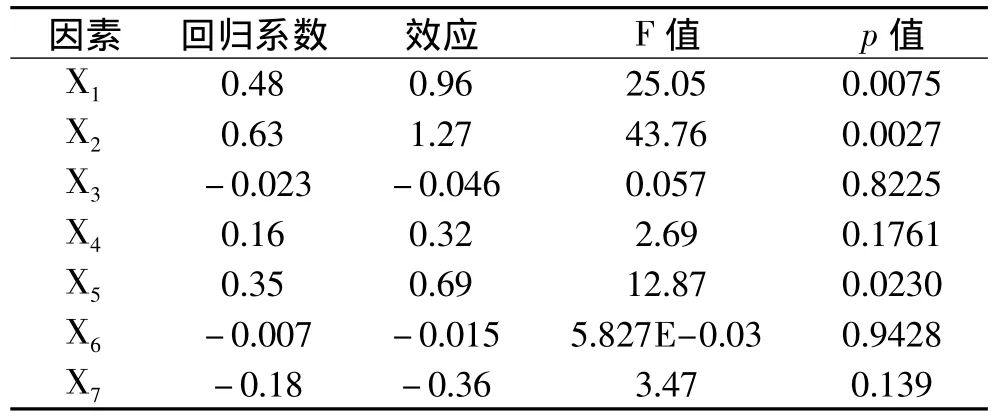
表4 Plackett-Burman实验设计结果分析Table 4 The analysis of results for Plackett-Burman design

表5 最陡爬坡实验及结果Table 5 Experimental design and results of steepest ascent path
由表5可知,随着发酵培养基中蛋白胨、乳糖和K2HPO4浓度的增加,酶活先上升后下降,当培养基中蛋白胨、乳糖和 K2HPO4的浓度分别为 25、30、3.0g/L时,所对应的发酵液酶活最大,故以此条件作为Box-Benhnken实验的中心点,进行下一步优化实验。
2.2.3 Box-Benhnken实验设计与响应面分析 综合单因素实验结果,根据Box-Behnken实验设计的原理[16],以乳糖酶活力为响应值 Y,选取乳糖 X1、蛋白胨X2、K2HPO4X5三个因素进行设计,Box-Benhnken实验设计及结果见表6。
根据实验结果,采用逐步回归的方法进行二次回归分析,得到相应的回归方程式如下:
Y=15.81+0.45X1+0.49X2+0.49X5+0.17X1X2+0.51X1X5+0.22X2X5-1.20X12-1.41X22-1.62X52。对回归模型进行方差分析,结果表明:该方程回归显著,模型的R2值为0.9649,说明回归方程的拟合程度良好,失拟较小。由表7可以看出,方程中 X1、X2、X5、X1X5、X12、X22和X52对Y值的影响显著,表明三个因素乳糖X1、蛋白胨X2、K2HPO4X3对酶活都有显著影响,而且与响应值间不是简单的线性关系。

表6 Box-Benhnken实验设计及结果Table 6 Experimental design and result of Box-Benhnken

表7 二次多项回归模型方程系数显著性检验Table 7 Significance test of regressive coefficient of regression equation
三个因素之间的交互作用情况见图8~图10。图8为当蛋白胨添加量位于中心水平时,乳糖浓度和K2HPO4浓度对发酵液酶活力影响的等高线图,由图可以直观地看出乳糖浓度和K2HPO4浓度的交互作用较强。图9为当K2HPO4浓度位于中心水平时,乳糖浓度蛋白胨浓度对酶活力影响的等高线图,由图可以看出乳糖浓度和蛋白胨浓度交互作用不大。图10为当乳糖浓度位于中心水平时,蛋白胨浓度和K2HPO4浓度对酶活影响的等高线图,由图可以看出蛋白胨浓度和K2HPO4浓度的交互作用也不大。
采用Design-Expert软件进行岭脊分析(Ridge Analysis),得出乳糖酶活力最大估计值为15.96U/m L,此时因素X1、X2、X5对应的实际浓度为:乳糖31.1g/L,蛋白胨26.0g/L,K2HPO43.0g/L。
2.2.4 验证实验 为检验响应曲面法所得结果的可靠性,采用上述优化发酵培养基进行验证实验,重复3次,测得的酶活平均值为15.95U/m L,与理论预测值基本一致,因此,基于响应曲面法所得的乳糖酶发酵培养基参数准确可靠。
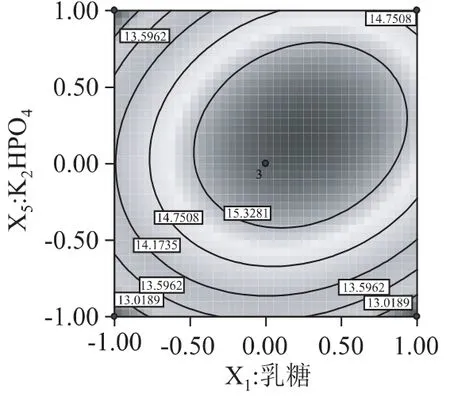
图8 乳糖与K2 HPO4浓度交互作用等高线图Fig.8 Contour plot for interaction effect between lactase and K2 HPO4 on production of lactose

图9 乳糖与蛋白胨浓度交互作用等高线图Fig.9 Contour plot for interaction effect between lactose and peptone on lactose production

图10 蛋白胨与K2 HPO4浓度交互作用等高线图Fig.10 Contour plot for interaction effect between peptone and K2 HPO4 on lactose production
3 结论
3.1 采用单因素实验对Enterobacter sp.SYA2产乳糖酶的发酵条件进行优化,得到最佳发酵条件为:培养温度37℃,装液量50mL/250mL,摇床转速175r/min,接种量5%(V/V),种龄8h。
3.2 在发酵培养基的优化实验中,首先通过Plackett-Burman实验筛选出对酶活影响显著的3个因素即乳糖、蛋白胨、K2HPO4,然后以爬坡实验结果为中心点,利用Box-Benhnken实验设计并进行响应面分析,优化得出发酵培养基为:乳糖31.1g/L,蛋白胨26.0g/L,酵母膏 5.0g/L,K2HPO43.0g/L,NaCl 6.0g/L,MnCl20.5g/L,pH 6.5。利用该培养基进行发酵培养,测得的酶活平均值为15.95U/mL,与理论预测值基本一致,证明了模型的可靠性。
[1] Sheik Asraf S,Gunasekaran P.Current trends of β-galactosidase research and application[M].Madurai:Formatex Research Center,2010:880-890.
[2]Manuela R,Valentina T,Alida M,et al.Influence of substrate on β-galactosidase production by Kluyveromyces strains[J].Annals of Microbiology,2008,58(4):705-710.
[3]Kennedy M,Krouse D.Strategies for improving fermentation medium performance:a review[J].Industrial Microbiology and Biotechnology,1999,23(6):456-475.
[4]李涛,岳田利,袁亚宏.Plackett-burman设计法筛选超声波提取苹果多酚工艺的主要影响因子[J].农产品加工·学刊,2007(3):18-21.
[5]高修功,王超,章克昌.数学统计法快速优化假单胞菌脂肪酶发酵条件[J].微生物学通报,1998,25(2):94-97.
[6]陈桂光,邵利,潘丽霞,等.响应面分析优化壳聚糖酶产生菌的发酵条件[J].食品科学,2008,29(10):380-383.
[7]张蕾,张铎,张丽萍,等.枯草芽孢杆菌BSD-2产抗菌肽发酵培养基的优化[J].食品科学,2010,31(3):189-192.
[8]Wang Y X,LU Z X.Optimization of cultivation conditions for exopolysaccharide and mycelial biomass by Clitocybe sp.using Box-Behnken design[J].Agricultural Sciences in China,2004,3(9):687-694.
[9]巨蕾,梁琪,乔海军,等.甘南牧区牦牛乳酸奶中产乳糖酶菌株的筛选、鉴定及产酶条件研究[J].食品工业科技,2012,33(12):239-254.
[10]Alazzeh A Y,Ibrahim S A,Song D,et al.Carbohydrate and protein sources influence the induction ofα-and βgalactosidases in Lactobacillus reuteri[J].Food Chemistry,2009,117(4):654-659.
[11]Hsu CA,Yu R C,Lee SL,et al.Cultural condition affecting the growth and production ofβ-galactosidase by Bifidobacterium longum CCRC 15708 in a jar fermenter[J].International Journal of Food Microbiology,2007,116(1):186-189.
[12]Batra N,Singh J,Banerjee U C,et al.Production and characterization of a thermostableβ-galactosidase from Bacillus coagulans RCS3[J].Biotechnology and Applied Biochemistry,2002,36(1):1-6.
[13]Confer D R,Logan B E.Increased bacterial uptake of macromolecular substrates with fluid shear[J].Applied and Environmental Microbiology,1991,57(11):3093-3100.
[14]Umasankar U,Annadurai G,Chellapandian M,et al.Xanthan production—effect of agitation[J].Bioprocess and Biosystems Engineering,1996,15(1):35-37.
[15]蔡国林,杨旭.黑曲霉产α-半乳糖苷酶发酵条件研究[J].中国酿造,2007(5):11-14.
[16]冯培勇,钟旭生.利用响应面法优化茶薪菇产纤维素酶的发酵条件[J].食品科学,2009,30(7):162-165.
——壳聚糖固定化乳糖酶条件的优化

