两种浒苔无机碳利用对温度响应的机制
徐军田,王学文,钟志海,姚东瑞,2
(1.淮海工学院海洋学院,连云港 222005;2.江苏省中国科学院植物研究所,南京 210014)
温度是影响生物过程最普遍的气候因素。迄今为止向大气排放的CO2已经使得地球比工业革命前变暖2.4℃,全球暖化的趋势在本世纪还将进一步的加速 (IPCC 2001),预计本世纪末温度将上升2—5℃,这将带来许多生物种的灭绝[1]。大型海藻构成海洋总初级生产力的10%左右,是近岸海域重要的初级生产者,在近岸碳循环中起着很重要的作用[2]。温度的变化对大型海藻的生长、代谢、碳平衡等产生重要影响,并进而影响到海藻季节与地理分布状况[3]。
在自然海水中,在通常的pH值(8.0—8.2)和20℃条件下的浓度约为2mmol,而 CO2仅为10 μmol,由于Rubisco利用CO2的半饱和常数(Ks)为30—60 μmol[4]。在长期的进化过程中,许多大型海藻形成了无机碳浓缩机制(CCMs)来更有效地利用无机碳进行光合作用。除直接利用扩散进入细胞的CO2外,CCMs主要包括以下途径:①依赖胞外碳酸酐酶(CA)的催化脱水形成 CO2,CO2进而被细胞吸收利用[5];②在细胞膜外酸性区域脱水而形成CO2,CO2进而被细胞吸收利用[6];③ 耗能的的直接吸收利用(此过程可被抑制剂DIDS所抑制)[7];④的协同运输或的反向运输[6]。这些机制得到了广泛的研究,实验主要以改变培养介质里的无机碳浓度以及pH值来测定这种机制的变化,但对于温度的效应,却未见报道。
浒苔(Ulva prolifera)和缘管浒苔(Ulva linza)是沿海潮间带常见的大型绿藻,也是近几年来绿潮爆发的主要种类,其生理特性对环境的变化得到了很好的研究[8-12],在此基础上本文以这两种浒苔为材料,研究无机碳利用机制对温度的响应,为探讨近岸大型海藻无机碳利用机制与温度变化的关系提供一定的实验基础,同时对了解绿潮在响应全球变暖过程中的变化提供一定的数据支持。
1 实验材料和方法
1.1 实验材料
缘管浒苔(Ulva linza)和浒苔(Ulva prolifera)分别采自于江苏连云港高公岛和连岛海域。材料用过滤海水清洗干净后,选取色泽鲜绿,长度适中的健康藻体于玻璃水族箱内暂养,暂养的条件是温度为15℃,光强为200μmol m-2s-1,光周期为12h∶12h;培养液为过滤的自然海水,每2d更换1次,每天24h通气培养。
1.2 pH值漂移曲线的测定
称取0.3g的缘管浒苔和浒苔藻体放于含有15ml过滤灭菌海水(pH值为8.0)的小玻璃瓶中,玻璃瓶放置于恒温光照培养箱内,将藻体充分舒展后封闭,水体用磁力搅拌器均匀搅动,光照控制为200μmol m-2s-1,温度为15℃。实验设3个重复,每个小瓶口接一个pH计探头,每隔一定的时间记录pH的变化,当pH稳定后结束测定,这个稳定点就是pH值补偿点。
1.3 光合作用的测定
用氧电极法(Hansatech,英国)测定缘管浒苔和浒苔的光合放氧速率。测定之前,把藻体用锋利的小剪刀剪成约0.2 cm2大小的小片(缘管浒苔)和约1cm长的小条(浒苔),在室内低光下适应1—2h(温度设定为测定时的温度),最大程度的消除藻体损伤带来的测定误差。然后称取大约20 mg鲜重的藻片(大约20片)放入装有2 mL反应介质的反应槽中。用循环水浴精确控制反应槽内的温度。饱和光强设置为600μmol m-2s-1。
1.4 无机碳利用机制的研究
为精确研究温度对缘管浒苔和浒苔无机碳利用的影响,采用藻类碳酸酐酶的抑制剂AZ(acetazolamide)和EZ(6-ethoxyzolamide)(Sigma)(用0.05 mol/L NaOH配制成5mmol/L的原液),最终反应介质中的浓度为100μmol。AZ不能渗透细胞而只抑制胞外CA酶的活性[13-14],而EZ能渗透细胞从而抑制胞内和胞外CA两者的活性[15]。通过和不加抑制剂的藻样进行对比,从光合作用的光响应曲线来分析温度的效应。
1.5 统计与分析
试验数据采用one-way ANOVA(turkey)分析(采用Origin 7.0分析软件),设显著水平为P<0.05,所有实验处理均为3个重复。
2 结果
pH漂移曲线表明这两种浒苔都有很强的无机碳利用能力,其pH补偿点分别高达10.19±0.01(缘管浒苔)和10.08±0.01(浒苔)(图1)。
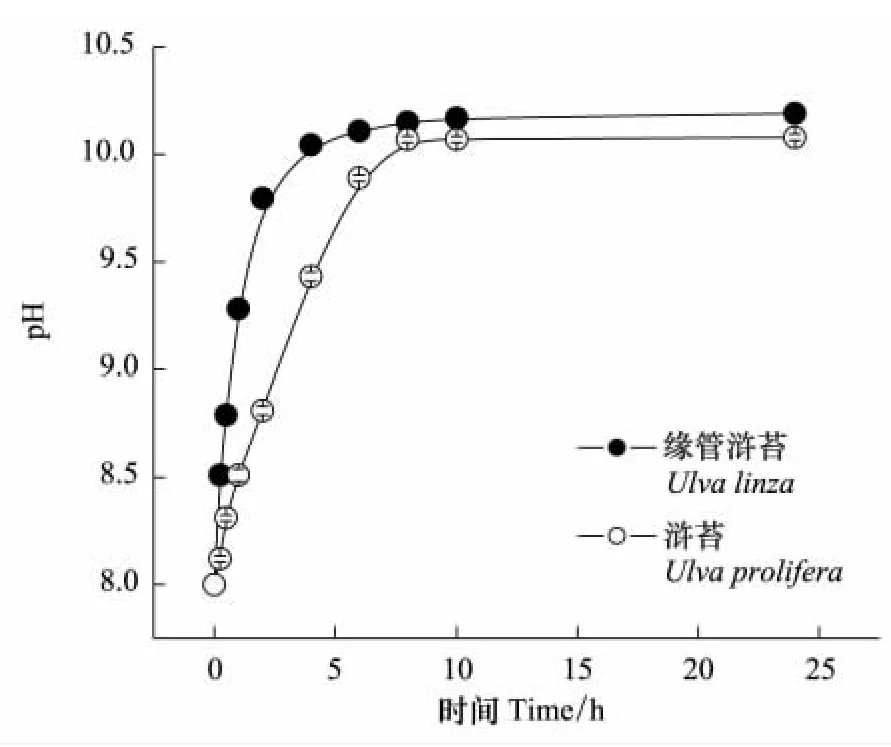
图1 缘管浒苔和浒苔在15℃、光强为200μmol m-2s-1的pH漂移曲线Fig.1 The pH-drift curves of Ulva linza and Ulva prolifera under 20℃ and 200μmol m-2s-1condition
为了探讨温度对两种浒苔无机碳利用能力的影响,测定了藻体在不同温度下和加入不同抑制剂情况下的最大放氧速率,从图中可以看出,缘管浒苔的最大光合作用速率(Pmax)随着温度的升高而显著增加,到25℃达到最大,但在30℃显著下降,下降比率为56%。当加入抑制剂AZ后,除在15℃外,其他温度下的Pmax受到显著的抑制。其Pmax随着温度的变化模式为,随着温度的升高,Pmax也显著增加,但到15℃后,Pmax维持在一个恒定的水平,直到30℃才显著下降。而加入抑制剂EZ后,藻体的Pmax在所有的温度下与加入AZ相比受到了更显著的抑制,其Pmax随温度的变化模式为,随着温度的升高,Pmax也显著增加,在30℃具有最大的Pmax(图2)。通过抑制剂对光合作用的抑制率来看,AZ处理的藻体在5℃和30℃最大,达到70%,而在15℃最小,抑制率为零。整个抑制率随着温度的变化呈“V”字形变动。而EZ处理的藻体,抑制率随温度的变化基本维持在85%的水平,只是在30℃时光合作用的抑制水平下降为80%(图2)。
浒苔的最大光合作用速率(Pmax)随着温度的升高而显著增加,到25℃达到最大,但在30℃显著下降,其下降比率与缘管浒苔相比要小,仅为20%。当加入抑制剂AZ后,所有温度下藻体的Pmax都受到显著的抑制,其随着温度的变化趋势和对照情况下一致,都是随着温度的升高而显著增加,在25℃达到最大,但在30℃显著下降。加入抑制剂EZ后,藻体的Pmax在所有的温度下与加入AZ相比受到了更显著的抑制,其Pmax随温度的变化模式为,5℃下浒苔具有最低的Pmax,10℃处理下浒苔的Pmax约是5℃的2.5倍,但随着温度的增加,Pmax却一直保持在10℃时的水平上,其处理间没有显著差异(图3)。通过抑制剂对光合作用的抑制率来看,AZ处理的藻体在5℃时最低,仅为16%,在10℃时其抑制率上升为55%,随着温度的上升,抑制率却保持稳定的水平,除5℃外,其他所有温度间的抑制水平没有显著差异。而EZ处理的藻体,抑制率随温度的变化在5℃和10℃较低,约为70%,随着温度的增加,其他温度处理下的抑制率基本维持在85%的水平(图3)。
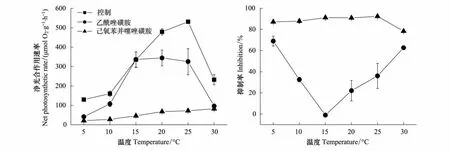
图2 缘管浒苔在正常和抑制剂AZ和EZ存在情况下最大光合作用速率随温度的变化图以及这两种抑制剂对藻体最大光合作用速率的抑制率Fig.2 The change of the maximum photosynthetic rate of Ulva linza as function of temperatures with or without AZ and EZ inhibitors and the inhibition ratio of AZ and EZ for the maximum photosynthetic rate
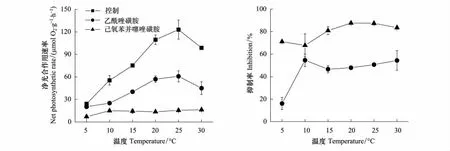
图3 浒苔在正常和抑制剂AZ和EZ存在情况下最大光合作用速率随温度的变化图以及这两种抑制剂对藻体最大光合作用速率的抑制率Fig.3 The change of the maximum photosynthetic rate of Ulva prolifera as function of temperatures with or without AZ and EZ inhibitors and the inhibition ratio of AZ and EZ for the maximum photosynthetic rate
3 讨论
本实验结果表明,缘管浒苔和浒苔的pH漂移曲线说明这两种海藻具有很强的无机碳利用能力,一般认为一种海藻的pH补偿点达到9.2以上就表示其具有有效的利用能力[16-17],而这两种海藻的pH补偿点可以高达10以上,这表明这两种海藻存在一种或者几种高效的体外无机碳转运形式。研究表明,缘管浒苔和浒苔具有明显的胞外和胞内碳酸酐酶活性,这是大型海藻胞外CA酶催化的利用方式,是大型海藻无机碳利用的最普遍和最基本的方式[18-19]。而胞外CA酶活性本身仅仅是加速与CO2之间的相互转化,而不能影响CO2的平衡浓度,并且形成的CO2主要是通过扩散作用而被动的进入细胞。这就意味着,这种方式的利用,在高pH(>9.4)时就不能很好地起作用,因为这时的CO2平衡浓度极低[20-21]。因此这表明,除胞外碳酸酐酶催化利用的方式外,缘管浒苔和浒苔必定还存在另外的利用方式。这在同属的肠浒苔(Ulva intestinalis)中得到证实,其有两种利用能力,即通过胞外CA酶催化的利用,以及通过阴离子交换蛋白抑制剂(4,4'-diisothiocyanatostilbene-2,2'-disulfonic acid,DIDS)敏感机制的直接吸收[21]。
通过比较缘管浒苔在不同温度下AZ对其最大光合作用速率抑制率,得到在温度最低的5℃和最高的30℃下,其抑制水平达到70%左右,这表明在这两个温度下无机碳的转运主要是通过胞外碳酸酐酶的催化作用,而其他的转运方式仅占很少的比例。而在15℃,加入胞外碳酸酐酶的抑制剂对藻体光合作用速率没有显著影响,这表明在这个温度下其他的转运方式可以弥补碳酸酐酶转运方式所起到的作用。而其他的温度下碳酸酐酶和其他转运方式各占有一定的比例。这些实验结果表明,除碳酸酐酶外的转运方式对温度具有很强的依赖性,在温度很低或者很高的情况下,其效率与碳酸酐酶相比受到明显的抑制,其最适的温度为15℃,在这个温度下其高的效率完全可以替代碳酸酐酶来为藻体进行有效的转运。
而对于浒苔来说,无机碳利用机制对温度的响应和缘管浒苔有显著的差异,AZ在温度最低的5℃具有最低的Pmax抑制率,其抑制水平仅为16%,这表明在低温的情况下,除胞外碳酸酐酶的活性外,其他的转运方式占有很高的比例。而从10℃开始,这种抑制水平就达到一个很高的值,并且一直保持在这个水平上(55%),这表明,当温度升高到10℃以后,碳酸酐酶催化转运所占的比率显著增加,其他的转运方式在无机碳利用过程中的作用与5℃相比显著下降,并且在10℃以后直到30℃,这种比率保持恒定。
缘管浒苔光合作用能力最强的温度是在25℃,而加入抑制剂EZ后,最高光合作用的温度为30℃,但这表明光合作用体系(包括光合作用电子传递、固碳以及碳获取的各个组分)里酶的最适温度是不相同的,EZ抑制了胞内外碳酸酐酶的活性,导致胞内无机碳库产生向Rubisco供应的CO2过程受到抑制[15],藻体利用的CO2是胞内碳酸盐系统中自然解离的产物,这样藻体的光合作用能力取决于RUBISCO酶的活性以及CO2的解离速度。而正常情况下,光合作用能力的大小必须要考虑无机碳转运体系里各种酶的活性以及效率。我们实验结果说明在30℃情况下,无机碳转运体系受到了一定程度的抑制,导致光合作用能力显著下降。
但对浒苔来说,其光合作用能力最强的温度也为25℃,加入抑制剂EZ后,最高光合作用速率从15℃开始就保持恒定的水平,这表明,在不同温度下影响光合作用能力的主要是无机碳转运体系所起的作用,当这些转运体系受到抑制后,藻体仅仅是利用海水中和体内自然化学解离形成的CO2,温度对其光合作用过程中各种酶的活性没有显著的影响。
综上所述,温度对缘管浒苔和浒苔的无机碳利用转运体系的影响是不同的,他们之间存在着明显的种间差异,缘管浒苔对温度的依赖性要强于浒苔,其对温度的适应范围要窄于浒苔,尤其是在高温下(30℃),缘管浒苔的最大光合作用能力与最适温度相比下降了56%,而浒苔仅为20%,这表明在高温的情况下,浒苔比缘管浒苔具有更强的生存适应能力,这是浒苔能够在绿潮藻占有绝对优势的原因之一,并且在北方海域浒苔绿潮的调查研究中得到证实[9]。对于缘管浒苔和浒苔的无机碳利用机制来说,其他转运的方式是在正常海水pH下就可以起到有效的作用,还是当胞外碳酸酐酶受到抑制后的诱导使其产生作用,这还需要进一步的研究。
[1] Romm J.Cleaning up on carbon.Nature Reports Climate Change,2008,doi:10.1038/climate.2008.59.
[2] Leigh E G,Paine R T,Quinn J F,Suchanek T H.Wave energy and intertidal productivity.Proceedings of the National Academy of Sciences of the United States of America,1987,84(5):1314-1318.
[3] Barry J P,Baxter C H,Sagarin R D,Gilman S E.Climate-related,long term faunal changes in a California rocky intertidal community.Science,1995,267(5198):672-675.
[4] Cook C M,Colman B.Some characteristics of photosynthetic inorganic carbon uptake of a marine macrophytic red alga.Plant Cell and Environment,1987,10(3):275-278.
[5] Smith R G,Bidwell R G S.Mechanism of photosynthetic carbon dioxide uptake by the red macroalga Chondrus crispus.Plant Physiology,1989,89(1):93-99.
[6] Lucas W J.Photosynthetic assimilation of exogenousby aquatic plants.Annual Review of Plant Physiology,1983,34(1):71-104.
[7] Raven J A,Lucas W J.The energetics of carbon acquisition//Lucas W J,Berry J A,eds.Inorganic Carbon Uptake by Aquatic Photosynthetic Organisms.Rockwell:American Society of Plant Physiologists,1985:305-324.
[8] Gao S,Chen X J,Yi Q Q,Wang G C,Pan G H,Lin A P,Peng G,Peer W A.A strategy for the proliferation of Ulva prolifera,main causative species of green tides,with formation of sporangia by fragmentation.PloS One,2010,5(1):e8571,doi:10.1371/journal.pone.0008571.
[9] Zhang X W,Xu D,Mao Y Z,Li Y X,Xue S Y,Zou J,Lian W,Liang C W,Zhuang Z M,Wang Q Y,Ye N H.Settlement of vegetative fragments of Ulva prolifera confirmed as an important seed source for succession of a large-scale green tide bloom.Limnology and Oceanography,2011,56(1):233-242.
[10] Xu J,Liu S,Zou D,Guo G L,Li X S,Liu S X.Responses of Enteromorpha linza to the copper exposure under different N growth conditions.Marine Science Bulletin,2010,29(6):643-648.
[11] Lin A P,Wang C,Qiao H J,Pan G H,Wang G C,Song L Y,Wang Z Y,Sun S,Zhou B C.Study on the photosynthetic performances of Enteromorpha prolifera collected from the surface and bottom of the sea of Qingdao sea area.Chinese Science Bulletin,2009,54(3):399-404.
[12] Xu J,Gao K.Future CO2-Induced ocean acidification mediates the physiological performance of a green tide alga.Plant Physiology,2012,160(4):1762-1769.
[13] Haglund K,Pedersén M.Growth of the red alga Gracilaria tenuistipitata at high pH:influence of some environmental factors and correlation to an increased carbonic-anhydrase activity.Botanica Marina,1992,35(6):579-587.
[14] Axelsson L,Mercado J,Figueroa F.Utilization ofat high pH by the brown macroalga Laminaria saccharina.European Journal of Phycology,2000,35(1):53-59.
[15] Sültemeyer D F,Schmidt C,Fork H.Carbonic anhydrases in higher plants and aquatic microorganisms.Physiologia Plantarum,1993,88(1):179-190.
[16] Maberly S C,Madsen T V.The contribution of air and water to the carbon balance of Fucus spiralis.Marine Ecology Progress Series,1990,62(1/2):175-183.
[17] Johnston A M,Maberly S,Raven J A.The acquisition of inorganic carbon by four red macroalgae.Oecologia,1992,92(3):317-326.
[18] Mercado J M,Figuroa F L,Niell F X,Axelsson L.A new method for estimating external,carbonic anhydrase activity in macroalgae.Journal of Phycology,1997,33(6):999-1006.
[19] Larsson C,Axelsson L.Bicarbonate uptake and utilization in marine macroalgae.European Journal of Phycology,1999,34(1):79-86.
[20] Axelsson L,Ryberg H,Beer S.Two modes of bicarbonate utilization in the marine green macroalga Ulva lactuca.Plant Cell and Environment,1995,18(4):439-445.
[21] Larsson C,Axelsson L,Ryberg H,Beer S.Photosynthetic carbon utilizatin by Enteromorpha intestinalis(Chorophyta)form a Swedish rockpool.European Journal of Phycology,1997,32(1):49-54.
参考文献:
[10] 徐军田,邹定辉,朱明,郭赣林,李信书,刘树霞.不同N水平下缘管浒苔对重金属铜的响应.海洋通报,2010,29(6):643-648.
[11] 林阿朋,王超,乔洪金,潘光华,王广策,宋厉芸,王志远,孙松,周百成.青岛海域漂浮和沉降浒苔的光合作用研究.科学通报,2009,54(3):294-298.

