七叶一枝花组织培养和种子萌发条件的研究
宋发军,黄宗华
(中南民族大学 生命科学学院,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
七叶一枝花(Parispolyphyllavar.chinensis)又名华重楼、蚤休等,是延龄草科(Trilliaceae)重楼属(Paris)多年生草本植物.最早在《神农本草经》中是以蚤休之名记载[1].七叶一枝花的野生资源匮乏,且七叶一枝花的种子成熟时,其未分化的胚停留在原胚阶段,有“二次休眠”的特性,需要2个低温和2个高温才能打破休眠,出苗困难,种子从繁殖到药用一般需要5~10年,急需寻找一种解决种子出苗困难问题的办法[2-4],虽然种子繁殖技术复杂,生长周期长,但繁殖系数大,故种子的快速萌发研究得到了广泛关注.
研究表明,杨丽云等[5]用云南重楼的芽作外植体进行组织培养,获得组培苗,但不能用于大田生产;李群等[6]用根茎为外植体,愈伤组织的诱导效果不理想;熊海浪等[7,8]用剥离了滇重楼种子的胚乳和子叶进行组织培养,只在光照下才能生长.王艳芳等[9]选择成熟果实的种子、去除种皮和用赤霉素处理,可提高滇重楼种子发根率和发根速度.目前人们最为关注的是七叶一枝花不同外植体的组织培养,因为在短期内可以获得大量种苗.本文主要从植物组织培养和七叶一枝花种子快速萌发两方面来研究,而种子的萌发以胚根长短及其萌发率为指标,研究温度、赤霉素、外源激素等对七叶一枝花种子对种子萌发过程的影响.
1 材料与方法
1.1 仪器和试剂
超净工作台(SWC-J-A智能型,上海新苗医疗器械制造有限公司),恒温箱培养箱(SPX-250BS-II型,上海新苗医疗器械制造有限公司),冰箱(BCD-277(KK28F76TI)型,博西华家用电器有限公司).
MS培养液(上海科兴贸易有限公司),2,4-D和NAA(上海科兴生化试剂有限公司)、 6-BA(上海拜力生物科技有限公司)、GA3(Sigma公司),PEG 6000(上海索诚化学试剂有限公司).
1.2 材料
2011年2月末,从恩施土家族苗族自治州神农架林区移栽带顶芽的七叶一枝花根状茎,种植于小钵子内.栽植时芽头向上,用手轻压根状茎入疏松的腐殖质土内,其上覆盖一薄层苔藓保持湿润,第一次浇透水,置于气候光照培养箱内供实验使用.3月,七叶一枝花开始长出苗,每年的秋末冬初季节,七叶一枝花开始倒苗,第2年又重新长出新的地上部分.
2011年9月末,从云南大理采集新鲜的七叶一枝花成熟种子,经刘学群教授鉴定后置于冰箱的密封塑料袋内使其腐烂,并用水流强的自来水洗去颖壳,再用手搓揉种子外种皮并用细孔筛筛去红色浆果的外种皮,余下白色种子,晾干后人工去除残留物,4℃保存备用[10].
1.3 方法
1.3.1 外植体的消毒与无菌外植体的获得
选取饱满的种子和当年的地下根茎为外植体,从顶芽下的第2和第3茎痕间切断根茎,带顶芽的继续留作种苗,其余的则留作外植体,用自来水大流速冲洗根状茎2~3 h(种子用蒸馏水浸泡24 h),然后进行无菌操作:用无菌水清洗外植体3~5次后置于75%的无水乙醇浸泡30 s,再用无菌水清洗3~5次,置于0.1%HgCl2浸泡根状茎10~15min,种子12~15min,最后用无菌滤纸吸干表面的水分[11].
1.3.2 种子和根茎的诱导培养基
不同浓度激素组合下的七叶一枝花种子和根茎的诱导培养基如表1所示,将不同的激素配比下的培养基分别命名为A~G.
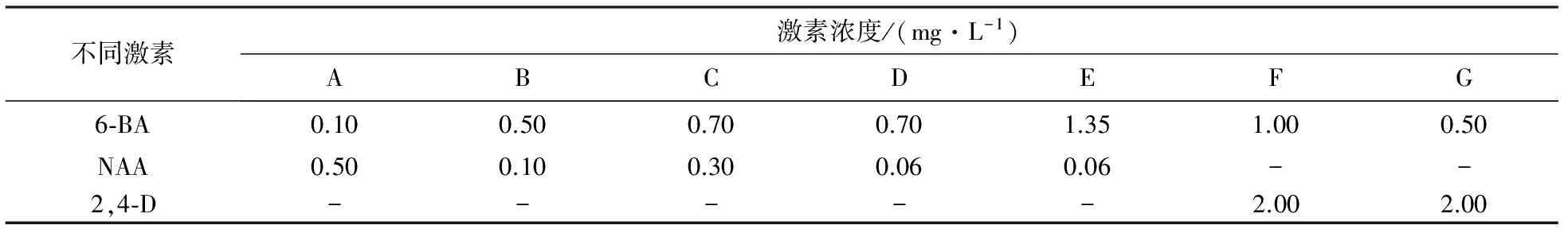
表1 不同浓度激素组合下的培养基
1.3.3 接种和培养
将种子接种在培养基A和B上,每个三角瓶接种3粒种子,共接种100粒种子,2个月时统计萌发率,2个月后将接种在A培养基上的种子换到B培养上继续培养.将根茎接种在培养基C、D、E、F和G上,每个三角瓶接种3块,共接种100块根状茎.取七叶一枝花种子诱导出的较好的愈伤组织,分别接种于继代培养基(与诱导培养基相同)上继代培养,继代1个月后,接种在预先配好的分化培养基(MS+0.5 mg/L 6-BA+0.1 mg/L NAA)上分化培养.
当种子的胚根突破种皮后长到2~3 cm时,无菌条件下去除其胚乳部分,置于15~22℃光照培养箱培养(1000 μmol·m-2·s-1,12 h)和暗培养继续培养.当种子的胚根长到3~4 cm时,从尖端处向上切去胚根根尖约1~2 cm,种子长根的另一端切去部分种皮,继续在相同的诱导培养基和条件下培养.
1.4 浸种处理和数据统计
采用实验前的浸种处理,用不同浓度的GA3、6-BA、2,4-D和PEG 6000(如表2)对七叶一枝花的种子浸泡24 h,重蒸水作对照,放在20℃黑暗条件下.1 d后倒掉浸种的溶液,用自来水反复冲洗数次,直至洗净残留液体,再用蒸馏水和重蒸水冲洗5次,无菌下处理种子.
超净工作台内用无菌水洗3~5次,75%酒精消毒30 s,0.1%升汞浸泡10~15 min,无菌水洗3~5次,在150 cm的2层滤纸的培养皿内培养,滴加无菌水湿润滤纸并封好培养皿,置于人工气候培养箱(20±2)℃暗培养,每隔3~5 d观察1次.若发现有轻微发霉的种子,用无菌水清洗后在放回原处;若发霉数量较多,则及时更换发芽滤纸.
以胚根的长度和萌发率来表示胚根的生长情况:最长胚根长度=规定日期内胚根达到一定长度的种子,萌发率=胚根突破种皮时的种子数/供试种子数×100%.
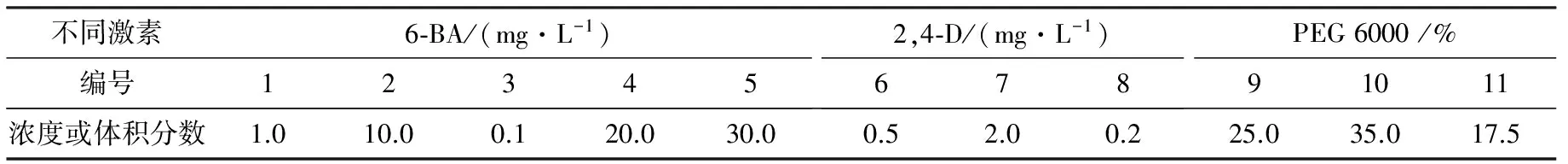
表2 不同浓度的GA3,2,4-D和PEG6000培养基组成
2 结果与分析
2.1 6-BA、NAA和2,4-D的不同浓度组合对种子和根茎愈伤组织的影响
将6-BA、NAA和2,4-D以表1中的不同浓度组合作为培养基培养种子和根茎,发现接种在A培养基上的种子胚根突破种皮的时间较B培养基短,萌发率较B 培养基高.由于接种在A培养基上的种子,细胞分裂素的浓度低于生长素的浓度,促进根的形成;而B培养基细胞分裂素的浓度高,促进芽的分化.在A培养基上还能诱导出愈伤组织,接种在B培养基上能分化出芽;而在B上则没有诱导出愈伤组织.
接种在C、D、E、F和G培养基上的根状茎,只在D上诱导出了愈伤组织,诱导率低,且未分化出苗,30瓶只有4瓶诱导出愈伤组织.原因是C培养基的细胞分裂素和生长素的浓度相差不大,不能起到协同促进作用;而E培养基浓度相差过大,也未诱导出愈伤组织;D培养基比例浓度适合诱导出愈伤组织,但诱导率不高,说明还可以适当地调节细胞分裂素和生长素的浓度,以诱导出更多的愈伤组织,进而分化出苗.F和G生长素的浓度较细胞分裂素高,未诱导出愈伤组织,原因是相差2~4倍不能满足要求,需要更大的倍数才能诱导出愈伤组织.
2.2 不同温度、光照条件对根状茎诱导效果的影响
植物组织的培养需要一定的温度和光照.实验结果表明:在17~22℃诱导效果变化不大.相同温度下12 h光照处理与暗培养的差别是:光照强度越大,愈伤粒(图1)越壮大,颜色由泛白-白中带黄点-淡黄-黄色逐渐加深,愈伤表面逐渐由干爽变为不干爽,愈伤诱导率下降,这是由于光合作用可促进生长,但光照强度过大使培养基内水分蒸发,吸附在玻璃内壁上,愈伤粒表面吸水,颜色变黄,诱导率降低.15℃也能使根状茎诱导出愈伤组织,但诱导率不高且生长缓慢.实验中所取的根茎外植体多年生于土中,污染较严重.

图1 根状茎的愈伤组织
2.3 6-BA和NAA对种子诱导效果的影响
6-BA和NAA对种子诱导效果的影响见图2.由图2中有的直接诱导出愈伤组织(图2a);有的诱导出愈伤组织还同时长出芽(图2b);有的培养一段时间后发现,愈伤组织不断褐化甚至变黑(图2c);有的未分化出苗,但芽不断地长大,最后分化出茎和子叶,根状茎也在不断地膨大加粗,60 d后膨大的根茎处开始分化出第2个芽(图2d).

a)种子的愈伤组织;b)种子的愈伤组织和芽;c)愈伤组织变黑,芽逐渐分化;d)根状茎分化出第2个芽
2.4 不同处理后种子培养结果分析
切去根尖尖端1~2 cm后,发现约2个月时在其切口部位长出一个膨大的圆形的突起(见图3),再将其膨大的部位纵横各切1刀得4块组织继续培养.1个月后,在其中的1块膨大的部位上分化出1团薄壁细胞.种子长根的另一端切去部分种皮,发现有子叶伸出,但一段时间后不再变化,由于当胚根出现时,子叶并未立即出现,说明七叶一枝花存在“上胚轴休眠”现象,胚根生长比子叶和胚轴更快,子叶的分化和发育最慢.

图3 根尖长出膨大的突起
去掉胚乳的带胚根的种子培养一段时间后发现要分化出子叶的那一部位渐渐枯萎,最后死掉.由于去掉了胚乳的养分后,培养基内的营养不能满足其生长的要求,或因激素的浓度和蔗糖的渗透调节性不佳,不能促其生长而最终死掉;或因光照大,导致光合作用强,水分蒸发快,使其缺少水分而渐渐枯萎死掉.
2.5 种子萌发率统计
不同GA3,2,4-D和PEG6000配比下对种子萌发率的影响结果见表3.由表3可知,GA3能不同程度地诱导胚根长出,2个月时除去烂掉和染菌的的种子,种子的发芽率都很高;2个月时2 mg/L 2,4-D (7号)对种子的发芽率有抑制作用,低于6号和8号而35%的PEG6000(10号)的发芽率比9号和11号高,说明低浓度的PEG对种子引发的效果没有高浓度效果好,且整齐度高.

表3 不同GA3,2,4-D和PEG6000配比对种子萌发率的影响
3 讨论
在对七叶一枝花的组织培养中,影响种子诱导率的条件有成熟种子的预处理的方法、培养基的成分、培养条件和细胞分裂素和生长素等.选择合适的外植体和植物激素是体外增殖的重要因素,而植物组织培养的目的即降低繁殖的时间增加植物的数量.培养根状茎一段时间后发现:在根状茎的外植体上有不同程度的污染现象,由于有内生真菌的存在,在培养的初期,内生真菌未立刻显现出来,在继代过程中,潜伏的内生菌不断出现,污染材料导致诱导率下降,可考虑在培养基加抗生素或消毒液中加Tween-20.
在30 mg/L GA3萌发率最高,故可考虑加大浓度,寻找一个使种子萌发更高的最低的GA3的浓度.PEG是较为理想的渗透剂,它是一种高分子惰性物质,有各种分子量类型,在种子处理时分子量 6000~10000,浓度以20%~30%为佳.PEG在大豆、高粱、水稻、菠菜、花生等作物种子处理上都表现出明显效果,特别是活力低的种子经处理后活力明显提高.应用 PEG处理种子时,要通过预试验摸索最佳的剂量、温度和时间等条件,然后在大田中应用.后续实验还可考虑用PEG8000、PEG10000和PEG20000对七叶一枝花的种子进行处理,获得更高的萌发率和幼苗整齐度,并检测激素含量的变化和发生这种变化的机制.野生七叶一枝花具有广阔的应用前景,应用植物组织培养能解决其培养过程中的某些问题,也可推动我国中药材的发展和进步.
[1]张 嫚,李彦文,李志勇,等.重楼属药用植物的研究进展[J].环球中医药,2011,4(2):145-148.
[2]陈 伟,马绍宾,陈宏伟.生境对滇重楼种子发育与萌发的影响[J].湖北农业科学,2011,50(5): 972-974.
[3]黄 玮,孟繁蕴,张文生,等.滇重楼种子休眠机理研究[J].植物生理科学,2008,24(12):242-246.
[4] Ye Y,Chen S,Wang L,et al.Effects of stratification at different temperatures on the embryo differentiation and development ofparispolyphyllavar.yunnanensis seeds[J].Pak J Bot,2011,43(3):1507-1512.
[5]杨丽云,陈 翠,吕丽芬,等.云南重楼的组织培养与植株再生[J].植物生理学通讯,2008,44(5):947-948.
[6]李 群,陈丽萍,葛方兰.重楼属植物愈伤组织的诱导和培养[J].四川师范大学学报,2006,29(1):120-122.
[7]熊海浪,于振艳,张宗申,等.影响濒危药用植物滇重楼愈伤组织发生的因素[J].时珍国医国药,2012,23(6):1372-1374.
[8]熊海浪,易继财,张宗申.滇重楼种子萌发及组织培养研究[J].广东农业科学,2011,38(21):47-49.
[9]王艳芳,唐 玲,李荣英,等.影响滇重楼种子萌发及胚根生长因素的研究[J].云南中医学院学报,2012,35(2):28-31.
[10]Madhav K C,Sussana P,Pramod J.Ecological Study ofparispolyphyllaSM.[J].ECOS (Nepal),2010,17:87-93.
[11] Jaimsha Rani V K,Fijesh P V,Padikkala J.Micropropagation of ophiorrhiza eriantha wight.throught leaf explant cultures[J].Plant Tissue Cult & Biotech,2010,20(1):13-20.

