某蛋用型父母代鸡群种蛋中禽白血病病毒的检测
王海燕 李志松 李志杰
某蛋用型父母代鸡群种蛋中禽白血病病毒的检测
王海燕 李志松 李志杰
(山东省寿光市纪台镇畜牧兽医管理站,262722) (山东省寿光市畜牧兽医管理局) (山东畜牧兽医职业学院 山东 潍坊)
为了检测某蛋用型父母代鸡群是否存在外源性禽白血病病毒(ALV)的感染,收集该鸡群的92枚鸡胚,每枚鸡胚无菌取蛋清2份,一份用禽白血病病毒p27抗原检测试剂盒直接检测群特异性p27抗原,同时分别将92枚鸡胚蛋清接种DF1细胞,培养维持8d后取细胞上清检测p27抗原。将p27抗原阳性样品,分别用针对ALV-J和ALV-AB的单因子血清做间接免疫荧光检测(IFA)。比较p27阳性检出率。结果表明,直接检测蛋清的检出率高于蛋清接种DF1后的细胞上清,接种DF1细胞后p27抗原阳性样品的IFA检测结果显示ALV-J的阳性率为100%,ALV-AB全部为阴性。说明该蛋用型父母代鸡群存在的外源性ALV感染主要是ALV-J,该研究为针对ALV的净化提供了可行性检测方法。
父母代 种蛋 禽白血病病毒 p27抗原 间接免疫荧光
禽白血病(Avian Leukosis,AL)是由禽白血病病毒(Avian Leukosis Virus,ALV)和禽肉瘤病病毒(Avian Sarcoma Virus,RSV)引起的禽类多种肿瘤性疾病的统称。本病除了肿瘤等一些特殊病变外,常继发细菌感染或严重干扰对鸡新城疫、禽流感等疫苗的免疫效果,而且还常常通过种蛋引发垂直感染,引起诸多纠纷。
从20世纪60年代起,国际大型种鸡公司已开始对ALV实行严格的净化措施,主要是通过剔除感染种鸡,切断垂直传播途径并将后代隔离饲养。经过多年的努力,到80年代中期,在商业化鸡群中外源性ALV感染已基本被清除,很少被检测到。1989年,在白羽肉用型鸡群中又出现了具有更强致病性和传播能力的ALV-J,并流行到世界各地,给世界肉鸡产业带来了巨大的经济损失[1-3]。近几年来,我国各地蛋鸡场在鸡群开产后发生禽白血病/血管瘤的病例显著增多,该病已成为影响我国蛋鸡业的重要疫病之一。病毒分离鉴定表明,近年来在我国产蛋鸡开产后发生的白血病/血管瘤主要是由ALV-J引起,但也同时也大量存在由A、B亚群ALV感染引起。实际上,ALV-J的流行状况,最初主要表现在从国外引进的白羽肉用型种鸡[4,5,6],随后发现ALV-J在我国蛋用型鸡[7,8,9,10]、南方的三黄鸡[11]和我国的纯地方品系[12,13]中也开始引发骨髓样细胞瘤的广泛流行。本研究从某疑似感染ALV的父母代种鸡场种蛋中完成了对ALV的分离鉴定。
1 材料与方法
1.1 样品来源与背景 某海兰褐父母代蛋鸡种鸡场剖检多次观察到肿瘤,怀疑感染有ALV。为了确认并评估本鸡群ALV感染的风险,从该种鸡场随机采集种蛋92枚。以无菌操作的方式,每枚鸡胚取2份蛋清,置于-80℃冰箱中保存备用。
1.2 主要试剂与试剂盒 ALV-J和A/B单因子血清由本实验室制备和保存,异硫氰酸荧光素(FITC)标记的羊抗鸡二抗购自SIGMA公司。DF-1细胞购自ATCC并由本实验室保存,小牛血清购自大理邓川锦洋生物工程公司。禽白血病病毒p27抗原ELISA检测试剂盒购自美国IDEXX公司。
1.3 蛋清ALV-p27抗原的直接检测 将冻存的蛋清反复冻融3次后用禽白血病病毒p27抗原检测试剂盒检测ALV的群特异性抗原p27,具体操作严格按照试剂盒说明书进行。
1.4 蛋清接种细胞后ALV-p27抗原的检测 将92份蛋清,用在4℃预冷的细胞维持液进行5倍稀释(用2ml细胞维持液稀释500ul的蛋清)接至含DF1单层细胞的24孔板上,每孔1ml,每份样品接1孔,同时设阴性对照。接种的细胞在37℃培养箱中孵育2h后弃掉培养上清液,更换成含1%新生小牛血清的DMEM维持液;继续在37℃培养箱中培养7d后,收集培养上清液,反复冻融3次,取200uL用IDEXX公司ALV-p27抗原检测试剂盒检测p27抗原。
1.5 ALV-J和ALV-A/B的IFA检测 将DF1细胞培养的经ELISA试剂盒检测p27为阳性的蛋清样品,分别传至带有飞片的六孔板中,继续培养3d后,将飞片取出固定后分别用ALV-J和ALV-AB的单因子血清做IFA检测[23]。
2 结果与分析
2.1 种蛋中ALV-p27抗原的检测结果比较 92枚鸡蛋蛋清直接检测ALV p27抗原的阳性率为36.96%。而92份蛋清接种DF-1后p27抗原检测结果显示,4份样品为阳性,显示该鸡群存在外源性ALV感染,阳性率为4.35%。比较p27阳性检出率的结果表明,直接检测蛋清的检出率高于蛋清接种DF1的细胞上清,这说明存在大量的内源性ALV的表达。结果见表1。

表1 蛋鸡场种蛋中p27抗原的阳性比率
2.2 IFA检测ALV-J,ALV-A/B与ELISA检测p27抗原的结果比较 IFA检测结果表明,4份经DF1培养的ALV阳性样品有4份为ALV-J阳性。与未感染ALV-J的样品相比,阳性样品的胞质内均有明显的特异性绿色荧光,细胞核未被染色呈现灰暗色;ALV-AB均为阴性。IFA与p27抗原的ELISA检测结果比较表明,该鸡群中存在的ALV感染主要为ALV-J。结果见表2。
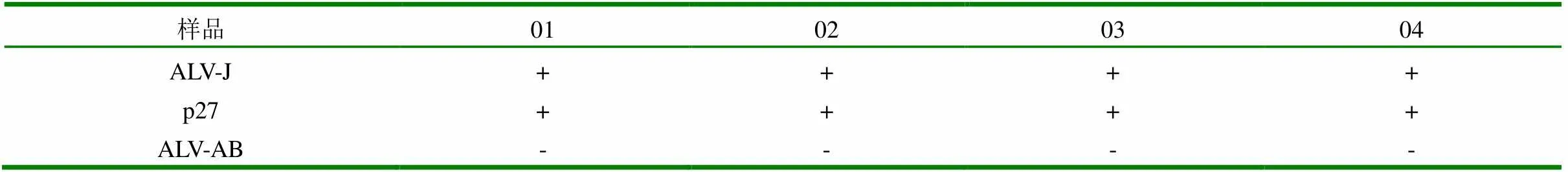
表2 IFA检测ALV-J、ALV-AB与ELISA检测p27抗原的比较结果
3 讨论
ALV引起的肿瘤病是目前危害养鸡业的主要疾病之一,已在世界范围内呈蔓延。近几年来,不断有蛋鸡感染禽白血病的报道[14,7,8,9,10],许多种鸡场都很关心蛋鸡禽白血病的感染来源,对种鸡群进行检测与净化已经势在必行。国际大型蛋用型祖代鸡场公司尽管一直在实施ALV的净化措施,但却不能完全排除外源性ALV的感染,并且美国已有报道证明,近年来在美国市场上使用的几种马立克疫苗中都检测出了ALV的污染[15,16],相关种禽企业可能使用了这些疫苗,从而造成了ALV的感染。鉴于ALV的垂直传播特性,这些企业即使在发现感染后重新采取净化措施,也不能保证在几年内就实现100%的净化。本研究采集某蛋鸡场父母代鸡群的92枚种蛋对ALV进行了检测,评价了该蛋鸡场父母代鸡群ALV的感染状态。
所有ALV检测方法中,ELISA最为常用,而DF1对内源性ALV有抗性,可区分有致病性的外源性ALV,对种蛋蛋清接种DF1培养后的细胞上清的ELISA检测可用于剔除内源性ALV感染的种鸡。本研究采用ELISA方法检测了92枚种蛋蛋清ALV-p27抗原与92枚种蛋蛋清接种DF1细胞上清中的ALV-p27抗原。比较p27抗原阳性检出率的结果表明,直接检测蛋清的检出率高于蛋清接种DF1的细胞上清。由于ALV对外界的抵抗力很弱,在运输、取样或接种过程中会由于温度等外界因素而失去传染性,而蛋清中的p27属于衣壳蛋白,不易变性,故直接检测蛋清p27的阳性率会远远的高于检测蛋清接种细胞的细胞上清p27,因此采用种蛋蛋清直接检测ALV-p27的方法检测ALV更加有利于ALV阳性蛋鸡的及时剔除,而且该研究方法较经典的采集抗凝血进行病毒分离的方法更为简便。对4份经DF1培养的外源性ALV阳性样品分别用ALV-J和ALV-A/B单因子血清进行的IFA检测结果显示,4份ALV-J均呈阳性,ALV-AB均呈阴性。表明,该蛋用型鸡场父母代鸡种蛋中感染的外源性ALV为ALV-J。
本研究通过对某父母代蛋鸡种蛋蛋清中ALV-p27抗原及细胞培养后p27抗原的检测,评价了该蛋鸡场父母代鸡群ALV的感染状态,为不同种鸡群ALV的净化提供了可行性方法,同时提供了禽白血病防控技术体系所需的实验室检测依据与可靠的流行病学资料。
[1] Payne L N, Brown S R,et al. A novel subgroup of exogenous avian leukosis virus in chickens[J]. J Gen Virol, 1991, 72: 801-807.
[2] Payne L N, HowesK, et al. Host range of Rous sarcoma virus pseudotype RSV(HPRS-103)in 12 avian species: support for a new avian retrovirus envelope subgroup, designated J[J]. J Gen Virol, 1992, 73: 2995-2997.
[3] Coffin J M.Structure and Classification of Retroviruses.In J.A.Levy, (Ed), New York:Plenum Press. 1992. The Retroviridae, vol.1(pp.19-49).
[4] 杜岩, 崔治中等. 鸡的J亚群白血病病毒的分离及部分序列比较[J]. 病毒学报. 2000, 16: 341-346.
[5] Cui Z, Du Y, et al. Comparison of Chinese field strains of avian leukosis subgroup J viruses with prototype strain HPRS-103 and United States strains[J]. Avian Dis,2003, 47, 1321-1330.
[6] 张志, 崔治中等. 商品代肉鸡J亚群禽白血病的病理及病毒分离鉴定[J]. 中国兽医杂志, 2002,38: 6-8.
[7] Xu B, Dong W, et al. Occurrence of avian leukosis virus subgroup J in commercial layer flocks in China[J]. Avian Pathol, 2004,33(1): 13-17.
[8] 王辉, 崔治中等. 蛋鸡J亚群白血病病毒的分离鉴定及序列分析[J]. 病毒学报, 2008, 24: 369-375.
[9] 成子强, 张利等. 中国麻鸡中发现禽J亚群白血病[J]. 微生物学报, 2005, 45: 584-587.
[10] 何爱飞, 徐春志等. 蛋鸡血管瘤型禽白血病的诊断[J].动物医学进展, 2009, 30(1): 112-115.
[11] Sun S, Cui Z. Epidemiological and pathological studies of subgroup J avian leukosis virus infections in Chinese local”yellow” chickens[J]. Avian Pathology. 2007,36(3): 221-226.
[12] 秦爱建, 崔治中等. 抗J亚群禽白血病病毒囊膜糖蛋白特异性单克隆抗体的研制及其特性[J]. 畜牧兽医学报, 2001, 32(6): 556-562.
[13] 张洪海, 刘青等. 地方柴鸡中J亚群禽白血病与马立克氏病的混合感染[J].畜牧兽医学报, 2009,40(8): 1215-1221.
[14] Purchase, HG., D.G.Gilmour, C.H.Romero, andW. OkaZaki. 1977. Post infeetion genetic Resistance to avian lymPhoid leukosis resides in a B traget cell.Nature270:61-62.
[15] 徐镇蕊, 董卫星, 何召庆等. 间接荧光抗体法快速诊断海兰褐蛋鸡J亚群禽白血病的研究[J]. 中国兽医杂志, 2002, 38(6): 6-8.
[16] Cottal, G, E., B. R. Burmester, and N.F. Waters. Egg transmission of avian lymphomatosis. Poult Sci 1954,33:1174-1184.
[17] deBoer, G.F., 0.J.H.Devos, and H.J.L. Mass.The incidence of lymphoid leukosis in Chiekens in the Nether lands.Zooteehniea Int 1981, 10: 32-35.
[18] 徐镇蕊, 董卫星, 何召庆等. 间接荧光抗体法快速诊断海兰褐蛋鸡J亚群禽白血病的研究[J]. 中国兽医杂志, 2002, 38(6): 6-8.
[19] 徐镔蕊, 董卫星, 余春明. 蛋鸡J亚群禽白血病的分子生物学诊断[J]. 病毒学报, 2005. 21(4): 289-292.
[20] 崔治中. 鸡白血病及其鉴别诊断和预防控制[A]. 鸡淋巴白血病防控技术研讨会论文集[C], 山东农业大学. 2010. 1-12.
[21] Sandelin K.and Estola T..Testing and management of a specific pathogen free chicken flock with special reference to avian leukosis virus infections[J]. Acta Veterinaria Scandinavica, 1975. 16: 341-356.
[22] 杨玉莹, 叶建强, 赵振华等. J亚群禽白血病病毒的分离与鉴定[J]. 中国病毒学, 2003. 18(5): 46-50.
[23] Qin A, Lee LF, Fadly AM, et al. Development and characterization of monoclonal antibodies to subgroup J avain leukosis. Avian Dis, 2001, 45: 938-945.
(2014–03–31)
S858.3
A
1007-1733(2014)05-0006-03

