原花青素对营养肥胖模型大鼠氧化应激的影响
肖俊松,王 莹,宋雪琳,吴 华,单静敏,曹雁平,*
(1.北京工商大学 食品添加剂与配料北京高校工程研究中心,食品风味化学北京重点实验室,北京 100048;2. 江汉大学生命科学院,湖北 武汉 430058)
原花青素对营养肥胖模型大鼠氧化应激的影响
肖俊松1,王 莹1,宋雪琳1,吴 华2,单静敏1,曹雁平1,*
(1.北京工商大学 食品添加剂与配料北京高校工程研究中心,食品风味化学北京重点实验室,北京 100048;2. 江汉大学生命科学院,湖北 武汉 430058)
以高脂饲料喂养Wistar大鼠建立营养 肥胖模型,然后灌胃不同剂量葡萄籽原花青素4周,研究其对大鼠肥胖程度、氧化应激和炎症的影响。结果表明:与模型组相比,葡萄籽原花青素可显著降低肥胖大鼠体质量、肾周脂肪水平、肝脏湿质量、血清甘油三酯及血清总胆固醇水平,但对血清高密度脂蛋白和血清低密度脂蛋白水平无影响;葡萄籽原花青素可显著降低大鼠血清中丙二醛水平,升高超氧化物歧化酶和过氧 化氢酶水平,但对谷胱甘肽过氧化物酶水平无影响;葡萄籽原花青素可降低白细胞介素-1的水平,且与原花青素剂量相关;对内毒素以及肿瘤坏死因子-α的水平无显著影响,但可显著恢复由高脂膳食导致的异常高的肠道壁通透性。
葡萄籽原花青素;肥胖;氧化应激;炎症因子
原花青素是一类多酚类物质,是以黄烷-3-醇,如(+)-儿茶素和(-)-表儿茶素为单体,通过C4—C6或者C4—C8键连接而成的聚合物[1]。原花青素是植物重要的次生代谢物,广泛的存在于人类的膳食中,在果蔬中含量尤其丰富[2]。
原花青素有良好的抗氧化、清除自由基、减肥、消炎等生理活性[3-5]。流行病学调查也显示,膳食中原花青素等多酚类物质的摄入,能显著降低肥胖、糖尿病等代谢疾病发病几率[6],其机制已有较多研究。
近年来研究发现,在高脂膳食诱导大鼠肥胖过程中,肠道菌群和内毒素扮演了关键角色[7]。高脂膳食导致肠道菌群结构改变和肠道通透性异常,进一步导致机体内毒素水平的增加,内毒素水平升高,则会诱导慢性炎症,改变机体健康表型,如肥胖、胰岛素抵抗和糖尿病等[8-9]。原花青素可能通过对肠道菌群及内毒素水平产生影响,缓解炎症及与之相关的机体氧化应激状态,起到降低肥胖程度的作用。
因此,本实验以高脂膳食诱导建立Wistar大鼠营养肥胖模型,探讨原花青素对高脂膳食诱导营养肥胖模型大鼠肥胖程度、体内氧化应激状态、炎症水平、肠道壁通透性以及内毒素水平的影响,为后续研究提供参考。
1 材料与方法
1.1 材料、动物与试剂
葡萄籽原花青素(≥95%) 天津尖峰天然产物公司。
SPF级Wistar雄性大鼠90只(90±10)g,购自北京华阜康生物科技股份有限公司。
丙二醛( malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;大鼠内毒素试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-1(interleukin-1,IL-1)试剂盒、白细胞介素-6(interleukin-6,IL-6)试剂盒及D-乳酸试剂盒 美国Rapid-Bio公司。
1.2 仪器与设备
Multiskan MK3全自动多功能酶标仪 美国Thermo公司;全自动生化分析仪 美国贝克曼库尔特有限公司;UV-2000型紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 动物实验
营养肥胖模型的复制:出生3周后断乳SPF级Wistar雄性大鼠90只,饲养于SPF级动物房,温度25℃,湿度约30%,光照10~12 h/d。适应性喂养3 d后开始造模,造模方法为:随机抽取8只大鼠,给予正常大鼠饲料,其余大鼠给予高脂饲料。6周后,称量体质量,以体质量超过正常组大鼠平均体质量20%为造模成功。
造模成功后开始进行药物处理,正常组大鼠8只,普通大鼠饲料,灌胃蒸馏水。造模成功的大鼠给予高脂饲料,并随机分为模型组,原花青素高、中、低剂量组,每组8只,各组间体质量无显著差异,分别灌胃蒸馏水,葡萄籽原花青素400、250、100 mg/(kg·d)。灌胃4周后,隔夜禁食,测定体质量,戊巴比妥麻醉大鼠,股动脉取血,用于生化指标测定;测定肝脏、肾和肾周脂肪湿质量。
1.3.2 生理生化指标测定
大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)采用全自动生化分析仪测定;SOD、MDA、CAT以及GSH-Px采用试剂盒显色,用分光光度法测定;血清内毒素、TNF-α、IL-1、IL-6及D-乳酸采用酶联免疫试剂盒检测。
1.4 数据处理与分析
采用DPS v7.05软件,利用邓肯(Duncan)新复极差法进行显著性分析,来比较任意不同2个处理组的效应之间差异及差异显著性。
2 结果与分析
2.1 原花青素对肥胖大鼠肥胖相关指标的影响
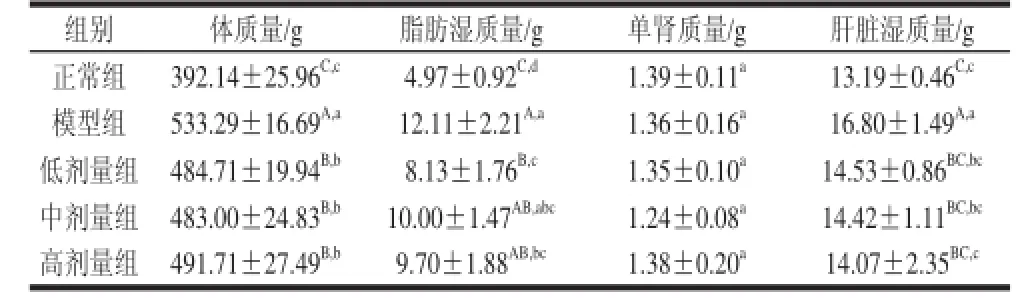
表1 原花青素对大鼠体质量、体脂、脏器质量的影响(x =8)Table 1 Effect of grape seed procyanidins on body weight, perinephrit fat, kidney and liver weight of rats (x ±s,n = 8)
从表1可见,模型组体质量、脂肪湿质量、肝脏湿质量均显著高于正常组,表明模型在整个实验过程中均有效。与模型组相比,原花青素3个剂量均可极显著降低肥胖大鼠体质量,显著降低体脂含量,极显著降低肝脏湿质量。各组肾质量均无显著差异,提示高脂膳食及灌胃原花青素可能对肾质量无显著影响。
表2 原花青素对大鼠血清TC、TG、LDL-C和HDL-C的影响(x = 8)Table 2 Effect of grap seed procyanidins on total cholesterol, triglycerides, high-density and low-density lipoproteins in rat serum

表2 原花青素对大鼠血清TC、TG、LDL-C和HDL-C的影响(x = 8)Table 2 Effect of grap seed procyanidins on total cholesterol, triglycerides, high-density and low-density lipoproteins in rat serum
组别 TG含量/(mmol/L)TC含量/(mmol/L)HDL-C含量/(mmol/L)LDL-C含量/(mmol/L)正常组 0.97±0.21a 1.77±0.17ab 0.63±0.08A 0.16±0.05b模型组 0.92±0.23a 1.94±0.36a 0.43±0.11B 0.24±0.05a低剂量组 0.64±0.18b 1.66±0.22b 0.41±0.04B 0.23±0.05a中剂量组 0.71±0.20ab 1.69±0.11b 0.41±0.04B 0.26±0.08a高剂量组 0.72±0.34ab 1.67±0.20b 0.40±0.06B 0.24±0.08a
从表2可见,与正常组相比,模型组的TG、TC水平无显著差异,LDL-C水平显著升高,HDL-C水平显著降低。与模型组相比,葡萄籽原花青素可显著降低TC水平,低剂量组可显著降低血清TG水平,但对LDL-C和HDL-C均无显著影响。
2.2 原花青素对肥胖大鼠氧化应激状态的影响
高脂膳食诱导肠道菌群紊乱,导致内毒素水平升高,诱发机体炎症,与此同时伴随着机体处于氧化应激状态[10-11]。从表3可见,与模型组相比,中剂量组原花青素可显著升高CAT的水平,高剂量原花青素可显著升高SOD的水平,同时,均可显著降低MDA的水平,但3个剂量原花青素对GSH-Px水平无显著影响。这说明,原花青素可以通过促进CAT、SOD水平的升高,降低MDA的水平,来缓解氧化应激压力,促进机体健康。
表3 原花青素对肥胖大鼠氧化应激状态的影响(x ±s,n == 88)TTaabbllee 33 EEffffeecctt ooff ggrrape seed procyanidins on oxidative stress in obese

表3 原花青素对肥胖大鼠氧化应激状态的影响(x ±s,n == 88)TTaabbllee 33 EEffffeecctt ooff ggrrape seed procyanidins on oxidative stress in obese
组别 CAT活力/(U/mL) GSH-Px活力/(U/mL) MDA含量/(nmol/mL)SOD活力/(U/mL)正常组 6.37±2.40ab 748.24±55.21a 5.99±0.75AB,a 345.55±86.36c模型组 6.11±2.11b 730.89±103.99a 6.24±1.07A,a 356.11±57.98bc低剂量组 7.39±1.57ab 752.67±84.30a 4.03±0.66BC,b 390.39±116.18abc中剂量组 8.71±2.60a 770.42±128.97a 3.88±1.20C,b 464.13±111.02ab高剂量组 6.87±1.52ab 671.59±95.80a 4.07±2.38BC,b 477.47±113.37a
2.3 原花青素对肥胖大鼠炎症的影响
表4 原花青素对肥胖大鼠炎症因子、内毒素和肠道通透性的影响(x±s,n == 88)Table 4 Effect of grape seed procyanidins on inflammation factors, endotoxin and intestinal permeability in rats

表4 原花青素对肥胖大鼠炎症因子、内毒素和肠道通透性的影响(x±s,n == 88)Table 4 Effect of grape seed procyanidins on inflammation factors, endotoxin and intestinal permeability in rats
组别 IL-1含量/(ng/L) IL-6含量/(ng/L) TNF-α含量/(ng/L)肠毒素活力/(U/L)D-乳酸/(mmol/L)正常组 47.96±4.30A,a 25.48±2.27B,bc 43.92±2.99a 3.55±0.62a 1.47±0.06a模型组 43.30±4.35AB,ab 26.24±1.78B,bc 47.79±6.74a 3.79±0.75a 2.15±0.34b低剂量组 42.58±5.17AB,ab 25.13±2.54B,c 42.62±4.86a 3.68±0.35a 1.49±0.05a中剂量组 35.83±3.57B,c 29.78±4.17AB,ab 42.84±4.60a 3.52±0.27a 1.46±0.03a高剂量组 41.58±7.86AB,b 32.86±5.26A,a 46.51±8.73a 3.96±0.26a 1.47±0.03a
从表4可见,灌胃葡萄籽原花青素的剂量组大鼠血清中IL-1的含量略低,但只有中剂量组作用达到显著水平。中低剂量组原花青素可降低血清中TNF-α水平,但无显著性。内毒素水平没有发现显著性差异,但原花青素低、中剂量组平均值低于模型组。D-乳酸是肠道微生物发酵产生的一种糖,大鼠体内无法合成。大鼠血清中的D-乳酸均为通过肠道壁进入,故D-乳酸的水平能反应肠道壁通透性[12-14]。模型组D-乳酸水平明显高于正常组,说明高脂饲料导致了肠道壁通透性异常,而通过摄入原花青素,能显著恢复肠道壁的通透性,达到 正常水平。
3 讨 论
肝-肠是机体防御内毒素的关键屏障,健康大鼠肠道少量的内毒素会经静脉进入肝脏,被肝脏内的枯否细胞清除[15-16]。高脂饮食诱导的大鼠肥胖模型,体脂和血脂均升高,还会100%患上非酒精性脂肪性肝病,清除内毒素功能受损。因此高脂饮食诱导的肥胖大鼠,肠道菌群结构失调,内毒素水平较高,细胞毒作用增加,内毒素通过特异受体或非特异膜结合方式作用于枯否细胞膜激发炎症因子如TNF-α、IL-1、IL–6、INF-γ等。已有研究表明,超重和肥胖者血清中IL-6水平会有一定的增高[17],长期处于慢性炎症会导致机体处于氧化应激状态,产生大量自由基,导致机体功能逐渐受到损害,发生慢性代谢疾病[18-19]。
本研究发现原花青素具有极显著的降低体质量、体脂及肝脏湿质量异常增加的作用,对血脂相关指标的分析表明,其可显著降低TG、TC,但对HDL-C、LDL-C水平并无显著影响,这与闫少芳等[17]研究一致。
本研究发现,原花青素可以显著恢复因高脂膳食而被破坏的异常高的肠道壁通透性。异常高的通透性会导致肠道内大量有毒物质经过静脉进入肝脏,加重肝脏解毒负担。本次实验中,内毒素水平各组之间有差异,但并不显著,推测可能与内毒素检测方法有关,需改进测定方法。
同样,本研究发现原花青素对IL-1、IL-6及TNF-α的影响亦不显著,但是对抗氧化相关的酶(除了GSH-Px)、MDA水平的影响较为显著,说明原花青素作用位点不在上游的炎症因子产生的相关通路上,而在炎症因子诱导机体氧化应激的相关通路上,也可能和评价的指标有关[20]。原花青素对GSH-Px基本无影响,这与Puiggros等[21]的研究一致。Puiggros等[21]利用肝癌细胞系HepG2探讨了葡萄籽原花青素对抗氧化酶系统的影响,发现葡萄籽原花青素很可能并不调节GSH-Px或谷胱甘肽还原酶的水平,而是直接调节谷胱甘肽的合成。原花青素对MDA的清除尤为显著,这种清除是一种生化过程,还是纯粹的化学清除,有待于进一步研究。
本研究未发现原花青素与其生理效应间存在依赖关系。在原花青素对血清TC、TG、HDL-C、LDL-C影响方面,低剂量组表现最佳;对氧化应激指标的影响方面,各剂量组表现不一;对D-乳酸影响方面,3个剂量组表现无显著区别。生物体内,药物与其生理效应只是在一定浓度范围内存在近似线性的剂量依赖关系。本实验设计的不同灌胃组别间原花青素给药浓度范围较宽,故不一定能反映剂量效应关系;缩小这个浓度范围,或可进一步研究原花青素的剂量效应关系。
[1] 周素娟. 葡萄籽提取物原花青素的研究概况及其在我国保健食品中的应用[J]. 中国食品卫生杂志, 2007, 19(3): 284-286.
[2] YAMAKOSHI J, SAITO M, KATAOKA S, et al. Safety evaluation of proanthocyanidin rich extract from grape seeds[J]. Food Chem Toxicol, 2002, 40(5): 599-607.
[3] PINENT M, BLADE C, SALVADO M J, et al. Procyanidin effects on adipocyte-related pathologies[J]. Crit Rev Food Sci Nutr, 2006, 46: 543-550.
[4] DECORDE K, TEISSEDRE P L, SUTRA T, et al. Chardonnay grape seed procyanidin extract supplementation prevents highfat diet-induced obesity in hamsters by improving adipokine imbalance and oxidative stress markers[J]. Mol Nutr Food Res, 2009, 53: 659-666.
[5] 何青芳, 俞敏, 陈雅萍, 等. 超重肥胖与血压、血糖和血脂关系分析[J]. 中国农村卫生事业管理, 2010, 30(9): 773-775.
[6] KIMBERLY A G, JOSHUA D L. Laboratory, epidemiological, and human intervention studies show that tea (Camellia sinensis) may be useful in the prevention of obesity[J]. J Nutr, 2010, 140: 3446-3453.
[7] HEILBRONN L K, CAMPBELL L V. Adipose tissue macrophages, low grade inflammation and insulin resistance in human obesity[J]. Curr Pharm Des, 2008, 14(12): 1225-1230.
[8] CANI P D, BIBILONI R, KNAUF C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat dietinduced obesity and dabetes in mice[J]. Diabetes, 2008, 57: 1470-1481.
[9] 朱亭, 谢宇, 刘娟, 等. BVT273对肥胖小鼠胰岛素抵抗及炎症指标的影响[J]. 南京医科大学学报, 2008, 28(8): 968-972.
[10] ZEMEl M B. Role of calcium and dairy products in energy partitioning and weight management[J]. Am J Clin Nutr, 2004, 79(5): 907-912.
[11] HEANEY R P, DAVIES K M, BARGER LUX M J. Calcium and weight : clinical studies[J]. J Am Coll Nutr, 2002, 21(2): 152-155.
[12] JOHNSTON S D, SMYE M, WATSON R P. Intestinal permeability testsin coeliac disease[J]. Clin Lab, 2001, 47(3/4): 143-150.
[13] 孙晓庆, 付小兵, 张蓉, 等. 创伤后肠道通透性改变血浆标志物D-乳酸的实验研究仁[J]. 中国危重病急救医学, 2000, 12(8): 476-478.
[14] MURRAY M J, BARBOSE J J, COBB C F. Serum D (-)-lactate levels as a predictor of acute intestinal schemia in a rat model[J]. Journal of Surgical Research, 1993, 54(5): 507-509.
[15] 杨林辉, 蔡俊, 陈东风. 非酒精性脂肪型肝炎患者肠道菌群的变化及意义[J]. 临床肝胆病杂志, 2012, 28(2): 124-126.
[16] 伍烽, 金先庆. 肠-肝屏障在肠道细菌和内毒素移位中的作用[J]. 中华小儿外科杂志, 1997, 18(3): 188-190.
[17] 闫少芳, 李勇, 吴娟, 等. 葡萄籽提取物原花青素调节血脂作用及机理研究[J]. 中国食品卫生杂志, 2003, 15(4): 302-304.
[18] THORAND B, LOWEL H, SCHNEIDER A, et al. C-reactive protein as a predictor for incident diabetes mellitus among middle-aged men: results from the MONICA Augsburg cohort study, 1984—1998[J]. Arch Intern Med, 2003, 163(1): 93-99.
[19] CHANBERS J C, EDA S, BASSETT P, et al. C-reactive protein, insulin resistance, central obesi ty, and coronary heart disease risk in Indian Asians from the United Kingdom compared with European whites[J]. Circulation, 2001, 104(2): 145-150.
[20] 张迪, 籍保平, 周峰, 等. 食品体外抗氧化能力评价方法探讨[J]. 北京工商大学学报: 自然科学版, 2012, 30(1): 20-25.
[21] PUIGGROS F, FLOPIZ N, ARDEROL A, et al. Grape seed procyanidins prevent oxidative injury by modulating the expression of antioxidant enzyme systems[J]. J Agric Food Chem, 2005, 53(1): 60-80.
Effect of Grape Seed Procyanidins on Oxidative Stress in Diet-Induced Obese Rats
XIAO Jun-song1, WANG Ying1, SONG Xue-lin1, WU Hua2, SHAN Jing-min1, CAO Yan-ping1,*
(1. Beijing Key Laboratory of Flavor Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Technology and Business University, Beijing 100048, China; 2. College of Life Sciences, Jianghan University, Wuhan 430058, China)
Nutritional obesity model was induced by feeding Wistar rats with a high-fat diet. The model rats were treated with different dose of grape seed procyanidins by gavage for 4 weeks. The effect of grape seed procyanidins on obesity, oxidative stress and inflammation was investigated in these model rats. The results showed that grape seed procyanidins significantly decreased body weight, perinephrit fat weight and liver weight. Grape seed procyanidins could also decrease the levels of triglyceride and total cholesterol in serum, but no effect on high-density lipoprotein or low-density lipoprotein was observed. It also exhibited a decrease of malonaldehyde level in rat serum and an increase in the levels of superoxidase and catalase, but no effect on glutathione peroxidase was observed. The effect of grape seed procyanidins on the levels of TNF-α, IL-1, IL-6 and endotoxin was not significant. Grape seed procyanidins could significantly restore the abnormally high intestinal permeability caused by high-fat diet.
grape seed procyanidins; obesity; oxidative stress; inflammation factors
TS201.4
A
1002-6630(2014)03-0183-04
10.7506/spkx1002-6630-201403037
2013-08-11
国家自然科学基金项目(31201323);北京市自然科学基金项目(6123033);“十二五”国家科技支撑计划项目(2011BAD23B02)
肖俊松(1980—),男,副教授,博士,研究方向为功能食品和肠道菌群。E-mail:xiaojs@th.btbu.edu.cn
*通信作者:曹雁平(1961—),男,教授,博士,研究方向为超声化学与天然产物化学。E-mail:caoyp@th.btbu.edu.cn

