响应面法优化载儿茶素叶酸偶联壳聚糖纳米粒的制备工艺
刘步云,王永丽,于奇建,刘 芳,臧金红,金铃和,李大鹏,李 锋,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.南京农业大学食品科技学院,江苏 南京 210095)
儿茶素属黄烷醇类化合物,是茶叶中主要的活性成分之一,约占茶多酚总量的60%~80%。研究表明儿茶素具有很强的抗氧化活性[1],以及防癌抗癌、抗突变、广谱抑菌、免疫调节和保护心血管等多种功效[2-3],因此,在食品、医药和精细化工等领域具有重要的应用价值。但是,儿茶素在生理水相环境中极不稳定,易聚合或异构化;其含有的多个酚羟基与水分子之间也易形成氢键,从而导致儿茶素脂溶性差,大大降低了其在体内的吸收和利用率[4]。而且,儿茶素进入人体后半衰期很短,90%以上的儿茶素在体内发生代谢转化或由粪便或尿液排出,显著降低了其生物学功能[5]。
近年来,纳米粒子已经成为营养素及药物新剂型研究中非常活跃的领域。基于不同方法制备的纳米载体具有良好的生物相容性、缓释性及靶向性,能够有效提高营养素及药物的稳定性和生物利用率。在食品领域,纳米载体已用作维生素、矿物质、多肽、蛋白质等营养物的新型输送载体[6]。同时,应用纳米粒递送5-氟尿嘧啶[7]、紫杉醇[8]、阿霉素[9]等抗肿瘤药物的研究也有报道。叶酸受体在多数人体肿瘤细胞表面过度表达,而在正常细胞中很少或不表达,通过对药物载体进行叶酸偶联,可以增强药物与肿瘤细胞的靶向性结合,减少药物对正常细胞的毒副作用,从而提高药物的选择性和利用率[10]。
目前,关于通过叶酸修饰的纳米载体对儿茶素进行靶向输送的研究尚未见报道。本研究拟通过化学反应制备叶酸偶联壳聚糖,然后以儿茶素为载药,利用分子自组装原理制备载儿茶素叶酸偶联壳聚糖纳米粒,通过响应面法研究影响儿茶素包封率的因素并进行工艺优化,研究结果将为新型儿茶素输送载体的研究开发提供理论依据。
1 材料与方法
1.1 材料与试剂
叶酸(≥99%)、儿茶素(≥98%) 美国Sigma公司;壳聚糖(脱乙酰度≥95%,食品级)、三聚磷酸钠(sodium tripolyphosphate,TPP)、无水二甲基亚砜、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、丙酮、氢氧化钠、醋酸等均为分析纯 上海阿拉丁试剂公司。
透析袋(截留分子质量3 500 D) 北京索莱宝科技有限公司。
1.2 仪器与设备
FA1004电子天平 上海舜宇恒平科学仪器有限公司;78-1磁力加热搅拌器 常州智博瑞仪器制造有限公司;TGL-18高速台式离心机 上海安亭科学仪器厂;754N紫外分光光度计 上海奥谱勒仪器有限公司;PHS-3E pH计 上海精密科学仪器有限公司;VERTEX70傅里叶红外光谱仪 德国布鲁克公司;FreeZone2.5冷冻干燥机 美国Labconco公司。
1.3 方法
1.3.1 叶酸偶联壳聚糖(folate chitosan conjugates,FA-CS)的制备[11]
称取2.648 4 g叶酸和2.683 8 g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,溶于100 mL无水二甲基亚砜,室温下避光磁力搅拌至叶酸全部溶解。称取2.648 4 g壳聚糖,溶于pH 4.7的0.2 mol/L醋酸-醋酸钠缓冲溶液,充分搅拌,配制得到质量分数为0.5%的壳聚糖溶液。将上述叶酸混合溶液逐滴加入壳聚糖溶液中,并持续搅拌16 h。待反应结束后,加入1 mol/L的氢氧化钠调节溶液的pH值至9.0。然后依次用PBS(pH 7.4)、蒸馏水透析3 d,冷冻干燥得到淡黄色的FA-CS粉末。
1.3.2 叶酸偶联比的计算[12]
1.3.2.1 叶酸标准曲线的绘制
准确称取6.3 mg叶酸,用醋酸-醋酸钠缓冲液(pH 5.8)溶解,并定容至50 mL。精确量取0.5、1.0、1.5、2.0、2.5、3.0 mL上述叶酸溶液,分别置于10 mL容量瓶中,用醋酸-醋酸钠缓冲液定容至刻度,各管中叶酸的质量浓度分别为0.006 3、0.012 6、0.018 9、0.025 2、0.031 5、0.037 8 mg/mL。以醋酸-醋酸钠缓冲液为对照溶液,用紫外分光光度计在358 nm波长处测定吸光度,以吸光度A为纵坐标,叶酸的质量浓度C为横坐标,制作标准曲线并得其回归方程为:A=0.010 3C+0.017 9(R2=0.996 3)。
1.3.2.2 偶联比的计算
称取一定质量冻干后的FA-CS,溶解于醋酸-醋酸钠缓冲液(pH 5.8),并转移至10 mL容量瓶中,定容至刻度,于358 nm波长处测定其吸光度,空白溶液同上法制备。按如下公式计算每毫克FA-CS中叶酸的含量,即为偶联比。

式中:mFA为根据标准曲线计算出的叶酸质量/mg;mFA-CS为称取的FA-CS的质量/mg。
1.3.3 载儿茶素叶酸偶联壳聚糖(Catechin-FA-CS)纳米粒的制备
参照Wan等[13]方法并稍作修改。称取一定质量的FA-CS溶解于2%醋酸溶液中配制成1.0 mg/mL的FA-CS溶液。称取6.4 mg的儿茶素,溶解于16 mL上述FA-CS溶液中。然后用质量分数为1%的氢氧化钠调节pH值至5.0,搅拌条件下将2 mL 2.0 mg/mL的TPP溶液以3 s每滴的速度滴入上述FA-CS溶液中,并持续搅拌30 min,即得Catechin-FA-CS纳米粒悬浮液。将混悬液于16 000 r/min离心30 min,收集沉淀物,冷冻干燥、-20℃保存。
1.3.4 儿茶素包封率的测定
1.3.4.1 儿茶素标准曲线的绘制
采用香草醛-盐酸比色法[14]测定儿茶素含量。准确称取儿茶素标准品5.0 mg,用蒸馏水溶解,转移至50 mL棕色容量瓶中并定容至刻度,配制0.1 mg/mL的贮备液。精确量取0.2、0.4、0.6、0.8、1.0、1.2、1.5 mL的贮备液至10 mL的棕色容量瓶中,分别加1 mL水,用质量分数为1%的香草醛-盐酸溶液定容至刻度,摇匀静置30 min,作为待测液。空白溶液同上法制备。在503 nm波长处分别测定其吸光度,得到儿茶素吸光度-质量浓度标准曲线方程为:A=0.085 5C+0.081 9(R2=0.996 1)。
1.3.4.2 儿茶素包封率的计算
将Catechin-FA-CS纳米粒悬浮液于16 000 r/min转速离心30 min后,收集上清液。按照上述的香草醛-盐酸比色法操作步骤,于503 nm波长处测定其吸光度。按如下公式计算儿茶素包封率:
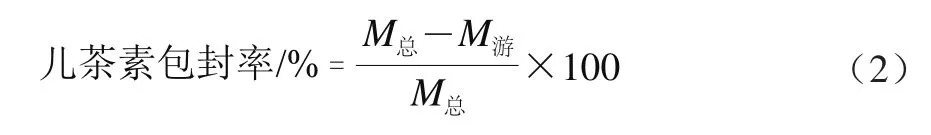
式中:M总为儿茶素的初始质量/mg;M游为根据标准曲线计算的上清液中儿茶素质量/mg。
1.3.5 红外光谱分析[15]
将儿茶素、CS、FA-CS和Catechin-FA-CS纳米粒冻干粉末,使用溴化钾压片法压片,在红外光谱分析仪中进行红外光谱测试。
1.3.6 透射电镜观察粒子形态[16]
取一滴悬浮液,用质量分数2%的磷钨酸染色剂染色2~3 min,然后置于铺有碳支持膜的铜网上,用滤纸吸去多余染液,自然干燥后,置于Hitachi-7650透射电镜下观察,设定加速电压为80 kV。
1.4 试验设计
1.4.1 单因素试验
称取6.4 mg的儿茶素,设定儿茶素与FA-CS质量比为2∶5,FA-CS与TPP质量比为4∶1,反应pH 5.0,搅拌时间30 min,固定其他条件分别考察儿茶素与FA-CS质量比(1∶5、2∶5、3∶5、4∶5、5∶5)、FA-CS与TPP质量比(2∶1、3∶1、4∶1、5∶1、6∶1)、反应pH值(3.0、4.0、5.0、6.0、7.0)和搅拌时间(10、20、30、40、50 min)对儿茶素包封率的影响。
1.4.2 响应面试验设计
根据单因素试验结果确定因素水平范围,根据Box-Behnken设计原理,以儿茶素包封率为响应值,利用Design-Expert 8.0软件在四因素三水平上对儿茶素/FA-CS质量比、FA-CS/TPP质量比、反应pH值和搅拌时间进行优化。
2 结果与分析
2.1 FA-CS的制备及结构验证
2.1.1 叶酸偶联比的计算
经测定叶酸偶联比为0.258,根据其分子质量计算可知每个FA-CS分子上大约偶联了30个叶酸分子。根据文献报道,在叶酸-蛋白质偶联物上平均一个蛋白质分子上偶联3个叶酸分子已有较强的靶向性[17]。
2.1.2 FA-CS的红外光谱分析
如图1所示,叶酸的红外吸收峰主要在3 419.4、1 694.5、1 604.5、1 485.0 cm-1处,分别对应叶酸中N—H、C=O、蝶啶环上的氨基、C=C或C=N的振动吸收峰。壳聚糖主要在3 358.3、1 593.4 cm-1和1 069.2 cm-1处,分别对应—NH2和6位—OH共同作用的振动吸收峰、伯胺的N—H面内变形振动吸收和醚键C—O—C伸缩振动吸收。与壳聚糖相比,FA-CS最明显的变化是在1 604.3 cm-1处出现酰胺键的强吸收峰,1 512.2 cm-1处出现了仲胺N—H键的弯曲振动吸收,这表明叶酸中的羧基与壳聚糖的氨基发生反应,生成了酰胺键[18],叶酸已成功偶联于壳聚糖上。

图1 叶酸、壳聚糖和叶酸偶联壳聚糖的傅里叶变换红外光谱图Fig.1 FTIR spectra of folic acid, chitosan and FA-CS
2.2 单因素试验
2.2.1 FA-CS/TPP质量比对儿茶素包封率的影响

图2 FA-CS/TPP质量比对儿茶素包封率的影响Fig.2 Effect of FA-CS/TPP mass ratio on encapsulation efficiency of catechin
由图2可知,随着FA-CS/TPP质量比增大,儿茶素的包封率逐渐增大,当FA-CS/TPP质量比是4∶1时,包封率达到最大值,然后呈现逐渐下降趋势。这可能是因为纳米颗粒的形成是基于壳聚糖链中带正电的氨基与TPP中多聚阴离子之间的离子凝胶化作用[19]。当TPP浓度过高时,两者之间的离子作用太强,不利于纳米颗粒的形成和分散;而当TPP浓度过低时,多聚阴离子的量又不足以与壳聚糖中氨基发生离子凝胶化作用形成纳米颗粒。故选择FA-CS/TPP的质量比为4∶1。
2.2.2 儿茶素/FA-CS质量比对儿茶素包封率的影响
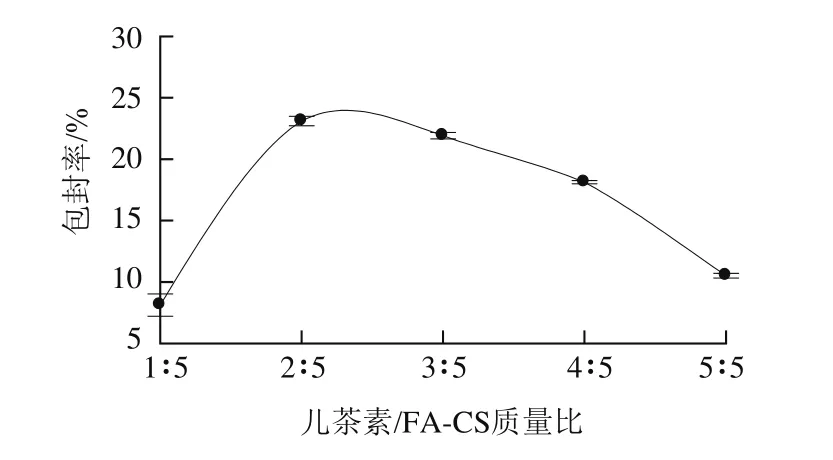
图3 儿茶素/FA-CS质量比对儿茶素包封率的影响Fig.3 Effect of catechin/FA-CS mass ratio on encapsulation efficiency of catechin
由图3可知,在儿茶素/FA-CS质量比为1∶5时,儿茶素包封率较低;随着儿茶素/FA-CS质量比增大,儿茶素包封率迅速上升后又缓慢下降。当儿茶素/FA-CS质量比是2∶5时,包封率达到最大值23.11%。原因可能是在儿茶素质量浓度很低的情况下,儿茶素在壳聚糖离子凝胶形成纳米粒时,由于体积排阻作用被排斥到颗粒以外,导致包封率较低。但投药量较高时,由于纳米粒的载药能力有限,继续增加投药量会使儿茶素包封率减小[20]。故选择儿茶素/FA-CS的质量比为2∶5。

图4 pH值对儿茶素包封率的影响Fig.4 Effect of pH on encapsulation efficiency of catechin
2.2.3 pH值对儿茶素包封率的影响由图4可知,pH值在3.0~7.0范围内,儿茶素包封率随着pH值升高先升高后下降,当pH值为5.0时达到最大值;随着pH值的进一步升高,包封率逐渐下降。原因可能是在pH值较低时,会减少TPP多聚阴离子,降低纳米粒的交联程度,导致儿茶素包封率较低;但pH值过高时,会极大地影响FA-CS中氨基的离子化程度,降低FA-CS正电荷数目,同样会致使儿茶素包封率较低[21]。故选择FA-CS溶液的pH值为5.0。
2.2.4 搅拌时间对儿茶素包封率的影响

图5 搅拌时间对儿茶素包封率的影响Fig.5 Effect of stirring time on encapsulation efficiency of catechin
由图5可知,搅拌时间在10~50 min范围内,儿茶素包封率先上升后下降,30 min时达到最高值;30~40 min时,包封率迅速下降;40~50 min时包封率下降较为平缓。这说明FA-CS与TPP的离子交联反应可能是一个较快的过程,在短时间内就能完成;随着搅拌时间的延长,已经包封的儿茶素有可能因搅拌作用而从纳米粒中分散出来[22],致使包封率下降。故选择搅拌时间为30 min。
2.3 响应面法优化Catechin-FA-CS制备工艺
2.3.1 响应面法分析因素水平的选取
在单因素试验的基础上,确定响应面试验的因素与水平如表1所示。

表1 响应面因素水平编码Table1 Independent variables and their levels used in response surface analysis
2.3.2 响应面试验设计及结果

表2 响应面试验设计及儿茶素包封率测定结果Table2 Experimental design and corresponding values for entrapment efficiency of catechin
采用四因素三水平的Box-Behnken响应面模型,试验设计及结果如表2所示。该试验共包括29个试验点,可分为两类:一类是析因点,自变量取值在各因素所构成的三维顶点,共包括24个试验点;其二是零点,为区域的中心点,零点试验重复5次,用以估计试验误差。
采用Design-Expert软件对试验数据进行多项式回归拟合,用以求出各影响因素的一次效应、二次效应及其交互效应的关联方程[23],对影响儿茶素包封率的因素进行更深入的研究和条件优化,并做出响应面图。多元回归拟合分析得到儿茶素包封率与各因素变量的二次方程模型为:Y=23.47+1.88X1-0.22X2+0.25X3+1.21X4+0.33X1X2+1.23X1X3-0.0075X1X4-0.71X2X3-0.06X2X4-0.17X3X4-3.74X12-1.70X22-1.98X32-2.52X4。
2.3.3 回归方程方差分析
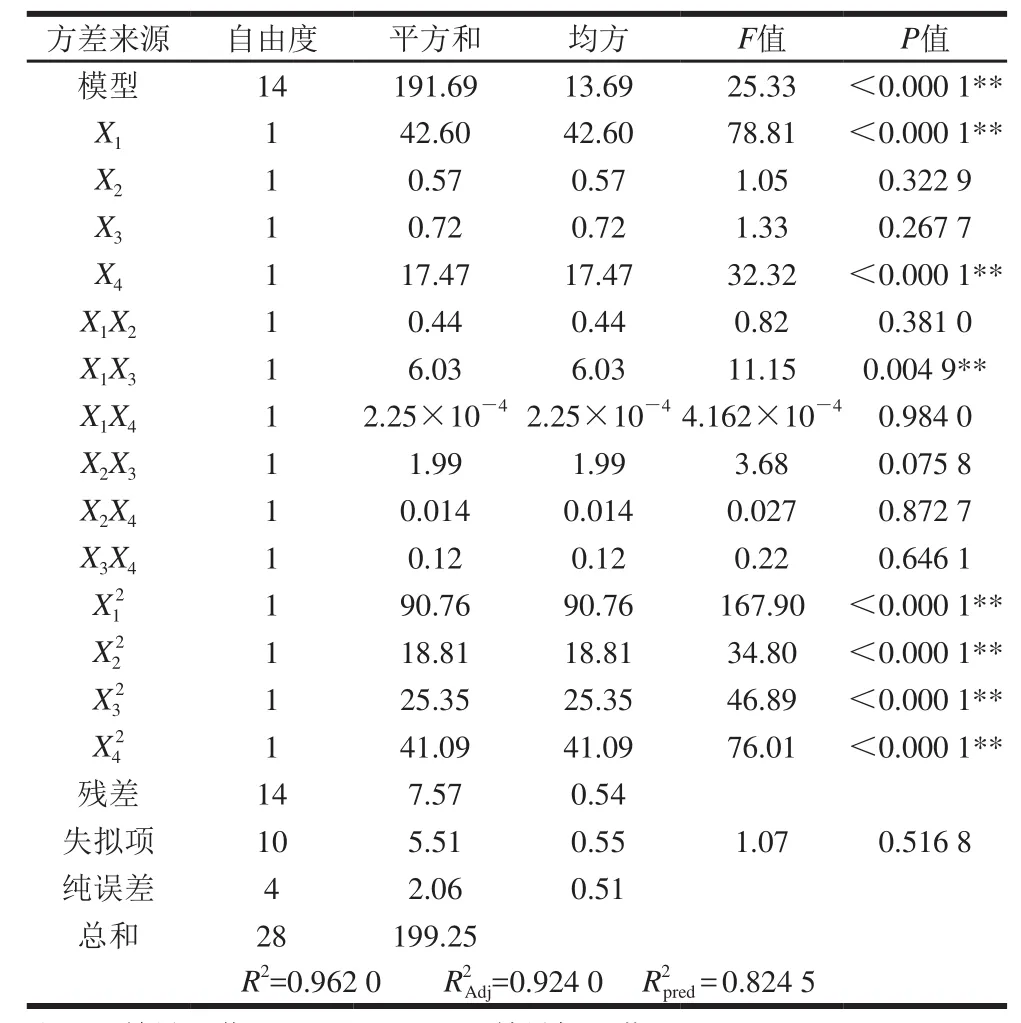
表3 回归模型方差分析表Table3 Analysis of variance for the developed regression equation
由表3方差分析结果可知,对儿茶素包封率建立的上述回归模型显著水平P<0.000 1,表明该Quadratic回归方程模型极显著。方程的失拟项不显著(P>0.05),表明回归方程对试验的拟合情况较好、误差小,能较好地描述响应值与各影响因素之间的关系。因变量与自变量之间的相关系数R2=0.962 0,模型调整决定系数R2=0.924 0,说明该模型能解释92.40%响应值的变化,Adj方程拟合度较高;模型的预测系数R2pred=0.824 5,表明考察值与模型预测值之间存在高度相关性。因此,可用该回归方程代替试验真实点对Catechin-FA-CS纳米粒的包封率进行分析和预测。对各因素回归系数进行显著性检验可知,一次项中儿茶素/FA-CS质量比(X1)、搅拌时间(X4)以及二次项中X12、X22、X32、X42对儿茶素包封率均有极显著的影响(P<0.01);交互项中儿茶素/FA-CS质量比和pH值的交互作用对儿茶素包封率影响极显著(P<0.01),其他交互项影响不显著。在所选的各因素水平范围内,各因素对儿茶素包封率的影响大小依次为:儿茶素/FA-CS质量比(X1)>搅拌时间(X4)>pH值(X3)>FA-CS/TPP质量比(X2)。
2.3.4 响应面分析
图6直观地给出了各因素交互作用对儿茶素包封率影响的响应面和等高线图。从响应面的最高点和等值线可以看出,在每个因素选取的范围内,存在响应值的极值,极值出现在响应面的最高处或者等值线最小椭圆的中心点[24]。
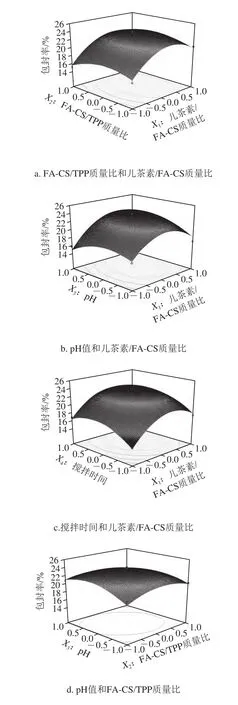
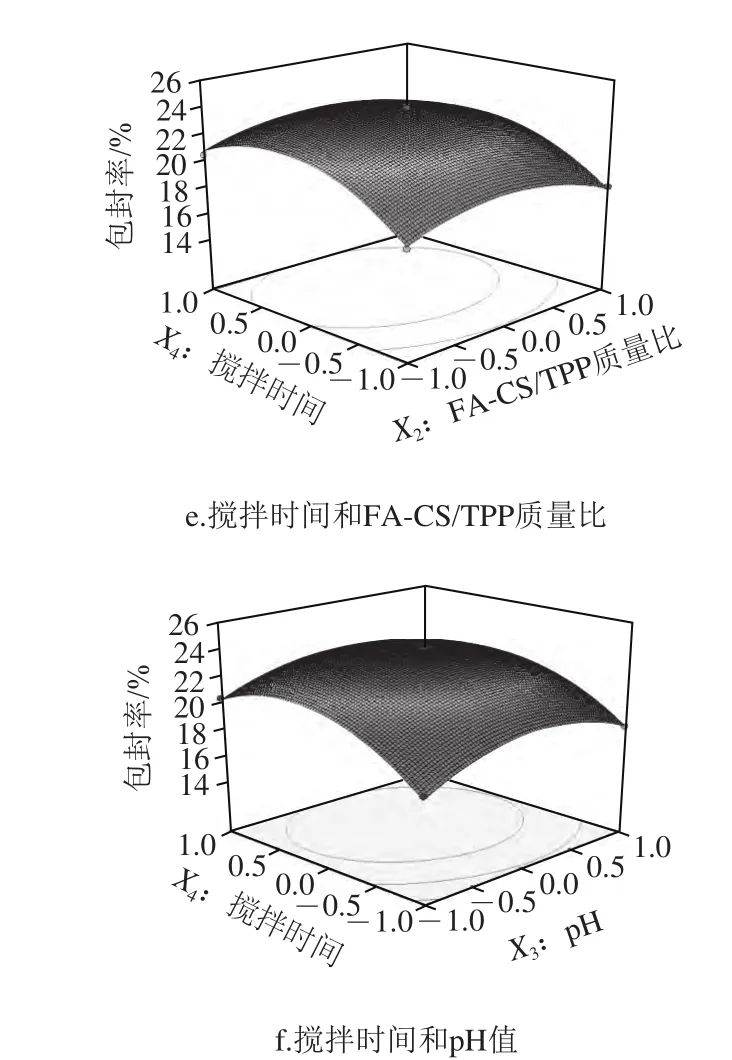
图6 各因素交互作用对儿茶素包封率的响应面和等高线图Fig.6 Response surface and contour plots for the interactive effects of four parameters on encapsulation efficiency of catechin
在固定其他因素的情况下,随着所考察因素值的升高,儿茶素的包封率均上升,在响应面的最高点(等高线的中心点)达到最大值后,包封率又呈现下降趋势。其中,儿茶素/FA-CS质量比(X1)对儿茶素的包封率影响最为显著,表现为沿该因素轴向响应面最为陡峭,等高线变化最密集,其次为搅拌时间(X4);而沿pH值(X3)和FA-CS/TPP质量比(X2)轴向的响应面较平滑,等高线变化较稀疏,表明两者对儿茶素包封率的影响较小。儿茶素/FA-CS质量比和pH值的交互作用对儿茶素包封率的影响显著,而其他交互项对儿茶素包封率的影响不显著。进一步由图6a可知,在固定反应pH值为5.0,搅拌时间为30 min时,儿茶素/FA-CS质量比对儿茶素包封率的影响比FA-CS/TPP质量比影响大,表现为沿X1轴方向响应面更为陡峭,等高线密集;同样,对于儿茶素包封率的影响,儿茶素/FA-CS质量比>pH值(图6b),儿茶素/FA-CS质量比>搅拌时间(图6c),pH值>FA-CS/TPP质量比(图6d),搅拌时间>FA-CS/TPP质量比(图6e),搅拌时间>pH值(图6f)。
2.3.5 验证实验
通过回归模型预测的最优制备工艺为:儿茶素/FA-CS质量比9∶20、FA-CS/TPP质量比3.93∶1、pH 5.15、搅拌时间32.35 min。儿茶素理论包封率为23.90%,在此条件下进行3次平行实验,Catechin-FA-CS纳米粒中儿茶素的平均包封率为23.45%,实际值与理论预测值基本接近,且重复性良好,说明该数学模型能很好地预测各因素同包封率之间的关系。
2.4 Catechin-FA-CS纳米粒的红外光谱分析

图7 Catechin-FA-CS纳米粒及儿茶素的傅里叶变换红外光谱图Fig.7 FTIR spectra of Catechin-FA-CS and catechin
由图7可知,与FA-CS的红外吸收峰(图1)相比,FA-CS纳米粒1 604.3 cm-1处的氨基面内变形振动吸收偏移至1 606.9 cm-1处,并在1 537.4 cm-1处产生了新的吸收峰,这表明FA-CS的氨基与TPP阴离子发生了交联[25]。儿茶素3 316.1 cm-1和1 608.1 cm-1处为O—H和C=C键的伸缩振动,在FA-CS纳米粒中相应峰有一定增强。3 250 cm-1处的振动吸收峰变宽可能是由于交联作用,分子内和分子间氢键作用增强而导致的宽化,这些结果表明儿茶素已包埋至FA-CS纳米粒中。
2.5 Catechin-FA-CS纳米粒的透射电镜分析
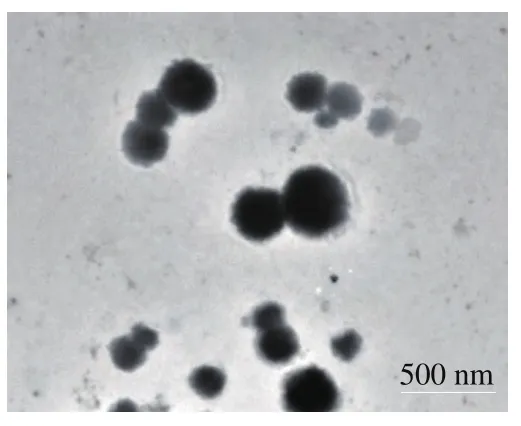
图8 Catechin-FA-CS纳米粒的透射电镜图Fig.8 Transmission electron micrograph of Catechin-FA-CS particles
为进一步验证儿茶素在FA-CS颗粒中的包埋情况,科研人员将Catechin-FA-CS纳米粒置于透射电子显微镜下进行观察,结果见图8。采用分子自组装原理制备的Catechin-FA-CS纳米粒形态均匀,外形较圆整,接近于规则的球形,基本无团聚现象,颗粒之间稍有黏连可能是由于制样分散不均造成。同时,电镜结果也表明Catechin-FA-CS纳米粒的粒径分布在200~500 nm范围内。
3 结 论
采用分子自组装原理制备载儿茶素叶酸偶联壳聚糖纳米粒,通过单因素试验和响应面试验,以儿茶素包封率为考察指标,进行工艺优化,得到的最佳制备工艺条件为:儿茶素/FA-CS质量比9∶20、FA-CS/TPP质量比3.93∶1、pH 5.15、搅拌时间32.35 min。在此条件下,儿茶素包封率为23.45%,与理论值23.90%接近。红外光谱分析证实儿茶素已包埋进纳米粒中,透射电镜分析表明所制粒子大小较均匀,接近于规则球形,分布在200~500 nm范围内。利用响应面法优化载儿茶素叶酸偶联壳聚糖纳米粒的制备工艺是可行的。
[1]KIDD P M.Bioavailability and activity of phytosome complexes from botanical polyphenols: the silymarin, curcumin, green tea, and grape seed extracts[J].Alternative Medicine Review, 2009, 14(3): 226-246.
[2]杨宇清, 魏伟.儿茶素对环磷酰胺诱导小鼠迟发性超敏反应的影响[J].中国新药杂志, 2007, 16(23): 1940-1943.
[3]刘珊丽, 刘宗文, 卢沛琦, 等.儿茶素对大鼠脑缺血/再灌注损伤的保护作用及机制[J].中国药理学通报, 2010, 26(2): 255-257.
[4]LIPINSKI C A, LOMBARDO F, DOMINY B W, et al.Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings[J].Advanced Drug Delivery Reviews, 2012, 64: 4-17.
[5]SANG S, LAMBERT J D, YANG C S.Bioavailability and stability issues in understanding the cancer preventive effects of tea polyphenols[J].Journal of the Science of Food and Agriculture, 2006,86(14): 2256-2265.
[6]XIA Shuqin, XU Shiying.Ferrous sulfate liposomes: preparation,stability and application in fluid milk[J].Food Research International,2005, 38(3): 289-296.
[7]LAI Lingfeng, GUO Hongxia.Preparation of new 5-fluorouracilloaded zein nanoparticles for liver targeting[J].International Journal of Pharmaceutics, 2011, 404(1): 317-323.
[8]AKHLAGHI S P, SAREMI S, OSTAD S N, et al.Discriminated effects of thiolated chitosan-coated pMMA paclitaxel-loaded nanoparticles on different normal and cancer cell lines[J].Nanomedicine:Nanotechnology, Biology and Medicine, 2010, 6(5): 689-697.
[9]TAN Yulong, LIU Chenguang.Preparation and characterization of selfassemblied nanoparticles based on folic acid modified carboxymethyl chitosan[J].Journal of Materials Science: Materials in Medicine, 2011,22(5): 1213-1220.
[10]龚金兰, 汪森明, 胡喜钢, 等.肿瘤靶向性药物载体叶酸-壳聚糖微球的制备及特性研究[J].南方医科大学学报, 2008, 28(12): 2183-2186.
[11]LI Puwang, WANG Yichao, ZENG Fanbo, et al.Synthesis and characterization of folate conjugated chitosan and cellular uptake of its nanoparticles in HT-29 cells[J].Carbohydrate Research, 2011, 346(6):801-806.
[12]赵颖, 杨琰, 卢实, 等.不同连接比例叶酸偶联壳聚糖的制备[J].西安交通大学学报, 2010, 31(5): 385-387.
[13]WAN Ajun, SUN Yan, LI Huili.Characterization of folate-graftchitosan as a scaffold for nitric oxide release[J].International Journal of Biological Macromolecules, 2008, 43(5): 415-421.
[14]SUN B, RICARDO-DA-SILVA J M, SPRANGER M.Critical factors of vanillin assay for catechins and proanthocyanidins[J].Journal of Agricultural and Food Chemistry, 1998, 46(10): 4267–4274.
[15]金鑫, 张阳德, 王吉伟, 等.荧光标记的叶酸修饰壳聚糖纳米载体研制[J].中南大学学报, 2010, 41(1): 161-165.
[16]梁进.纳米茶多酚的制备及其抗肿瘤作用研究[D].南京: 南京农业大学, 2011.
[17]LU Y, LOW P S.Folate-mediated delivery of macromolecular anticancer therapeutic agents[J].Advanced Drug Delivery Reviews,2002, 54(5): 675-693.
[18]蒋挺大.甲壳素[M].北京: 化学工业出版社, 2004: 33-38.
[19]BARBARA K.Application of chitin- and chitosan-based materials for enzyme immobilizations: a review[J].Enzyme and Microbial Technology, 2004, 35(2): 126-139.
[20]JI Jingou, WU Danjun, LIU Li, et al.Preparation, evaluation, and in vitro release of folic acid conjugated O-carboxymethyl chitosan nanoparticles loaded with methotrexate[J].Journal of Applied Polymer Science, 2012, 125(S2): 208-215.
[21]JI Jingou, WU Danjun, LIU Li, et al.Preparation, characterization, and in vitro release of folic acid-conjugated chitosan nanoparticles loaded with methotrexate for targeted delivery[J].Polymer Bulletin, 2011,68(6): 1707-1720.
[22]麻成金, 吴竹青, 傅伟昌, 等.响应面法优化仿栗籽油超临界萃取工艺[J].食品科学, 2011, 31(18): 196-202.
[23]KALIL S J, MAUGERI F, RODRIGUES M I.Response surface analysis and simulation as a tool for bioprocess design and optimization[J].Process Biochemistry, 2000, 35(6): 539-550.
[24]高义霞, 景红艳, 姜祖君, 等.响应面分析法优化乳苣总黄酮提取工艺的研究[J].中药材, 2010, 33(4): 621-624.
[25]WU Yan, YANG Wuli, WANG Changchun, et al.Chitosan nanoparticles as a novel delivery system for ammonium glycyrrhizinate[J].International Journal of Pharmaceutics, 2005,295(1): 235-245.

