(L)乳酸手性衍生物的含氟二苯乙炔液晶的合成
王建新,赵 敏 ,闻建勋
(1.华东理工大学 化学与分子工程学院,上海 200237;2.上海天问化学有限公司,上海 200232)
1 前 言
液晶显示器的性能取决于液晶化合物的双折射率和介电各向异性。为人熟知的扭曲向列相模式 (TN),超扭曲向列相模式(STN),薄膜晶体管模式 (TFT)等都取决于液晶材料的双折射率和介电各向异性[1]。TFT-LCD已经成为当今平板显示技术的主流。
除了上述的技术之外,与胆甾型液晶材料有关的技术也是研究的热点。其中一个是反射式的显示技术。显示用胆甾相液晶材料是由宽温向列相液晶组合物和手性组合物配制而成[2],与其他液晶材料相比,胆甾相液晶材料的螺距较短,双折射率大,手性组分含量高[3]。反射式胆甾相液晶最突出的优点是具有零场记忆特性[4]。在零电场时,能长期保持显示内容,其能耗只有TFT-LCD的1/8左右。由于不需要偏振片和背光源,具有高反射能力和宽视角,能够实现类似纸般的阅读效果,特别适用于电子书籍阅读器、商业广告等领域。
第二个是与蓝相液晶有关胆甾型液晶。在1888年Reinizer已经观察到蓝色雾状态,直到20世纪70年代,英国的Gray才把各向同性与胆甾型之间的相态命名为蓝相[5]。由于蓝相温度区间非常窄,不过1 ℃左右,限制了它的应用研究。直到2002年日本的Kikuchi等人在蓝相温度扩宽做了突破后,研究工作才有了迅速进展[6]。由于蓝相的液晶显示具有许多优点,例如响应速度快,不要彩色滤光片,不需要视角补偿膜对厚度不敏感等,被称为最具有革命性的下一代液晶显示器[7]。20世纪80年代,Macus等人及 Finn等人分别研究了蓝相与螺距的关系,发现系统的螺距小于500 nm时,才出现蓝相,当化合物或者混合物的螺距短的场合温度范围宽[8-9]。1990年代,Navailles 等人报道了手性乳酸衍生物二苯乙炔的蓝相研究[10],陈锡敏等人[11-12]报道了手性含氟二苯乙炔的研究结果。
本研究的目的涉及以上两个领域,探讨手性含氟二苯乙炔的胆甾型的液晶性与手性端基的关系。本工作作者[13]曾经发表含氟蓝相液晶:1-[(4-烷氧基-2,3,5,6-四氟苯基)乙炔基]苯基,4-[(S)2-甲基丁基] 对苯二酯,现在将手性基团换为(L )乳酸乙酯,研究其合成方法及液晶性的变化。
2 合成路线
目标化合物:1-[(4-烷氧基-2,3,5,6-四氟苯基)乙炔基]苯基,4-[(1-乙氧基羰基)乙基]对苯二酯。其合成路线如下:
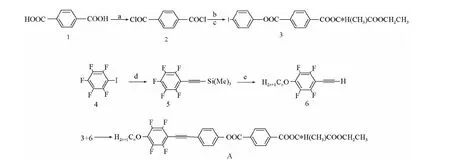
条件和试剂:(a)SOCl2,吡啶,rf10h;(b)对碘苯酚,DMAP,吡啶,二氧六环,rf;(c)乳酸乙酯,DMAP,吡啶,二氧六环,rf;(d)Pd(PPh3)2Cl2,CuI,Et3N,三甲基硅乙炔,40℃;(e)CnH2n+1OH,K2CO3,DMF,rt;(f)Pd(PPh3)2Cl2,CuI,Et3N,rf。
目标化合物合成方法:首先对苯二甲酸合成对苯二甲酰氯,对苯二甲酰氯在DMAP和吡啶催化下与对碘苯酚和手性乳酸乙酯反应得中间体3,将五氟碘苯和三甲基硅乙炔通过二氯二(三苯基膦)钯和碘化亚铜催化反应得到5,5在碱性(K2CO3)条件下和正烷醇在常温下亲核取代反应得到对烷氧基全氟苯乙炔6,中间体3和中间体6溶于三乙胺,在二氯二(三苯基膦)钯和碘化亚铜条件下,通过sonogashira偶合得到目标化合物A。
3 相变研究与讨论
本文用热台偏光显微镜及DSC 方法测定液晶的转变温度。
化合物A(n=6)DSC如图1。
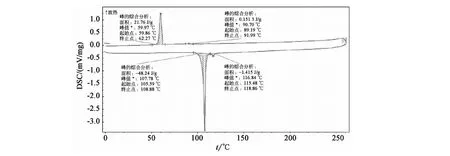
图1 化合物A(n=6)DSC图Fig.1 DSC of compound A(n=6)
化合物A的相转变温度结果见表1。
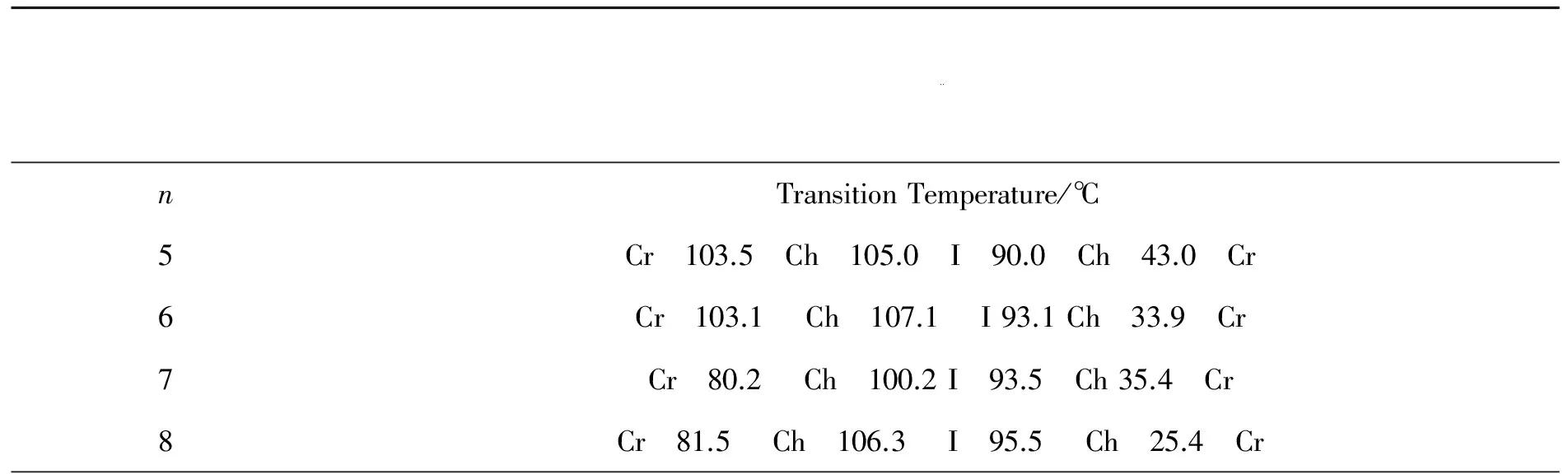
表1 化合物A的相转变温度
由上面的测试结果和数据可知,4个A类化合物都具有较高的清亮点,液晶的清亮点都具有奇偶效应,当尾部烷氧基链为偶数的化合物比尾部烷氧基链为奇数的化合物清亮点高。且烷氧基链越长,熔点和清亮点越低。由于端基的手性基团不同,液晶的相态与以前报道的B化合物不同[12-13],B化合物结构如下式所示:

(B)
含氟tolane结构中的氟取代基主要的作用是抑制近晶相的出现。由于氟原子范德华半径比较小,但是比氢原子稍大,能够增大液晶分子间的空间距离,使色散引力减小,抑制了近晶相的出现。这种有限的空间位阻效应对液晶的修饰有利。
对于在光子学技术领域中的液晶材料,需要低黏度和高双折射的液晶[14],即一般要求Δn>0.2,但是高双折射液晶的黏度很大,响应速度也会相应变慢。为了得到低黏度和高双折射的液晶材料,文献有许多报道[15-17]。闻建勋等人[18]利用全氟苯环将2,3,5,6-四氟亚苯基合成含氟二苯乙炔结构的单一向列型液晶。本工作将四氟亚苯基引入分子结构,四氟亚苯基是非极性结构,C—F化学键是最强的键,极化率低,分子间色散力作用小,不会因为氟原子大电负性而引起黏度增加,也不会出现有的文献中为了降低黏度引入环己基造成共轭系统破坏,以至于Δn减小的后果。四氟亚苯基不利于近晶相的发生。在以前的工作中,利用手性的2-甲基异丁醇得到清亮点135 ℃的单一胆甾相蓝相液晶[13].现在,利用同样的液晶核结构,将手性基团改用(L)乳酸乙酯,发现蓝相消失。虽然单一胆甾相依然存在,但是液晶性大大不如以前,如表1所示,不仅清亮点大大下降,而且升温时的胆甾相十分窄。这说明手性端基的结构对液晶相态结构影响深刻。从表1看到烷氧基的碳原子数为5及6时,升温时液晶区域很窄,只有2到3度,但是降温时的液晶相却相当宽。说明它们接近单变的液晶,应该是黏度非常低。另外一个有趣的现象,随着烷氧基的碳原子数目继续增加(n=7,8),升温及降温液晶温度区域都明显增加,说明分子间引力增加,并没有产生近晶相,这与液晶端基碳原子数8个时往往出现近晶相不同[19]。文献[19]与本文的化合物的区别仅是桥键—COO—的左右取向不同。
本文A类液晶化合物中引入了2,3,5,6-四氟苯乙炔结构,分子的侧位多氟取代使得分子的宽度增加,分子内的相互作用力减弱,会降低胆甾相液晶化合物的清亮点。但A类液晶化合物又以乙炔为链接桥键,由于π电子的相互作用,化合物分子的共轭性更强,分子的极化性增加。综上所述,A类化合物具有较高的清亮点和很宽的胆甾相温度区间。分子引入乙炔中心桥键,有利于增大分子的双折射和降低分子的黏度,响应速度变快。因此,化合物A的许多物理性能都满足自适应光学系统调制器的要求,如高双折射,低黏度,胆甾相(工作温度区域)宽等等,可以作为自适应光学系统调制器液晶材料。
4 实验部分
实验仪器:Bruker 400 (400 MHz) 型核磁共振仪测,G2577A型质谱仪,Nicolet Magna-I 550型红外光谱仪。XPV-203E型偏光显微镜,Dimand DSC型差示扫描量热仪。
4.1 中间体6(n=5)的合成
将2.00 g(7.56 mmol)的全氟苯基三甲基硅乙炔、2.00 g(14.44 mmol)的碳酸钾、2.60 g(28 mmol)的正戊醇和60 mL的DMF,依次加入100 mL的三口烧瓶中,在常温下磁力搅拌,反应72 h后停止反应(TLC跟踪)。加入50 mL水,用甲基叔丁基醚(50 mL×3)萃取,得有机相用无水硫酸钠干燥后,减压蒸除溶剂,用石油醚过柱,得黄色液体1.2 g,y:61.0%。
1H NMR (400 MHz,CDCl3):δ0.93 (t,J=8.0 Hz,3H),1.33~1.82(m,6H),3.54 (s,1H),4.27 (t,J=8.0 Hz,2H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28(m,2F),δ-138.01~137.93 (m,2F)
中间体6(n=6)
1H NMR (400 MHz,CDCl3):δ0.90 (t,J=8.0 Hz,3H),1.31~1.81(m,8.0H),3.53 (s,1H),4.26 (t,J=8.0 Hz,2H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28(m,2F),δ-138.01~137.93(m,2F)
中间体6(n=7)
1H NMR (400 MHz,CDCl3):δ0.78 (t,J=8.0 Hz,3H),1.20~1.71(m,10H),3.43 (s,1H),4.16 (t,J=8.0 Hz,2H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28 (m,2F),δ-138.01~137.93 (m,2F)
中间体6(n=8)
1H NMR (400 MHz,CDCl3):δ0.89 (t,J=8.0 Hz,3H),1.28~1.81(m,12H),3.53 (s,1H),4.26 (t,J=8.0 Hz,2H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28 (m,2F),δ-138.01~137.93 (m,2F)
4.2 中间体3的合成
在氮气保护下,将5 g对苯二甲酰氯加入到有溶剂二氧六环40 mL的100 mL三口烧瓶中,磁力搅拌使对苯二甲酰氯溶解。继续加入对碘苯酚3.6 g及0.1 g DMAP,再滴加几滴吡啶回流反应24 h。冷却后,在氮气保护下加乳酸乙酯2.9 g,然后加热回流24h,停止反应。依次用5%醋酸洗3次,饱和氯化钠溶液洗3次,二氯甲烷萃取3次,然后合并有机相,干燥,浓缩后过柱(石油醚∶乙酸乙酯∶二氯甲烷=30∶1∶0.5)得淡黄色固体2.3 g,y:30%。
MS (m/z,%):468.0 (M+,6.14),249.1 (100.00);
1H NMR (400 MHz,CDCl3):δ 1.29 (t,J=8.0 Hz,3H),1.66 (d,J=4.0 Hz,3H),4.24 (q,J=8.0 Hz,2H),5.34 (q,J=8.0 Hz,1H),6.98~8.25(m,8H)
4.3 目标化合物A(n=5)的合成
将560 mg(1.2 mmol)的化合物3,400 mg(1.5 mmol)的化合物6,50 mg的Pd(PPh3)2Cl2,60 mg的CuI和35 mL的三乙胺在氮气保护下加入50 mL的三口烧瓶中,磁力搅拌,在回流条件下反应,4.5 h后停止反应,冷却,抽滤,用甲基叔丁基醚洗固体,再用水(50 mL×3)洗得黄色有机相,用无水硫酸钠干燥,减压蒸除溶剂,用石油醚(bp 60~90 ℃)∶乙酸乙酯∶二氯甲烷=30∶1∶0.5为淋洗剂过柱,得白色固体,用甲醇重结晶,得0.51 g,产率y:70.8%。
MS (m/z,%):600.2 (M+,12.72),249.1 (100.00);
1H NMR (400 MHz,CDCl3):δ 0.94 (t,J=8.0 Hz,3H),1.30 (t,J=8.0 Hz,3H),1.67 (d,J=8.0 Hz,3H),1.36~1.83(m,6H),4.23~4.29(m,4H),5.36(q,J=8.0 Hz,1H),7.26~8.29 (m,8H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28 (m,2F),δ-138.01~137.93(m,2F)
IR(KBr,νmax,cm-1):3 451,2 958,2 933,2 868,2 220,1 735,1 651,1 598,1 580,1 513,1 493,1 441,1 408,1 392,1 346,1 310,1 263,1 244,1 204,1 167,1 120,1 076,1 015,986,869,835,787,720,531.
目标化合物A(n=6)
MS (m/z,%):614.2 (M+,12.99),249.1 (100.00);
1H NMR (400 MHz,CDCl3):δ 0.91 (t,J=8.0 Hz,3H),1.30 (t,J=8.0 Hz,3H),1.67 (d,J=8.0 Hz,3H),1.44~1.83 (m,8H),4.23~4.29(m,4H),5.36(q,J=8.0 Hz,1H),7.26~8.29 (m,8H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28(m,2F),δ-138.01~137.93(m,2F)
IR(KBr,νmax,cm-1):3 451,2 958,2 933,2 868,2 220,1 735,1 651,1 598,1 580,1 513,1 493,1 441,1 408,1 392,1 346,1 310,1 263,1 244,1 204,1 167,1 120,1 076,1 015,986,869,835,787,720,531.
目标化合物A(n=7)
MS (m/z,%):628.2 (M+,13.32),249.1 (100.00);
1H NMR (400 MHz,CDCl3):δ 0.90 (t,J=8.0 Hz,3H),1.30 (t,J=8.0Hz,3H),1.67 (d,J=8.0Hz,3H),1.33~1.83 (m,10H),4.23~4.29(m,4H),5.36 (q,J=8.0 Hz,1H),7.26~8.29 (m,8H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28(m,2F),δ-138.01~137.93(m,2F)
IR(KBr,νmax,cm-1):3 451,2 958,2 933,2 868,2 220,1 735,1 651,1 598,1 580,1 513,1 493,1 441,1 408,1 392,1 346,1 310,1 263,1 244,1 204,1 167,1 120,1 076,1 015,986,869,835,787,720,531。
目标化合物A(n=8)
MS (m/z,%):642.2 (M+,13.70),249.1 (100.00);
1H NMR (400 MHz,CDCl3):δ 0.89 (t,J=8.0 Hz,3H),1.30(t,J=8.0 Hz,3H),1.67(d,J=8.0 Hz,3H),1.33~1.82(m,12H),4.23~4.29(m,4H),5.36(q,J=8.0 Hz,1H),7.26~8.29(m,8H)
19F NMR (400 MHz,CDCl3):δ-157.35~157.28(m,2F),δ-138.01~137.93(m,2F)
IR(KBr,νmax,cm-1):3 451,2 958,2 933,2 868,2 220,1 735,1 651,1 598,1 580,1 513,1 493,1 441,1 408,1 392,1 346,1 310,1 263,1 244,1 204,1 167,1 120,1 076,1 015,986,869,835,787,720,531。
5 结 论
设计并合成了一类胆甾型液晶化合物,是互变的单一胆甾型液晶化合物。在降温过程中出现较高的清亮点及可以接受的液晶温度区域。由于自液晶核结构中接入2,3,5,6-四氟亚苯基,黏度低双折射较高,化学稳定,可以用于反射型液晶显示器及自适应光学系统。
本文采取与已经发表的工作对比的方法[13],讨论了分子结构中手性端基、2,3,5,6-四氟亚苯基以及桥键—COO—的连接方向之不同对液晶相态的影响。
[1] Hird M. Fluorinated liquid crystals-properties and applications [J].Chem.Soc.Rev,2007,36:2070-2095.
[2] Yang D K,Huang X Y,Zhu Y M. Bistable cholesteric reflective display:materials and drive schemes [J].Annu.Rev.Sci,1997,27:117-146.
[3] Yamaguchi T,Kawata Y. Driving voltage reflective Ch-LCD [J].JAppl.Phys.,1999,85 (11):7511-7516.
[4] Taheri B,West J L,Yang D K. Recent development in bistable Ch-LCD [J].SPIE,1998,3297:115-134.
[5] Coates D,Gray G W. Optical studies of the amorphous liquid-cholesteric liquid crystal transition:The “blue phase” [J].Phys.Lett.A,1973,45 :115-116.
[6] Kikuchi H,Yokota M,Hisakado Y,etal. Polymer-stabilized liquid crystal blue phases [J].Nat.Mater.,2002,1:64-68.
[7] Li Y,Jiao M,Wu S T. Transflective display using a polymer-stabilized blue-phase liquid crystal [J].Opt.Express,2002,18:16486-16491.
[8] Macus M,Goodby J W. Cholesteric Pitch and Blue Phases in a Chiral-Racemic Mixture [J].Mol.Cryst.Liq.Cryst.,1982,72:297.
[9] Finn P L,Cladis P E. Cholesteric blue phases in mixtures and in an electric field [J].Mol.Cryst.Liq.Cryst.,1982,84:159.
[10] Navailles L,Nguyen H T,Barois P.etal. Smectic A twist grain boundary phase in three new series with chiral (L) lactic acid derivatives [J].Liq.Cryst.,1993,15(4):479-495.
[11] Chen X M,Yin H Y,Xu Y L,etal. Synthesis and mesomorphic properties of novel tetrafluorinated biphenyl acetylene liquid crystals with a blue phase [J].Chin.J.Chem.,1998,16(3):277-283.
[12] 陈锡敏,闻建勋. 含氟二苯乙炔类蓝相液晶的研究进展 [J]. 液晶与显示,2013,28(1) :33-44.
Chen X M,Wen J X. Progress of fluorinated biphenyl acetylene blue-phase liquid crystals [J] .ChineseJournalofLiquidCrystalsandDisplays,2013,28(1):33-44.(in chinese)
[13] Yang Y G,Li H T,Wen J X. Synthesis and mesomorphic properties of chiral fluorinated liquid crystals [J].Liq.Cryst.,2007,34(8):975-979.
[14] 何军,张然,鲁兴海,等. 快速高双折射率向列相液晶的分子设计与模拟计算[J].液晶与显示,2009,24(1):1007-2780.
He J,Zhang R,Lu X H,etal. Molecular design and simulation of nematic liquid crystal of fast response and high brifringence [J].ChineseJournalofLiquidCrystalsandDisplays,2009,24(1):1007-2780.(in Chinese)
[15] Gauza S,Wang H,Wen C H,etal. High birefringence isothiocyanato tolane liquid crystals [J].Jpn.J.Appl.Phys.,2003,42:3463-3466.
[16] Gauza S,Wen C H,Wu S T,etal. Super high birefringence isothiocyanato biphenyl-bistolane liquid crystals [J].Jpn.J.Appl.Phys.,2004,43:7634-7638.
[17] Ziobro D,Kula P,Dziaduszek J,etal. Mesomorphic and dielectric properties of esters useful for formulation of nematic mixtures for dual frequency addressing system [J].Opto-Electron.,2009,17(1):16-19.
[18] 闻建勋,陈齐,郭志红,等. 含全氟苯环的液晶化合物及制备方法:中国,92108444.7 [P]. 1992.
Wen J X,Chen Q,Guo Z H,etal.The preparation method of liquid crystal compouds of containing perfluorinated benzene ring:China,92108444[P]. 1992. (in Chinese)
[19] Xu Y L,Wang W L,Chen,Q,etal. Synthesis and transition temperature of novel fluorinated chiral liquid crystals containing 1,4-tetrafluorophenylene units[J].Liq.Cryst.,1996,21(1) :65-71.

