分子动力学模拟研究纳米碳管中甲醇-水混合溶液的结构与输运性质
高文秀 王洪磊 李慎敏
(大连大学辽宁省生物有机化学重点实验室,辽宁大连116622)
1 引言
作为一种亲水性物质,甲醇可以与水以任意比例混溶,二者不易分离.传统上采用精馏技术1以实现醇与水的分离,然而该方法能耗较高.2新世纪以来,纳米碳管(CNT)作为新材料受到人们广泛的关注.2001年,Hummer等3通过计算模拟发现,(6,6)型单壁纳米碳管可以作为水的快速输运导体.2004年和2006年,Hinds4与Holt5等分别通过实验技术肯定了Hummer的预测.Holt指出,水在狭窄的纳米碳管簇中传递速率比商用的聚碳酸酯膜高几个数量级,受这些先驱性的工作启发,并得益于快速发展的计算机技术,目前有关纳米碳管中醇-水混合体系的静态结构与动态性质的模拟报道不断涌现,这些工作无疑为高效、低能耗的醇-水分离提供了理论基础.
利用分子动力学模拟方法,Liu等6发现具有疏水性甲基的甲醇分子更容易吸附在纳米碳管的管壁区域,而极性水分子更容易分布在远离管壁的轴线附近区域,导致在小尺寸纳米碳管内甲醇与水的空间分布的分离,即不混溶性.此外,管壁对甲醇的选择性吸附使得纳米碳管中甲醇的占有数远高于水的占有数,特别地,对于小管径的(6,6)纳米碳管,甲醇的占有率趋近于100%.7最近,Tian等8考察一些短碳链脂肪醇与水的混合溶液性质时,得到了类似的结论.他们把纳米碳管对醇的选择性吸附归因于醇分子与纳米碳管之间较强的色散力,并暗示有望利用纳米碳管内醇与水的不混溶性设计一种节能有效的醇-水分离方法.
然而,单纯依靠水-醇分子的自扩散难以实现醇-水在常温下的快速分离.借助外加驱动力,选择性地加速粒子的输运速度,以促进两者的分离,是必然的选择.目前,常用的外加驱动力的方法有外压法,9,10电场与电荷作用法,11-17表面张力法,18以及化学梯度19,20与热梯度法.21Zheng等22利用化学梯度方法实现了醇-水混合体系在纳米碳管中单向流动,考察了纳米碳管的亲水性对甲醇-水溶液输运性质的影响.他们发现,无论是疏水型纳米碳管还是亲水型纳米碳管,甲醇在纳米碳管中的流通量总是大于水的流通量.Goldsmith和Hinds23考察了不同外压下,不同管径中甲醇-水溶液的输运行为,与Zheng等22的结论一致,甲醇更倾向于沿着管壁流动;然而,与Zheng等结论明显不同的是,他们发现水的流通量远大于甲醇的,且随着管径的增大,水与甲醇的流通量之比随之增大.
显然,有关甲醇-水混合体系的输运性质的研究还有待进一步深入,到目前为止,通过外加驱动力,特别是外加电场作用下加速甲醇-水混合体系的动力学模拟研究还鲜见报道.在外压或梯度电场作用下,甲醇-水混合体系中水分子的快速输运行为24是否依然存在?电场极化后的纳米碳管能否依然保持对甲醇分子的倾向性吸附?为回答上述疑问,本文尝试利用分子动力学模拟方法,通过外压法与梯度电场法两种外力驱动,并结合无外力条件下平衡体系的情况,对比考察甲醇-水混合体系在纳米碳管中的静态结构以及动态输运性质.需要说明的是,最近的有关水在纳米碳管中的输运研究14,24表明,在均匀电场下,水呈现双向运动,净流通量很小;而在梯度电场下,水呈现单向运动,具有较大的净流通量.因此,本文采取梯度电场作为驱动力,研究甲醇-水混合体系的输运性质,为实现分子层次的甲醇-水快速分离奠定理论基础.
2 计算模型与模拟细节
模拟体系的初始构型及尺寸大小见图1(a)所示.首先,我们利用实验室自编程序构建了带有石墨烯挡板的单壁纳米碳管;然后通过蒙特卡洛能量优化方法构建了摩尔比为1:1,溶液的密度为0.8814 g∙cm-3的甲醇-水均匀混合溶液;25最后,利用TINKER程序中的xyzedit模块将带有石墨烯挡板的纳米碳管溶于甲醇-水混合溶液中,并去除石墨烯挡板间纳米碳管外多余的溶液分子.为考察管径尺寸变化对甲醇-水结构与输运性质的影响,我们选择了纳米碳管管长为4.428 nm,手性指标为(6,6)、(8,8)、(10,10)和(12,12)的四种扶手椅型纳米碳管作为研究对象.体系中石墨烯挡板、纳米碳管、甲醇及水分子等组成信息如表1所示.模拟中,甲醇及水分子均采用刚性模型,其中水为TIP3P模型,26甲醇的非键相互作用参数选用OPLS_UA力场参数,27纳米碳管与石墨烯挡板采用冻结模型.体系中各个粒子间的范德华相互作用由12-6 Lennard-Jones势描述,原子、联合原子的非键势能参数(ε,σ)及电荷见表2.不同粒子间范德华相互作用参数由Lorentz-Berthelot混合规则给出.
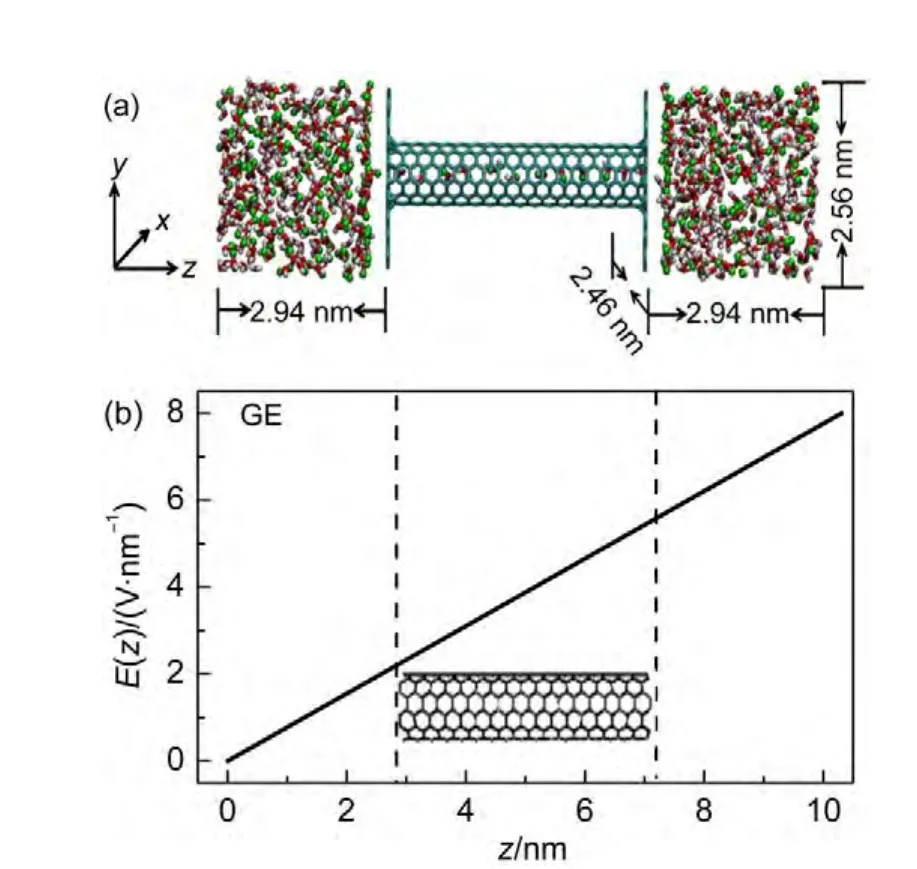
图1 (a)模拟体系的初始构型;(b)梯度电场强度与z轴位置相关图Fig.1 (a)Initial configuration of the simulation system;(b)dependence of gradient electric field strength with the z axis position
所有模拟均是在正则系综(NVT)下进行的,温度为298 K,模拟过程中使用三维周期性边界条件,轨迹积分由蛙跳算法数值计算,积分步长为1 fs.长程静电相互作用由Particle-Mesh-Ewald(PME)方法计算.模拟的预平衡时间为5 ns,为确保数据采集过程中得到较好的统计结果,数据采集时间为20 ns.需要指出的是,平衡条件与外压作用的模拟是在GROMACS(Groningen Machine for Chemical Simulations)软件包28下完成的,其中,温度控制采用Nose-Hoover方法,水与醇分子的键长限制采用线性限制算法(LINCS).为模拟外压作用,水与醇分子均被施以统一的沿z轴正方向的加速度,大小为0.1 nm∙ps-2;梯度电场作用的模拟是在NAMD(Nanoscale Molecular Dynamics)软件包29下完成的,其中,温度控制采用Langevin方法,水与醇分子的键长限制采用SHAKE算法.梯度电场的施加方法如图1(b)所示.这里,电场强度沿z轴的变化关系由公式E(z)=kz给出,常数其中,在体系的最左端zmin=0 nm处,电场强度Emin=0V∙nm-1,在体系的最右端zmax=10.308 nm处,电场强度Emax=8 V∙nm-1.
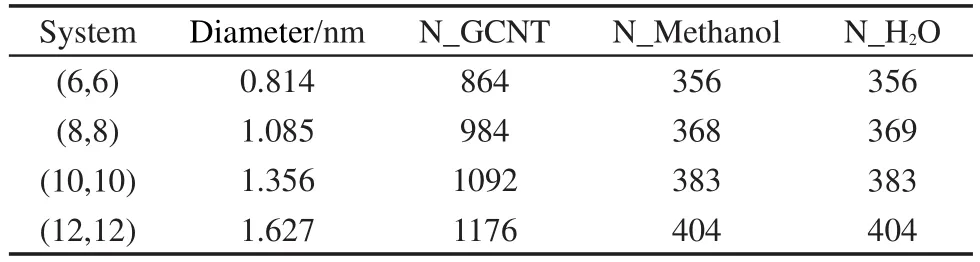
表1 不同类型纳米碳管体系的组成Table 1 Compositions of different CNT systems
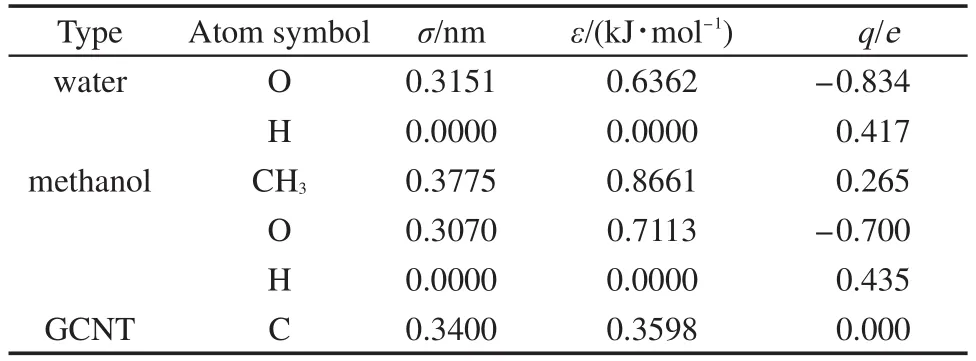
表2 本文所用的非键势能参数Table 2 Non-bond potential parameters used in this work
3 模拟结果及分析
3.1 甲醇-水分子的静态结构
为探究纳米碳管对甲醇-水混合溶液的分离机制,首先考察了平衡条件、外压作用、梯度电场作用等3种情况,以及4种管径所组成的12个模拟体系中甲醇-水分子的管内占有率、氢键结构与空间分布.
3.1.1 甲醇-水分子的管内占有率与氢键数
表3列出了12个模拟体系中甲醇与水分子的管内平均占有率以及管内、外平均氢键数.容易看出,在平衡条件下,(6,6)、(8,8)、(10,10)、(12,12)四种纳米碳管内甲醇的占有率(occupancy(m))分别是1.000、0.926、0.868、0.830.随着管径的增大,甲醇的占有率逐渐降低,但甲醇的占有数(n_in(m))始终高于水的占有数(n_in(w)),这与Zhao等7的结论十分吻合.
甲醇的较高占有率可以归结为两个原因:(1)甲醇分子与纳米碳管的范德华相互作用大于水分子与纳米碳管的,使得甲醇更容易靠近石墨烯挡板并进入纳米碳管;(2)除去(6,6)纳米碳管,甲醇在体相、纳米碳管内的氢键数分别约为2.2、2.0,而水在体相中的氢键数在3.23左右.22,26,30进一步的研究发现,纳米碳管内水的氢键数介于2-3之间,且随着纳米碳管管径的增大而上升,(12,12)纳米碳管内水分子的氢键数为2.9,已接近体相值.也就是说,在甲醇与水分别由体相进入纳米碳管内的过程中,甲醇分子氢键损失数约为0.2,而水分子的氢键损失数则始终大于甲醇,且管径越大,氢键损失数越小.所以,相比于水分子,甲醇更容易进入纳米碳管,特别是进入小尺寸纳米碳管.对于小尺寸(6,6)纳米碳管,以前的研究8表明,甲醇与水一样,在管内呈一维链状排布,每个甲醇分子只与相邻的分子形成一个氢键,氢键数约为1,此时,当甲醇与水分别进入纳米碳管时,其氢键损失数分别为1.2与2.2,较小的氢键损失数导致甲醇在(6,6)管内的占有率为100%,几乎没有水分子进入.
相比于平衡条件下相应管径的情况,在外压作用下,进入纳米碳管的甲醇数略有降低,取而代之的是水分子.但是,由于水分子体积小于甲醇分子,因此,管内分子总数较平衡条件有所增加.随着管径的增大,甲醇分子占有率进一步下降,更多的水分子进入到纳米碳管中.不过,对于讨论的4种纳米碳管体系,甲醇的占有率始终高于水的.值得注意的是,在平衡条件与外压作用情况下,在相同管径的研究体系中甲醇与水的氢键数几乎一致,也就是说,当前的外压作用对体系的氢键结构影响较小.
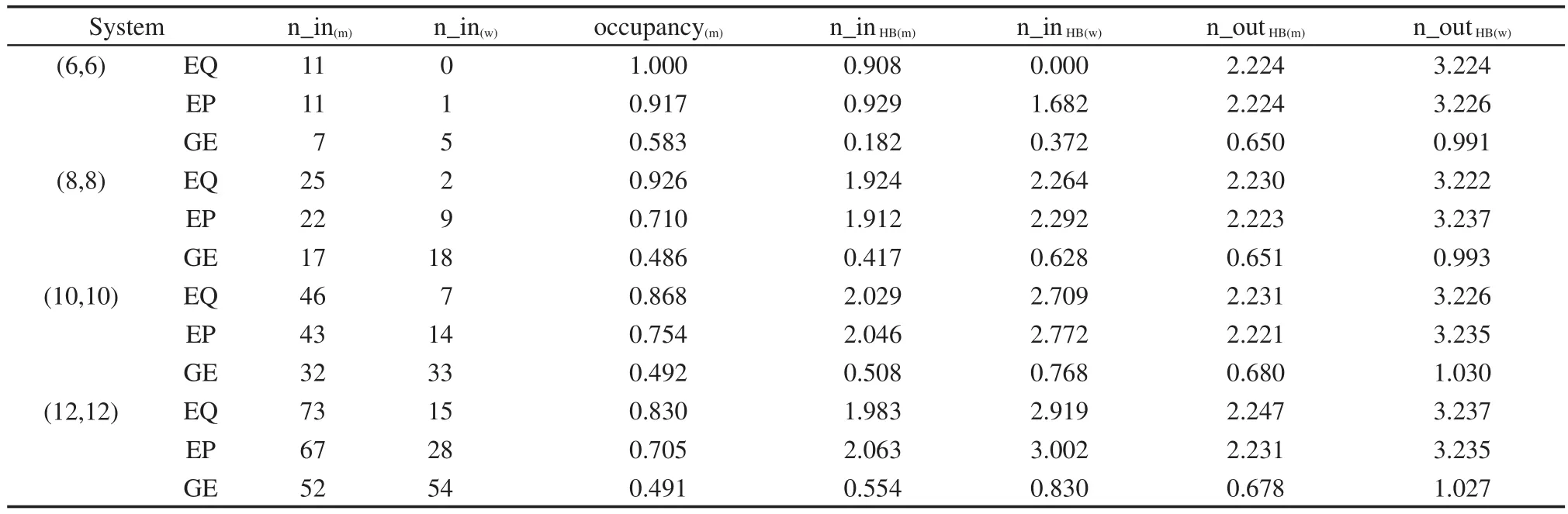
表3 纳米碳管内甲醇与水的平均占有率与纳米碳管内外分子的平均氢键个数Table 3 Average occupancy of methanol and water molecules in CNT and the average number of hydrogen bonds per molecule in and out of the CNT
在梯度电场作用下,我们发现,与平衡条件以及外压作用下形成鲜明对比,纳米碳管中甲醇的占有率、甲醇-水的总分子数、甲醇-水的氢键数均发生明显的变化.除了最小的(6,6)纳米碳管外,其他管径较大的3个体系中,更多的水分子进入管内,并取代甲醇的位置,导致甲醇占有率略低于0.5.与此同时,甲醇-水总分子数明显增加,例如在(12,12)管内,甲醇-水总分子数为106,明显高出平衡条件下的88,以及外压作用下的95;此外,甲醇与水的氢键体系受到了显著的影响,无论是甲醇分子还是水分子,无论是管内还是管外,氢键数明显小于相应的平衡条件下的氢键数.上述结果表明,在当前的梯度电场作用下,甲醇与水分子的氢键结构已被严重破坏.
3.1.2 甲醇-水分子沿纳米碳管轴向分布
图2给出了12个模拟体系中甲醇分子、水分子在管内、管口及体相区沿纳米碳管轴向的数密度分布情况.可以看出,在平衡条件下,4种管径体系中,甲醇与水均呈现为对称性分布.在靠近石墨烯挡板的管口附近,甲醇分布出现极大峰,表明在管口附近,主要聚集着甲醇分子,纳米碳管对甲醇的选择性吸附导致管内甲醇的分布大于水的分布.另一方面,由于各体系中甲醇与水的分子总数是相同的,因此,甲醇在纳米碳管内较高的数密度分布必然导致其在体相区较低的数密度分布.
相比于相应的平衡条件情况,在外压作用下,甲醇分布基本不变,而水分子在管口附近的分布发生了明显变化.在纳米碳管的左侧,水的分布由左至右,逐渐增大,在管口附近形成最大,其峰位与紧邻的甲醇峰相似,但峰宽远大于甲醇,此外,随着体系管径的增大,水的峰高逐渐增大,至(10,10)管时其峰高已高于甲醇;另一方面,在纳米碳管的右侧,水的占有数低于甲醇的占有数,在管口附近呈现极小.沿z轴方向远离管口,水的数密度逐渐增大.由于体系外压方向是由左向右的,上述分布变化表明,与甲醇相比,外压对水分子的影响较大,同时,由于水分子进入纳米碳管的速度小于水在管口的聚集速度,因此,在纳米碳管左侧管口处出现了水分子堆积的情况.不过,对于管径较大的体系,在左侧管口附近,水分子占有数已高于甲醇占有数,补偿了纳米碳管与水吸附能力较弱的劣势,水进入纳米碳管几率增大,在纳米碳管中的占有率也明显增大.
在梯度电场作用下,在4种不同管径体系的管口附近、体相区,甲醇与水的轴向分布呈现惊人的一致.但是在管内区域,随着管径尺寸的增大,甲醇与水的数密度随之增高.分析表明,与相应的平衡条件以及外压作用相比,在梯度电场的作用下,纳米碳管由疏水性向亲水性转变,导致越来越多的水分子进入纳米碳管,取代了甲醇的位置,引起纳米碳管内醇-水结构发生变化.为此,我们将在下一节讨论纳米碳管内醇-水结构的径向分布情况,以期从另一侧面对上述情况做出合理的解释.
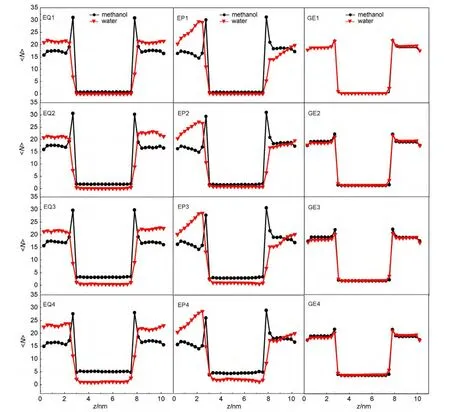
图2 甲醇与水沿z轴方向的数密度分布Fig.2 Number distribution of methanol and water along z axis
3.1.3 纳米碳管内甲醇-水分子的径向分布
图3给出了12个模拟体系中甲醇与水分子中氧原子的径向分布.在平衡条件下,由于管径较小的(6,6)与(8,8)管体系中,纳米碳管内主要由甲醇分子单一组分组成,因此,我们主要讨论另外两个管径较大的体系.容易看出,甲醇分子中氧原子主要分布在管壁附近,而水分子的氧原子主要分布在纳米碳管的轴心附近,表明受限的甲醇与水呈现了显著的不混溶现象.由于纳米尺寸的纳米碳管具有较大的比表面积,因此,纳米碳管管壁区域的体积比轴心区域大得多,同时,由于纳米碳管管壁由疏水性碳原子构成,主要表现为疏水性.这就导致了纳米碳管内带有疏水基团的甲醇较极性的水分子具有较大占有率.
在外压作用下,在较小管径的两个体系中,管内吸附的仍主要是甲醇分子,尽管较平衡体系来说,更多的水分子进入了纳米碳管中;与平衡体系相似,在较大管径的两个体系中,甲醇主要分布在纳米碳管内表面,水分子主要分布在轴心附近.甲醇与水分子在纳米碳管内呈现的这种不混溶结构,与Zhao等7的研究结果相一致.对比平衡条件的情况,外压作用下,水分子在管壁附近的分布峰值有所升高,这可能是由于在外压作用下,更多的水分子被压入纳米碳管内,使得管内总分子数有所增加,而这部分增加的水分子又会在管壁附近与甲醇分子形成占位竞争.
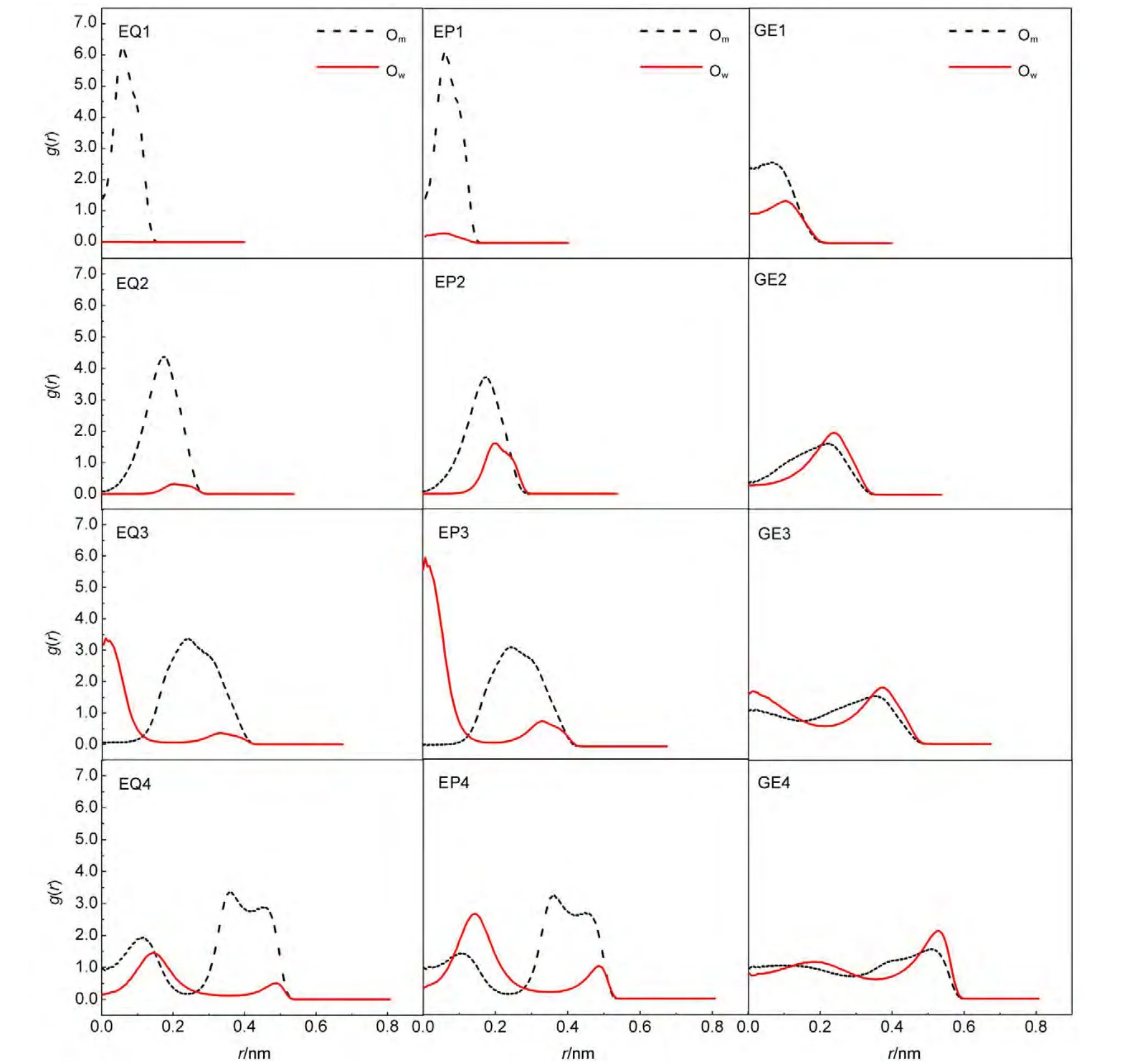
图3 纳米碳管内甲醇与水的径向分布Fig.3 Radial distributions of methanol and water molecules in CNTs
在梯度电场作用下,甲醇与水分子径向分布与前面讨论的情况完全不同,除(6,6)管体系中水的占有率较低导致其峰高较低外,在其他3个较大管径的体系中,甲醇与水具有相似的径向分布曲线,峰值均出现在管壁区域.说明在当前的梯度电场作用下,纳米碳管由疏水性向亲水性转变,更多的水分子分布于管壁,纳米碳管内甲醇-水的不混溶现象消失,与体相一致,呈现出完全混溶性质.值得一提的是,在电场强度作用下,纳米碳管的疏水性可以向亲水性转变的性质,与Pollack31和Hu32等的研究发现相一致.这在一定程度上表明较强的电场不利于甲醇-水的分离.
3.1.4 纳米碳管中甲醇-水分子的取向分布
图4描述了12个模拟体系中纳米碳管内甲醇与水分子取向分布.容易发现,在同一管径的平衡条件下,甲醇与水分子的取向分布与外压作用下相应的分布基本是一致的,明显不同的是在平衡条件时,由于水分子的管内占有率为零,导致(6,6)纳米碳管中水分子不存在取向分布.也就是说,在当前的外压作用下,对甲醇与水分子的取向分布影响不大.进一步的分析显示,在小尺寸的(6,6)与(8,8)纳米碳管体系中,甲醇的取向分布分别呈现出对称的双峰与单峰结构,表明在小尺寸管径的限制作用下,甲醇呈现出结构有序性;同样的,在相同的小尺寸管径限制下,水的结构也呈现一定的结构有序性,其取向分布主要出现在与z轴夹角为30°-40°的方向上.与小尺寸体系不同,在大尺寸的(10,10)与(12,12)纳米碳管体系中,甲醇与水的取向分布曲线在30°-150°范围内形成平台,呈现出各向同性特点,表明此时甲醇与水的结构已趋近于体相.此外,在当前的外加梯度电场作用下,4种不同管径的体系中,甲醇与水的取向分布曲线几乎是重叠一致的,与平衡条件及外压作用情况所呈现的平台不同,在梯度电场作用下,分布曲线在110°左右出现极值.结合上节讨论的径向分布,可以认定在梯度电场作用下,甲醇与水在所研究的纳米碳管内是混溶的,没有呈现出平衡条件或外压作用下甲醇与水分子具有可分离结构的特点.
我们推断,外压作用对纳米碳管中受限甲醇与水分子的氢键结构影响较小,与平衡体系一样,在纳米碳管管壁的限制作用下,管内的氢键具有一定的方向性,决定了甲醇与水结构的有序性.而在梯度电场作用下,分子的氢键结构被严重破坏,氢键数远小于平衡条件与外压作用的情况,管内甲醇与水的结构有序性发生改变.
3.2 甲醇-水在纳米碳管中的输运性质
流通量是研究纳米碳管中甲醇与水输运性质的重要物理量,为了便于讨论,我们定义甲醇(水)的正流通量/负流通量(flow+/flow-)为每纳秒时间内甲醇(水)分子从纳米碳管的左侧/右侧(-z/+z)进入通过纳米碳管并从右侧/左侧(+z/-z)流出的分子个数,总流通量(Flow)为正流通量与负流通量之和,净流通量(Flux)为正流通量与负流通量之差.表4给出了三种条件下,12个模拟体系中甲醇-水的流通量.
由表4可知,在平衡条件下,不论管径如何变化,甲醇与水的正、负流通量都很小,导致净流通量基本为0.需要指出的是,依据Nakamura和Ohno的报道,33300 K时,一元纯甲醇体系中甲醇在(8,8)、(10,10)、(12,12)等纳米碳管中的正、负流通量均大于20 ns-1,远大于二元甲醇-水混合体系中甲醇的流通量(见表4).
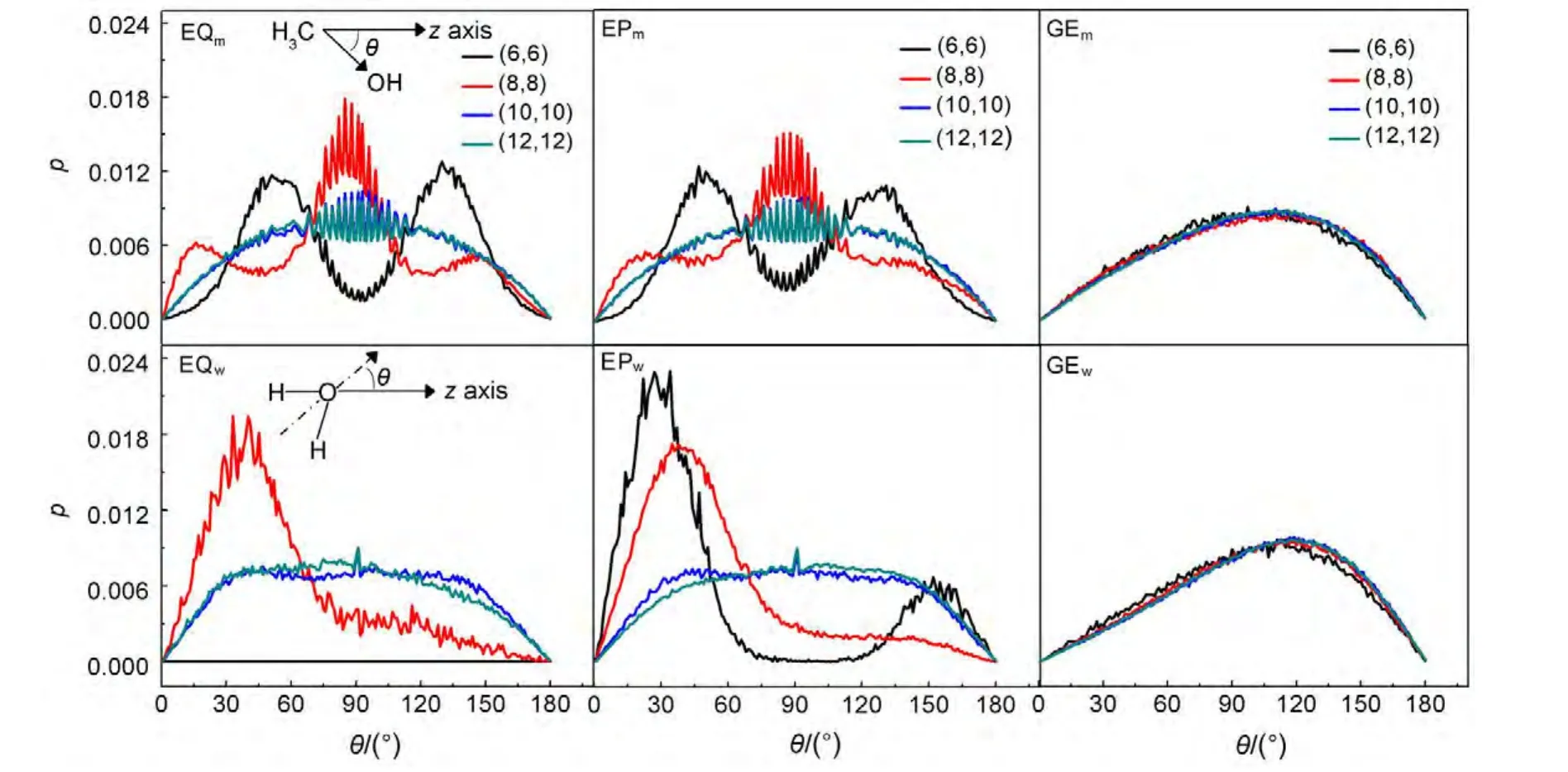
图4 纳米碳管内甲醇与水的取向分布Fig.4 Orientation distributions of methanol and water molecules in CNTs
在外压作用下,由于体系中每个分子受到z轴正方向的作用力,导致甲醇与水移动是单方向的,z轴负方向流通量基本为0.此时,甲醇与水的净流通量分别等于甲醇与水正方向的流通量.值得注意的是,纳米碳管内甲醇的净流量明显高于水的净流量,可能的原因有两个:一是纳米碳管对甲醇的选择性吸附,甲醇可以相对容易地进入纳米碳管,导致甲醇在管内的高占有率;二是甲醇中甲基的疏水性使得纳米碳管内的甲醇主要分布在纳米碳管壁附近,而水分子则分布在管轴心附近,由于管壁区域氢键形成机会明显小于纳米碳管轴心附近区域,因此,管中甲醇的氢键个数明显少于水的氢键个数,导致甲醇具有较快的移动速度.也就是说,在当前的外压作用下,利用甲醇与水在纳米碳管中流通量的差异,可以达到一定的分离目的,尽管分离的效率还较低.
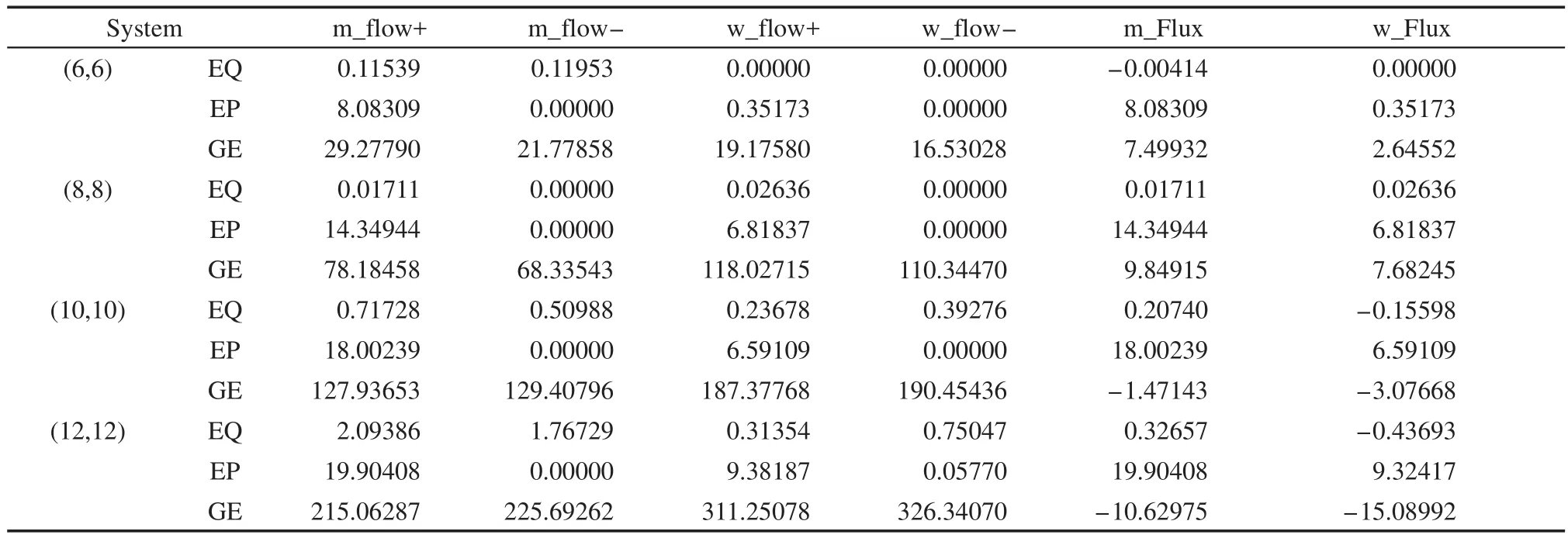
表4 甲醇与水沿z轴的流通量Table 4 Flux of methanol and water along the z axis
在梯度电场作用下,不同管径纳米碳管内甲醇与水均具有较大的正、负流通量,其值随着管径的增大而增大,比相应的外压作用体系的流通量大一个数量级,导致甲醇与水的总流通量远高于外压作用下相同管径体系中对应的总流通量.结合前面氢键结构的讨论,我们认为,氢键结构破坏是梯度电场下甲醇与水流通量增大的主要原因.值得注意的是,除(6,6)纳米碳管外,水分子的正、负流通量始终高于甲醇的,究其原因,一方面,管内水分子略多于甲醇分子,另一方面,从分子的径向分布可以看出,较多的水分子分布于管壁,水的氢键结构被破坏,使之更容易在纳米碳管内流通,这与Wang等24报道的梯度电场有利于水的流动结论是一致的.进一步的分析表明,在梯度电场作用下,纳米碳管内甲醇与水的运动均是双向的,但甲醇与水的正、负流通量数值相近,使得净流通量远小于正、负流通量,且与外压作用下的净流通量差异不大,说明与外压作用相比,当前的梯度电场作用并不能提高甲醇与水的分离效率.而梯度电场下,受限甲醇与水混合体系中水的双向流动性是其净流通量较小的主要原因,这种双向流动性与纯水体系的单向性流动21具有本质差异,具体原因还需要后续工作进一步解释.
4 结论
针对摩尔比为1:1的甲醇-水溶液体系,利用分子动力学方法,考察了平衡条件、外压作用及梯度电场作用等3种条件下,4种不同管径纳米碳管所组成的12个模拟体系中静态性质与动态流通性质.
与平衡体系相比,外压作用对纳米碳管内甲醇-水的静态结构影响很小,纳米碳管内甲醇与水仍呈现出明显的不混溶现象.甲醇主要分布于管壁,水分子主要分布于轴心位置.此时,甲醇与水分子呈单向流动,较相应的平衡体系,二者的流通量均有所增加,而且甲醇的净流通量远远高于水的,这可以从纳米碳管内甲醇的高占有率以及管壁分布导致氢键结构被破坏等两个方面来解释.上述研究表明,外压作用有利于实现二者的分离,但如何提高甲醇-水的分离效率还有待于进一步研究.
在梯度电场作用下,纳米碳管的疏水性向亲水性转变,管壁对甲醇倾向性吸附能力减弱.较相应的平衡及外压作用体系,管内甲醇分子数减少,越来越多的水分子进入纳米碳管并分布于管壁区域,导致受限甲醇与水像体相一样呈现混溶现象.此时,甲醇与水分子在管内呈快速的双向流动,不同于纯水体系中的水分子的单向流动,且除(6,6)纳米碳管外,水分子的正、负流通量均高于甲醇的,粒子的正、负流通量比相应的外压作用体系高出近一个数量级,但由于粒子呈双向流动,且流通量相近,因此,甲醇与水的净流通量与外压作用下的净流通量差异不大.这表明梯度电场虽然有利于加快分子的输运,尤其是水分子,但与外压作用体系相比,当前的电场强度并不能够提高甲醇与水的分离效率.
我们注意到,在当前的电场强度下,纳米碳管呈现出亲水性,水分子与甲醇分子一样分布在纳米碳管内壁,导致受限体系中特有的甲醇-水不混溶结构受到了破环.从结构上讲,这无疑不利于甲醇与水的分离.既需要作为驱动力的梯度电场的加速输运,又需要尽可能保持受限甲醇-水的不混溶结构,也许是提高醇-水分离的关键.因此,适当降低电场强度,寻找最佳作用电场,是研究甲醇-水分离的一个合理的努力方向.
(1) Remy,T.;Saint Remi,J.C.;Singh,R.;Webley,P.A.;Baron,G.V.;Denayer,J.F.M.J.Phys.Chem.C2011,115(16),8117.doi:10.1021/jp111615e
(2) Nakao,S.I.;Saitoh,F.;Asakura,T.;Toda,K.;Kimura,S.J.Membr.Sci.1987,30(3),273.doi:10.1016/S0376-7388(00)80123-4
(3) Hummer,G.;Rasaiah,J.C.;Noworyta,J.P.Nature2001,414(6860),188.doi:10.1038/35102535
(4) Hinds,B.J.;Chopra,N.;Rantell,T.;Andrews,R.;Gavalas,V.;Bachas,L.G.Science2004,303(5654),62.doi:10.1126/science.1092048
(5)Holt,J.K.;Park,H.G.;Wang,Y.M.;Stadermann,M.;Artyukhin,A.B.;Grigoropoulos,C.P.;Noy,A.;Bakajin,O.Science2006,312(5776),1034.doi:10.1126/science.1126298
(6) Liu,Y.;Consta,S.;Goddard,W.A.J.Nanosci.Nanotechnol.2010,10(6),3834.doi:10.1166/jnn.2010.1999
(7)Zhao,W.H.;Shang,B.;Du,S.P.;Yuan,L.F.;Yang,J.L.;Zeng,X.C.J.Chem.Phys.2012,137(3),034501.doi:10.1063/1.4732313
(8)Tian,X.L.;Yang,Z.X.;Zhou,B.;Xiu,P.;Tu,Y.S.J.Chem.Phys.2013,138(20),204711.doi:10.1063/1.4807484
(9) Service,R.F.Science2006,313(5790),1088.doi:10.1126/science.313.5790.1088
(10) Corry,B.J.Phys.Chem.B2008,112(5),1427.doi:10.1021/jp709845u
(11) Gong,X.J.;Li,J.Y.;Lu,H.J.;Wan,R.Z.;Li,J.C.;Hu,J.;Fang,H.P.Nat.Nanotechnol.2007,2(11),709.doi:10.1038/nnano.2007.320
(12) Guo,X.Q.;Su,J.Y.;Guo,H.X.Soft Matter2012,8(4),1010.doi:10.1039/c1sm06509b
(13) Joseph,S.;Aluru,N.R.Phys.Rev.Lett.2008,101(6),064502.doi:10.1103/PhysRevLett.101.064502
(14) Su,J.Y.;Guo,H.X.ACS Nano2010,5(1),351.
(15)Wong-Ekkabut,J.;Miettinen,M.S.;Dias,C.;Karttunen,M.Nat.Nanotechnol.2010,5(8),555.doi:10.1038/nnano.2010.152
(16) Ge,Z.P.;Shi,Y.C.;Li,X.Y.Acta Phys.-Chim.Sin.2013,29,1655.[葛振朋,石彦超,李晓毅.物理化学学报,2013,29,1655.]doi:10.3866/PKU.WHXB201305222
(17) Li,H.L.;Jia,Y.X.;Hu,Y.D.Acta Phys.-Chim.Sin.2012,28,573.[李海兰,贾玉香,胡仰栋.物理化学学报,2012,28,573.]doi:10.3866/PKU.WHXB201112191
(18) de Gennes,P.G.;Brochard-Wyart,F.;Quere,D.Capillarity and Wetting Phenomenon;Springer:New York,2003.
(19) Chaudhury,M.K.;Whitesides,G.M.Science1992,256(5063),1539.doi:10.1126/science.256.5063.1539
(20)Lü,Y.J.;Chen,M.Acta Phys.-Chim.Sin.2012,28,1070.[吕勇军,陈 民.物理化学学报,2012,28,1070.]doi:10.3866/PKU.WHXB201202213
(21) Linke,H.;Alemán,B.J.;Melling,L.D.;Taormina,M.J.;Francis,M.J.;Dow-Hygelund,C.C.;Narayanan,V.;Taylor,R.P.;Stout,A.Phys.Rev.Lett.2006,96(15),154502.doi:10.1103/PhysRevLett.96.154502
(22) Zheng,J.;Lennon,E.M.;Tsao,H.K.;Sheng,Y.J.;Jiang,S.J.Chem.Phys.2005,122(21),214702.doi:10.1063/1.1908619
(23) Goldsmith,J.;Hinds,B.J.J.Phys.Chem.C2011,115(39),19158.doi:10.1021/jp201467y
(24) Wang,Y.;Zhao,Y.J.;Huang,J.P.J.Phys.Chem.B2011,115(45),13275.doi:10.1021/jp2069557
(25) Thakur,S.K.;Chauhan,S.Adv.Appl.Sci.Res.2011,2(2),208.
(26) Jorgensen,W.L.;Chandrasekhar,J.;Madura,J.D.;Impey,R.W.;Klein,M.L.J.Chem.Phys.1983,79(2),926.doi:10.1063/1.445869
(27) Jorgensen,W.L.;Briggs,J.M.;Contreras,M.L.J.Phys.Chem.1990,94(4),1683.doi:10.1021/j100367a084
(28) Lindorff-Larsen,K.;Piana,S.;Palmo,K.;Maragakis,P.;Klepeis,J.L.;Dror,R.O.;Shaw,D.E.Proteins:Struct.Funct.Bioinf.2010,78(8),1950.
(29) Kalé,L.;Skeel,R.;Bhandarkar,M.;Brunner,R.;Gursoy,A.;Krawetz,N.;Phillips,J.;Shinozaki,A.;Varadarajan,K.;Schulten,K.J.Comput.Phys.1999,151(1),283.doi:10.1006/jcph.1999.6201
(30) Shevade,A.V.;Jiang,S.;Gubbins,K.E.J.Chem.Phys.2000,113(16),6933.doi:10.1063/1.1309012
(31) Pollack,M.;Fair,R.B.;Shenderov,A.D.Appl.Phys.Lett.2000,77(11),1725.doi:10.1063/1.1308534
(32)Hu,L.;Gruner,G.;Gong,J.;Kim,C.;Hornbostel,B.Appl.Phys.Lett.2007,90(9),093124.doi:10.1063/1.2561032
(33) Nakamura,Y.;Ohno,T.Chem.Phys.Lett.2012,539,123.

