吡唑基镁卤化物/四氢呋喃可充镁电池电解液
非路热∙吐尔逊 祖丽皮亚∙沙地克 努丽燕娜 杨 军 王久林
(上海交通大学化学化工学院,上海200240)
1 引言
人类社会的发展离不开优质能源的出现和先进能源技术的使用.随着人类对能源需求日益增大,不可再生能源短缺迫使人们把目光转向新型可再生的清洁能源方面.化学电源由于具有能量转换效率高、能量密度大、污染小、可移动等特点备受人们青睐.在现有的化学电源技术中,锂离子电池因其能量密度大、技术成熟而被广泛应用于各个领域,但由于存在安全性较低和成本较高的问题,在大型电能储存设备和电动汽车动力电池方面应用受到一定限制.人们开始注意到在元素周期表上与锂处于对角线位置的镁,根据对角线规则,二者具有较为相似的物理和化学性质,且镁储量十分丰富,具有成本低、电极电位较低、理论容量较高、加工处理方便、对环境无污染等诸多优点,因此以金属镁为负极的可充镁电池被认为在大型电能储存设备和电动汽车动力电池方面很有发展前景.1,2
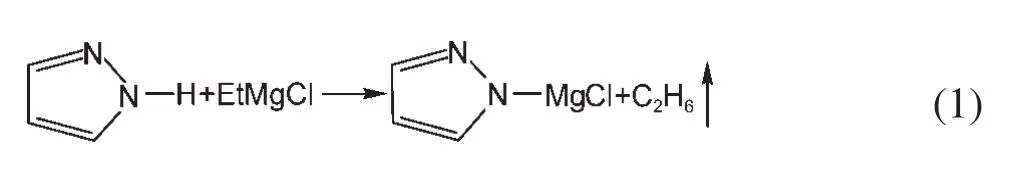
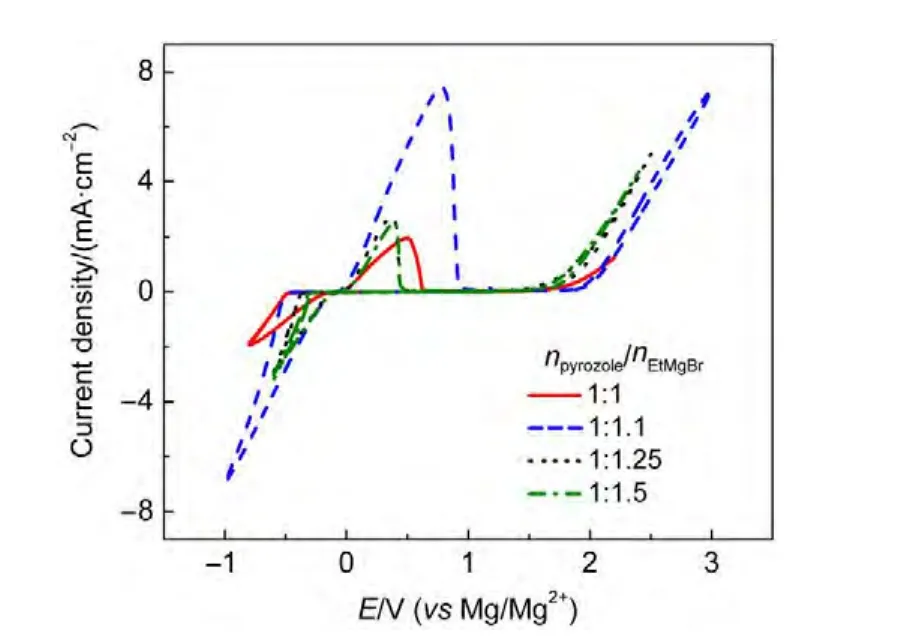
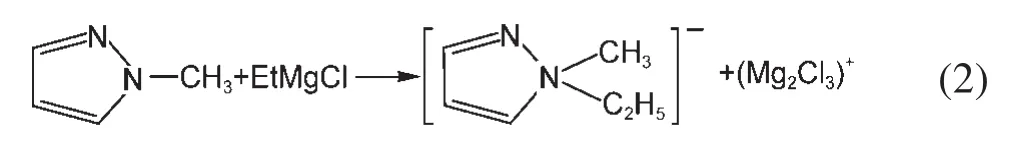
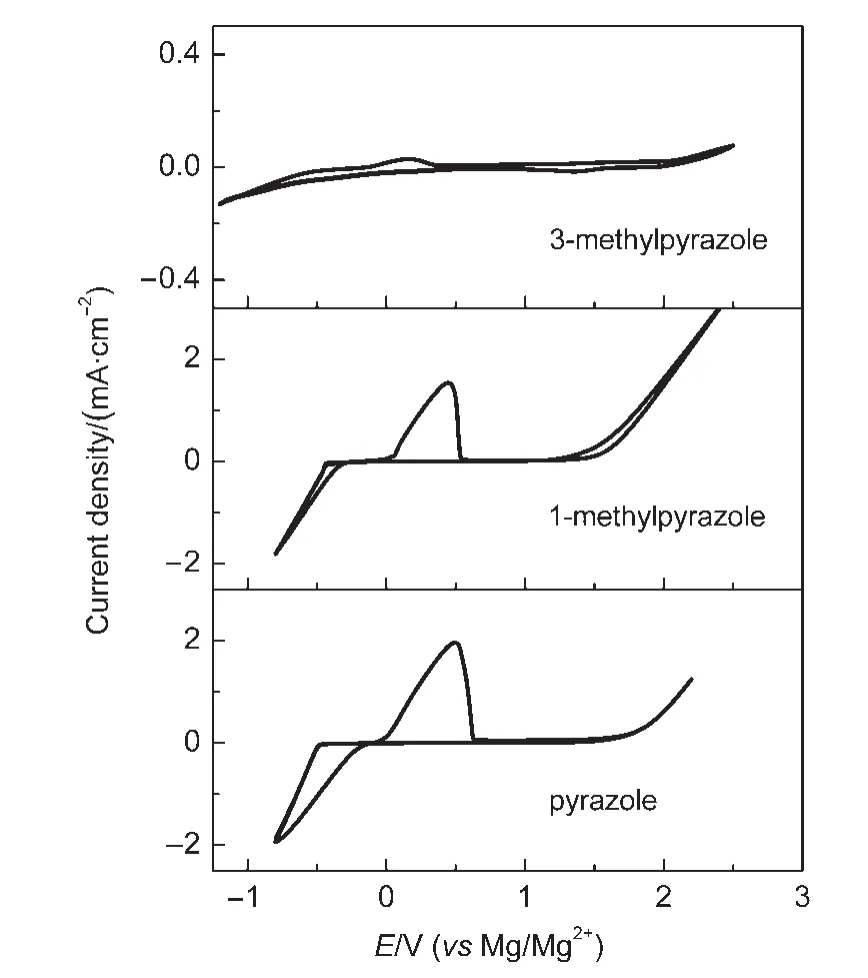
由于镁的反应活性较高,在大多数电解液中都会形成表面钝化膜,致使镁离子无法穿过,从而难以进行可逆的镁沉积和溶出,限制了其电化学活性.研究表明,在格氏试剂(RMgX,R为烷基或芳基,X为卤素)、3-6Mg(BR2R′2)2(其中R、R′为烷基或芳基)、7-9Mg(AX4-nRnʹRʹnʺ)2络合物(其中 A=Al、B、Sb、P、As、Fe、Ta等,X=Cl、Br、F,R、R′为烷基或芳基,0 格氏试剂与含有活泼氢的氨基化合物反应可以生成氨基镁卤络合物.1990年,Gregory等8通过N-甲基苯胺、N-乙基苯胺、二苯胺和2,5-二甲基吡咯与乙基氯化镁的醚溶液反应,制备得到了相应的氨基镁卤化物,首次报道了溶于醚中的氨基镁卤化物电解液体系用于镁沉积-溶出的电化学性能.Liebenow等9在2000年又比较了N-甲基苯胺溴化镁、吡咯基溴化镁、N,N-二(三甲基硅基)氨基氯化镁三种氨基镁卤化物/醚电解液的性能.其中,N,N-二(三甲基硅基)氨基镁氯化物中由于存在的Si―N―Si基团离域了N上的电子对,提高了电解液的阳极氧化分解电位.在此基础上,我们课题组研究了苯酚基镁卤化物/醚、19苯硫酚基镁卤化物/醚、20含氮杂环的吡咯烷基镁卤化物/醚21电解液体系中的镁沉积-溶出性能,为了提高可充电池电解液的性能,进一步系统化了解含氮杂环基镁卤化物/醚电解液的性能,本文研究了不同取代基的吡唑与不同格氏试剂反应配制的吡唑基镁卤化物/THF电解液体系,重点介绍了1-甲基吡唑基体系.测试了该电解液体系在不同工作电极上的循环伏安性能和镁沉积-溶出性能,并分析了沉积物的形貌和组成.1-甲基吡唑基卤化物电解液体系在非惰性电极不锈钢上显示出适宜的氧化分解电位和低的镁沉积-溶出过电位;简单的制备过程,高的循环效率及稳定的可逆性使该电解液体系在可充镁电池中显示出良好的应用前景. 吡唑购于TCI试剂公司,1-甲基吡唑、4-溴吡唑、4-硝基吡唑、4-甲基吡唑、3-甲基吡唑、乙基溴化镁的四氢呋喃溶液(EtMgBr/THF,1 mol∙L-1),苯基氯化镁的四氢呋喃溶液(PhMgCl/THF,2 mol∙L-1)、苯基溴化镁的四氢呋喃溶液(PhMgBr/THF,1 mol∙L-1)、4-氟苯基溴化镁的四氢呋喃溶液(4-F-PhMgBr/THF,1 mol∙L-1)和金属镁条购于上海百灵威化学技术有限公司,四氢呋喃(THF)使用之前经实验室自组装设备重蒸纯化处理去除微量水.所有试剂放置于氩气气氛手套箱(MBRAUN,德国UNILAB)中备用.铂、铜、镍、不锈钢(SS)盘(d=2 mm)电极购于上海仙仁仪器仪表有限公司. 使用CHI660电化学工作站(上海辰华仪器有限公司)作循环伏安扫描测试.LAND-CT2001A系统测试扣式电池中电解液的镁沉积与溶出循环特性.FE30电导率仪和inLab710电极(Mettler Toledo,Switzerland)测试电解液的电导率.D/max-2200/PC型X射线衍射仪(XRD,日本Rigaku公司)和扫描电子显微镜(SEM,FEI SIRION)分析在铜基质表面沉积物的组分和形貌. 2.2.1 电解液配置 在氩气气氛手套箱(MBRAUN,德国UNILAB)中,室温条件下,用电子天平称取一定量的不同种类吡唑加入到干净的双口烧瓶中,用移液枪移取相应量的格氏试剂/THF溶液缓慢加入到双口烧瓶中,边加边搅拌,反应时间为1.5 h.反应过程中,瓶口打开,乙烷气体及时排出.反应完毕,得到微黄色、深黄色电解液(有些有白色沉淀).反应式(1)为吡唑和EtMgCl的反应,除1-甲基吡唑以外,其它吡唑类与格氏试剂的反应与(1)式类似: 2.2.2 电化学性能的测试 电解液中镁的电化学沉积-溶出性能通过循环伏安曲线(CV)来测定,测试过程均在室温、氩气手套箱中进行.实验采用三电极体系,工作电极使用前用三氧化铝粉末进行抛光处理,然后用去离子水及无水乙醇清洗,烘干后使用.参比电极、对电极均采用表面用800Cw砂纸打磨处理干净的镁条.测试用的三电极管及塞子均经过烘干处理.测量时,从开路电位开始向负方向扫描,扫描速率为50mV∙s-1. 通过CR2016扣式电池的恒电流充放电测试电解液中镁的电化学沉积-溶出循环性能.扣式电池的组装在氩气气氛手套箱中进行.采用的正极为铜箔(99.99%,直径为12 mm),负极为镁条(使用前用800Cw砂纸打磨光亮),隔膜为Entek PE膜;电池组装后在室温放4 h后进行测量.充放电过程中的电流密度为0.1 mA∙cm-2,镁的沉积过程通过放电时间控制,而镁的脱出通过充电极限电位到0.8 V来控制,每次充电与放电过程之间缓冲时间为30 s. 2.2.3 XRD及SEM测试 恒电流条件下进行镁在金属Cu基质上的沉积,沉积电量为10.7 C∙cm-2.实验采用两电极体系,室温条件下在氩气气氛的手套箱中进行测定,仪器设备采用CHI660C电化学工作站;正极为铜片,表面用无水乙醇擦拭干净;负极为镁条,使用前用800Cw砂纸打磨光亮. 将沉积好的扣式电池在氩气气氛手套箱中打开,Cu片上的沉积样品用重蒸后的THF溶剂进行冲洗,晾干后密封取出,使用X射线衍射仪(Cu靶)对铜基质上的电沉积物进行XRD检测,扫描范围为30°-75°,扫描速率为4.0(°)∙min-1. 通过JSM-7401F型场发射扫描电子显微镜观察镁在铜金属基质上的沉积形貌.沉积后的样品在氩气气氛手套箱中用THF溶剂进行冲洗,晾干后密封取出进行SEM检测. 图1为吡唑(C3H4N2)与EtMgBr/THF按不同摩尔比配制的C3H3N2MgBr/THF电解液在铂盘电极上的镁沉积-溶出的循环伏安性能对比,对电极和参比电极为镁条,扫描速率为50 mV∙s-1.在几种溶液中都可以进行镁的电化学沉积和溶出.在从开路电位向负向扫描的过程中,从-0.2 V(vsMg/Mg2+)以下开始出现沉积电流,沉积过程中呈现一个典型的由过电位驱动产生晶核及晶核生长的成核环;正向扫描过程中,沉积镁的溶出从0 V(vsMg/Mg2+)左右开始,在0.35 V(vsMg/Mg2+)以上出现镁的氧化溶出峰;再向正电压方向扫描时电流基本保持不变,表明没有副反应发生,直到电解液发生分解,刚开始出现电流明显上升的电位即为电解液的氧化分解电位.吡唑与EtMgBr的摩尔配比对其电化学有一定影响.吡唑与EtMgBr的摩尔比为1:1.1时,电解液显示出最高的氧化分解电位(1.9 V(vsMg/Mg2+))和最高的沉积-溶出峰电流.此浓度下的镁溶出起始电位最低,但峰电位最高.继续增加EtMgBr比例,当吡唑与EtMgBr的摩尔比达到1:1.25和1:1.5时,由于过量EtMgBr的存在,大大降低了电解液体系的氧化分解电位(约1.7 V(vsMg/Mg2+)).Aurbach等13,16对不同酸碱比例制得的“一代电解液”和“二代电解液”的循环伏安比较中发现,电解液制备时酸碱组分比例的变化对镁沉积-溶出的过电位、峰电流和效率以及电解液的阳极稳定性有很大影响.这是由于电解液中存在复杂的化学平衡,酸碱比例的变化改变了溶液中性分子、阴阳离子的组分和强度,导致了其电化学性能的差异.10,13这四种电解液放置过程中均有沉淀出现,固体沉淀的组分为C3H3N2MgBr.其中吡唑与EtMgBr的摩尔比为1:1的溶液与其它三种相比沉淀明显较少,虽然其镁沉积-溶出电流最小,但氧化分解电位适当,在接下来的研究中选择吡唑与EtMgBr的摩尔配比为1:1. 图1 吡唑与格氏试剂EtMgBr按不同摩尔比反应制得的1 mol∙L-1C3H3N2MgBr/THF电解液在铂盘电极上的镁沉积-溶出的循环伏安曲线Fig.1 Typical cyclic voltammograms of Mg depositiondissolution on platinum disk electrode in 1 mol∙L-1 C3H3N2MgBr/THF electrolyte obtained from the reaction of pyrozole and EtMgBr at different molar ratios 考虑到在吡唑环的不同位置引入不同的吸电子基团和供电子基团以及基团不同的位置可能会对其与格氏试剂的反应过程产生一定影响,可以得到澄清的溶液.实验中分别将4-溴吡唑、4-硝基吡唑、4-甲基吡唑、3-甲基吡唑、1-甲基吡唑与EtMgBr按1:1摩尔比反应.其中,4-溴吡唑、4-硝基吡唑、4-甲基吡唑与EtMgBr反应之后溶液中存在大量沉淀,3-甲基吡唑、吡唑与EtMgBr反应后存在少量沉淀,而1-甲基吡唑与EtMgBr反应配制的电解液为澄清溶液,由于1-甲基吡唑中不存在可以与格氏试剂发生反应的活泼氢,反应过程和上面提到的反应式(1)不同,可能的反应过程如(2)式: 图2分别为吡唑、3-甲基吡唑、1-甲基吡唑与EtMgBr按1:1摩尔比反应配制的1 mol∙L-1电解液在铂盘电极上镁沉积-溶出的循环伏安性能对比.其中3-甲基吡唑与格氏试剂反应配制的电解液体系阳极氧化分解电位较高,但由于溶液中有明显沉淀存在,导致镁沉积-溶出电流较小;与略有沉淀的吡唑体系相比,1-甲基吡唑体系虽然阳极氧化分解电位较低,但溶液澄清,镁沉积-溶出过电位也较低. 图3为1-甲基吡唑与三种不同的格氏试剂按1:1摩尔比反应配制的1 mol∙L-1电解液在铂盘电极上的镁沉积-溶出循环伏安性能对比.可以看出,用吸电子能力强的苯基替换乙基、在苯环上引入强吸电子的F元素,可以改善镁沉积-溶出性能特别是提高电解液的阳极稳定性.其中1-甲基吡唑与PhMgCl反应配制的电解液体系中镁沉积-溶出的电流密度高于其余两种电解液,且氧化分解电位可以达到2.5 V(vsMg/Mg2+),相当于目前比较成熟的“一代电解液”0.25 mol∙L-1Mg(AlCl2BuEt)2/THF(2.5 V(vsMg/Mg2+)).与“一代电解液”相比,吡唑电解液体系在制备过程中不需要去除原料中溶剂的过程,具有简单易行的特点. 图2 吡唑、1-甲基吡唑、3-甲基吡唑与EtMgBr/THF按1:1摩尔比反应配制的1 mol∙L-1电解液在铂盘电极上镁沉积-溶出的循环伏安曲线Fig.2 Typical cyclic voltammograms of Mg depositiondissolution on platinum disk electrode in 1 mol∙L-1 electrolytes obtained from the reaction of pyrazole,1-methylpyrazole,3-methylpyrazole with EtMgBr/THF at 1:1 molar ratio 图3 1-甲基吡唑体系与三种不同的格氏试剂以1:1摩尔比反应配制的1 mol∙L-1电解液在铂盘电极上的镁沉积-溶出循环伏安曲线Fig.3 Typical cyclic voltammograms of Mg depositiondissolution on Pt disk electrode in 1 mol∙L-1electrolytes obtained from the reaction of 1-methylpyrazole with different Grignard reagents at 1:1 molar ratio 由于金属铂的价格较贵,不适合用作电池体系的集流体,我们进一步通过三电极体系的循环伏安测试比较了常用的不同金属电极Ni、SS、Cu、Al上的1-甲基吡唑-PhMgCl/THF电解液的电化学性能.图4给出了这四种金属电极在1 mol∙L-1的1-甲基吡唑-PhMgCl(摩尔比1:1)/THF电解液的循环伏安曲线.可以看出在这四种金属基质上都可以发生镁的电化学沉积和溶出,比较镁沉积-溶出电流可看出其性能由好到坏依次为Ni、SS、Cu、Al,但其阳极氧化稳定性大小依次为SS、Ni、Al、Cu,在SS和Ni电极上该电解液的氧化分解电位约为2.4和2.2 V(vsMg/Mg2+).值得注意的是在SS和Ni上的镁沉积-溶出电流明显高于Pt电极上的电流值.Feng等22系统研究了在“一代电解液”中镁的电化学可逆沉积-溶出的金属基质效应,发现镁在Ag、Cu、Ni等几种不同的金属基质上都可以进行沉积与溶出,但性能却存在较大差别.如,镁在Ag上的沉积过程中因为可以形成银-镁合金,对镁的进一步沉积起到了很大的促进作用,从而使得沉积-溶出峰电流和过电位都明显好于其他几种金属基质.1 mol∙L-1的1-甲基吡唑-PhMgCl(摩尔比1:1)/THF电解液在不同金属电极上的循环伏安曲线的差异也源于Mg沉积过程不同的金属基质效应. 图4 1 mol∙L-11-甲基吡唑-PhMgCl(摩尔比 1:1)/THF电解液在Al、Cu、SS和Ni工作电极上镁沉积-溶出的循环伏安曲线Fig.4 Typical cyclic voltammograms of Mg depositiondissolution in 1 mol∙L-11-methylpyrazole-PhMgCl(at 1:1 molar ratio)/THF electrolyte onAl,Cu,SS,and Ni electrodes 镁在电解液体系中可逆沉积-溶出的循环过程是表征可充镁电池电解液电化学性能的一个重要参数,可以通过扣式电池的恒电流循环充放电方法测试.图5显示了1 mol∙L-11-甲基吡唑-PhMgCl(1:1摩尔比)/THF电解液在Cu基底上镁的沉积-溶出循环伏安曲线和效率(镁溶出的电量和镁沉积的电量之比).由图中可以看出稳定循环过程中镁的沉积、溶出电位约为±0.06 V,镁在Cu基底上的首次沉积-溶出效率较低,但是稳定之后可达95%以上,表现出较高的镁可逆沉积-溶出循环效率. 图5 1 mol∙L-11-甲基吡唑-PhMgCl(摩尔比 1:1)/THF电解液中Cu基底上的镁沉积-溶出循环曲线(a)和循环效率(b)Fig.5 Mg deposition-dissolution cycling curves(a)and efficiencies(b)on Cu substrate in 1 mol∙L-1 1-methylpyrazole-PhMgCl(at 1:1 molar ratio)/THF electrolyte 图6分别为1 mol∙L-11-甲基吡唑-PhMgCl(摩尔比1:1)/THF电解液中,镁在Ni基质上的沉积-溶出性能及沉积-溶出效率.图中显示,镁在Ni基质上的沉积-溶出循环稳定,过电位低,首次效率为85.5%,稳定之后循环效率达98%,但在沉积-溶出循环到80次以上过电位逐渐变大,高于Cu基质上的;在Cu和Ni上均能够稳定循环200次以上.镁在不同金属基质上的电化学沉积-溶出循环性能的差异主要源于不同基质上镁沉积形貌的区别.12相对于疏松、粗糙的镁沉积物,致密、均匀的沉积层更有利于镁的溶出,提高镁沉积-溶出的长期循环性能.研究表明,与Ni相比,镁在Cu基质上更容易形成均匀、致密的沉积层.9,21 图7为1 mol∙L-11-甲基吡唑-PhMgCl/THF(摩尔比1:1)电解液体系中电沉积物的XRD图谱,沉积电量10.7 C∙cm-2.图中的衍射峰32.4°、34.3°、36.9°、47.9°、57.3°、62.9°、68.7°和70.2°为金属镁的特征峰(JCPDS 35-0821),43.4°、50.5°和 74.1°为铜基底的衍射峰,除此之外没有别的峰,这说明了沉积物确实是金属镁. 图8(a,b)显示了不同放大倍数下镁在铜金属基质上沉积形貌,沉积电量10.7 C∙cm-2.镁在铜基质上沉积层致密均匀,这对电解液在可充镁电池中的实际应用十分重要. 图6 1 mol∙L-11-甲基吡唑-PhMgCl(摩尔比1:1)/THF电解液中Ni基底上的镁沉积-溶出循环曲线(a)和循环效率(b)Fig.6 Mg deposition-dissolution cycling curves(a)and efficiencies(b)on Ni substrate in 1 mol∙L-11-methylpyrazole-PhMgCl(at 1:1 molar ratio)/THF electrolyte 图7 1 mol∙L-11-甲基吡唑-PhMgCl(摩尔比 1:1)/THF电解液中在铜基底上沉积物的XRD谱图Fig.7 XRD pattern of the electrodeposition on Cu substrate in 1 mol∙L-11-methylpyrazole-PhMgCl(at 1:1 molar ratio)/THF electrolyte 图8 1 mol∙L-11-甲基吡唑-PhMgCl/THF(摩尔比 1:1)电解液中镁在铜基质上的沉积形貌SEM图Fig.8 SEM images of magnesium deposition morphology on copper in 1 mol∙L-11-methylpyrazole-PhMgCl(at 1:1 molar ratio)/THF electrolyte 通过简单的方法制备出一类吡唑基镁卤化物的四氢呋喃溶液作为新型可充镁电池电解液,运用循环伏安、充放电测试对该类电解液中镁可逆沉积-溶出性能和阳极氧化分解电位进行了系统的测试,研究表明该电解液体系在非惰性电极上具有较高的阳极氧化分解电位,可逆、稳定的镁沉积-溶出过程,有希望应用于可充镁电池中. (1) Zhao,Q.S.;NuLi,Y.N.;Guo,Y.S.;Yang,J.;Wang,J.L.Process.Chem.2011,23(8),1599.[赵青松,努丽燕娜,郭永胜,杨 军,王久林.化学进展,2011,23(8),1599.] (2) Zheng,Y.P.;Nuli,Y.N.;Yang,J.;Chen,Q.;Wang,J.L.Chem.Ind.Eng.Prog.2011,30(5),1025.[郑育培,努丽燕娜,杨 军,陈 强,王久林.化工进展,2011,30(5),1025.] (3) Genders,J.D.;Pletcher,D.J.Electroanal.Chem.Interfa.Electrochem.1986,199,93.doi:10.1016/0022-0728(86)87044-9 (4) Liebenow,C.J.J.Appl.Electrochem.1997,27,221.doi:10.1023/A:1018464210084 (5) Lu,Z.;Schechter,A.;Moshkovich,M.;Aurbach,D.J.Electroanal.Chem.1999,466,203.doi:10.1016/S0022-0728(99)00146-1 (6)Aurbach,D.;Moshkovich,M.;Schechter,A.;Turgeman,R.Electrochem.Solid-State Lett.2000,3,31. (7) Muldoon,J.;Bucur,C.B.;Oliver,A.G.;Sugimoto,T.;Matsui,M.;Kim,H.S.;Allred,G.D.;Zajicek,J.;Kotani,Y.Energy Environ.Sci.2012,5,5941.doi:10.1039/c2ee03029b (8) Gregory,T.D.;Hoffman,R.J.;Winterton,R.C.J.Electrochem.Soc.1990,137,775.doi:10.1149/1.2086553 (9) Liebenow,C.;Yang,Z.;Lobitz,P.Electrochem.Commun.2000,2,641.doi:10.1016/S1388-2481(00)00094-1 (10) Mizrahi,O.;Amir,N.;Pollak,E.;Chusid,O.;Marks,V.;Gottlieb,H.;Larush,L.;Zinigrad,E.;Aurbach,D.J.Electrochem.Soc.2008,155,A103. (11)Aurbach,D.;Lu,Z.;Schechter,A.;Gofer,Y.;Gizbar,H.;Turgeman,R.;Cohen,Y.;Moshkovich,M.;Levi,E.Nature2000,407,724.doi:10.1038/35037553 (12)Aurbach,D.;Schechter,A.;Moshkovich,M.;Cohen,Y.J.Electrochem.Soc.2001,148,A1004. (13)Aurbach,D.;Gizbar,H.;Schechter,A.;Chusid,O.;Gottlieb,H.E.;Gofer,Y.;Goldberg,I.J.Electrochem.Soc.2002,149,A115. (14) Gizbar,H.;Vestfrid,Y.;Chusid,O.;Gofer,Y.;Gottlieb,H.E.;Marks,V.;Aurbach,D.Organometallics2004,23,3826.doi:10.1021/om049949a (15) Vestfried,Y.;Chusid,O.;Gofer,Y.;Aped,P.;Aurbach,D.Organometallics2007,26,3130.doi:10.1021/om061076s (16)Pour,N.;Gofer,Y.;Major,D.T.;Aurbach,D.J.Am.Chem.Soc.2011,133,6270.doi:10.1021/ja1098512 (17) Muldoon,J.;Bucur,C.B.;Oliver,A.G.;Sugimoto,T.;Matsui,M.;Kim,H.S.;Allred,G.D.;Zajicekb,J.;Kotanie,Y.Energy Environ Sci.2012,5,5941.doi:10.1039/c2ee03029b (18) Guo,Y.S.;Zhang,F.;Yang,J.;Wang,F.F.;NuLi,Y.N.;Hirano,S.I.Energy Environ.Sci.2012,5,9100.doi:10.1039/c2ee22509c (19) Wang,F.F.;Guo,Y.S.;Yang,J.;NuLi,Y.N.;Hirano,S.I.Chem.Commun.2012,48,10763.doi:10.1039/c2cc35857c (20) Bian,P.W.;Nuli,Y.N.;Zainapuguli;Yang,J.;Wang,J.L.Acta Phys.-Chim.Sin.2014,30(2),311.[卞沛文,努丽燕娜,再娜甫古丽,杨 军,王久林.物理化学学报,2014,30(2),311.]doi:10.3866/PKU.WHXB201312201 (21)Zhao,Q.S.;NuLi,Y.N.;Guo,Y.S.;Yang,J.;Wang,J.L.Electrochim.Acta2011,56,6530.doi:10.1016/j.electacta.2011.04.114 (22) Feng,Z.Z.;NuLi,Y.N.;Wang,J.L.;Yang,J.J.Electrochem.Soc.2006,153,C689.2 实验部分
2.1 试剂与仪器
2.2 实验方法
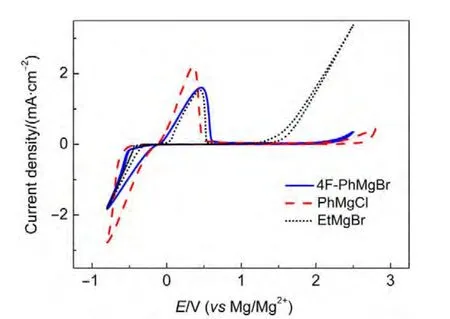
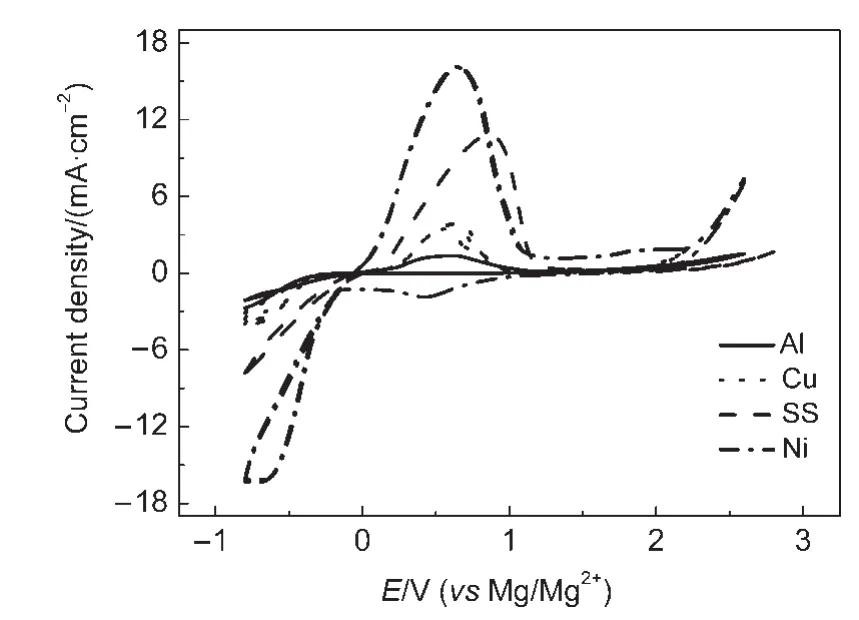
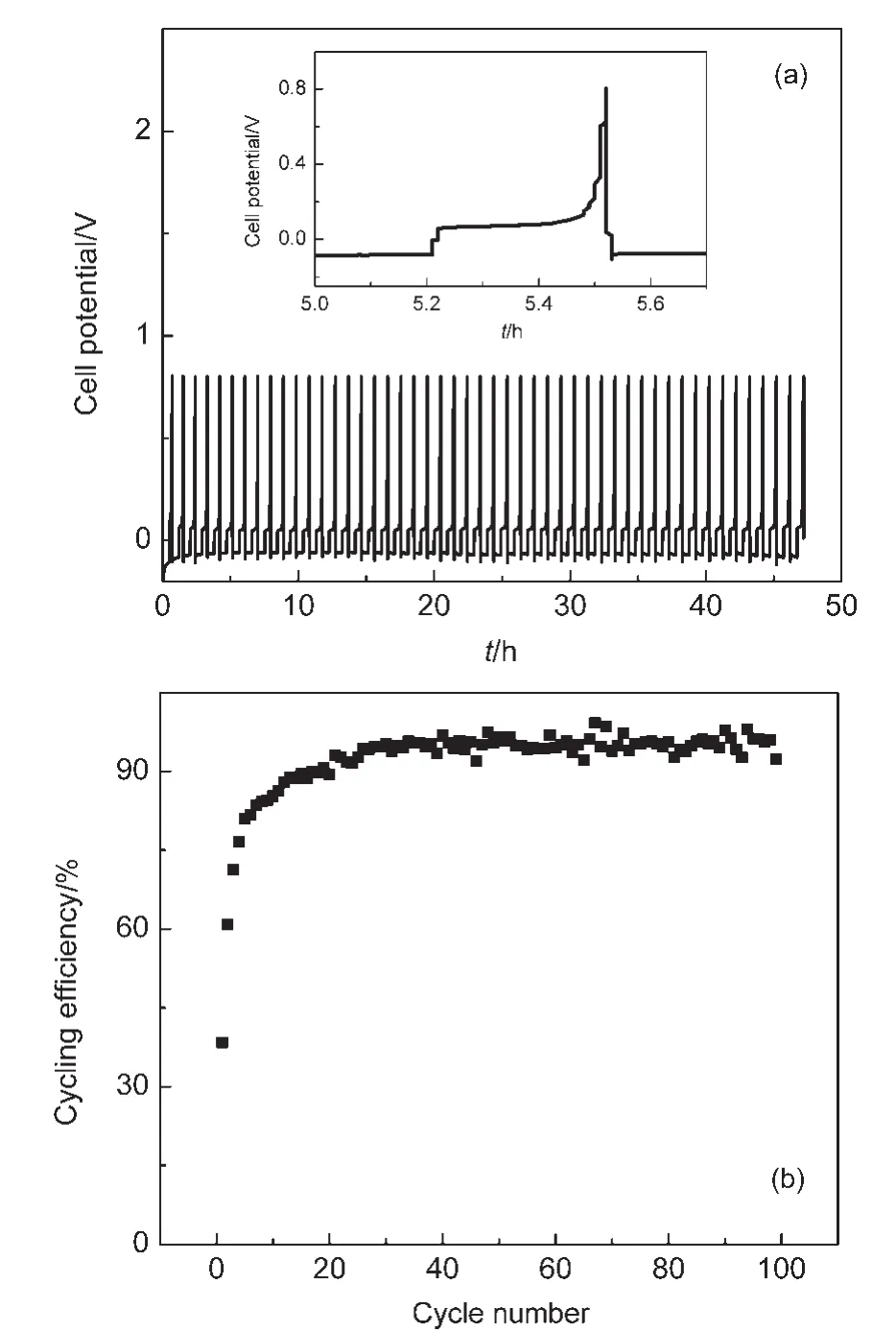
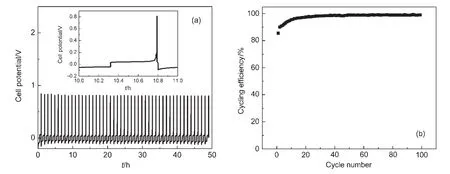
3 结果与讨论


4 结论

