谷朊粉酶解条件优化及其抗氧化活性
王章存 原 媛 王许东 赵学伟 安广杰 王 颖
(郑州轻工业学院 食品与生物工程学院1,郑州 450000)
(郑州新威营养技术有限公司2,郑州 450000)
谷朊粉是小麦淀粉生产的副产物,其蛋白高达80%左右。但是其含有很多疏水性氨基酸,限制其在生产上的应用。目前提高植物蛋白功能及营养性质应用的主要方法是酶解法[1]。蛋白质被酶水解可导致分子链内外功能结构的重排,一些原先包埋在分子链内部的功能基团暴露出来,蛋白酶进一步剪切从而释放出具有一定生物学功能的肽段[2]。生物活性肽通常由3~20个氨基酸组成,具有很多生物功能,如参与细胞免疫,降血压,促进矿物质吸收以及抗血栓等。而且,生物活性肽的功能是和其氨基酸的组成及其序列密不可分的[3]。由于化学合成抗氧化剂对人体存在潜在的危害,目前越来越多的人开始关注天然的抗氧化剂,如大豆蛋白、酪蛋白、鱼蛋白[4-6]等酶解物制备抗氧化活性肽的研究已有较多文献报道。关于谷朊粉酶解物生物活性也有一些研究。Kong等[7]用胃蛋白酶水解谷朊粉,研究结果表明,分子质量<3 000 u谷朊粉酶解物表现出了良好的抗氧化活性。Wang等[8]对谷朊粉木瓜酶水解物进行了研究,发现其也具有较好抗氧化活性。这些研究结果表明,谷朊粉酶解物具有一定的抗氧化活性,且不同酶种类和不同酶解条件制备的酶解物抗氧化活性也有较大的差异。
在前人研究的基础上,采用单酶(碱性蛋白酶)和双酶(碱性蛋白酶+风味酶)2种方法对谷朊粉进行酶解,通过正交试验优化了酶解条件,并对比分析了2种水解物的抗氧化活性、分子质量及氨基酸组成的差异,从而为谷朊粉酶解物制备抗氧化活性肽提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
谷朊粉(粗蛋白80.2%):河南省莲花味精有限公司。
碱性蛋白酶(Alcalase 2.4 L,酶活力2.4 AU/g)、风味酶(Flavourzyme 500 MG,酶活力500 LAPU/g):丹麦诺维信酶制剂公司;1,1-二苯基-2-三硝基苯肼(DPPH·):美国Sigma公司。其他化学试剂均为分析纯。
TDA型电子恒温水浴锅:北京永光明医疗仪器厂;Sartorius普及型pH计(PB-10):赛多利斯科学仪器有限公司;UV 8100 B紫外可见分光光度计:北京莱伯泰科仪器有限公司。
1.2 试验方法
1.2.1 谷朊粉酶解物的制备
准确称取一定量的谷朊粉,使其均匀分散于500 mL蒸馏水中,配置成一定浓度的悬浮液,并加热到所需温度,用1.0 mol/L NaOH调节到所需的pH值。在搅拌条件下加入适量的酶(单酶:Alcalase 2.4 L;双酶:Alcalase 2.4 L+Flavourzyme 500 MG,双酶按1∶1加入,总量和单酶相等),开始计时,反应过程中用1.0 mol/L的NaOH维持体系pH恒定。反应结束后,置于沸水浴灭酶5 min,之后取出冷却至室温,2 000 r/min离心10 min,上清液冷冻干燥得所需酶解物,并计量其质量。用凯氏定氮法测定酶解物的总氮量,其与初始酶解样品中总氮量的比值(%)即为该酶解样品的溶解性。
1.2.2 酶解条件的优化
以溶解性为指标,分别考察底物浓度、加酶量、酶解时间3个因素对溶解性的影响,在单因素试验的基础上,进行正交优化设计与分析。
1.2.3 酶解物溶解性的测定
酶解物用凯氏定氮法测定其含氮量,其与初始酶解样品含氮量的比值(%)即为该酶解物的溶解性,也即产品得率。
1.2.3 抗氧化活性的测定
1.2.3.1 还原力测定[9]
将谷朊粉酶解物用pH 6.6磷酸盐缓冲液稀释成不同浓度,各取1 mL,分别加入2.5 mL pH 6.6的磷酸盐缓冲液,2.5 mL 1%铁氰化钾,混合,50℃恒温2 0 min。再加入2.5 mL 10%三氯乙酸,然后3 000 r/min离心10 min。取上层清液加蒸馏水2.5 mL和0.1%FeCl30.5 mL,常温反应 5 min,700 nm处测定样品吸光度值。用VC做对照。
1.2.3.2 DPPH自由基清除率测定[10]
将谷朊粉酶解物稀释成不同浓度,各取2 mL于试管中,再加入2 mL 0.04 mg/mL的DPPH·溶液,混合均匀,反应20 min。然后3 500 r/min离心10 min。取上清液在517 nm处测其吸光值为A1;另各取2 mL上述浓度的酶解物于试管中,分别加入无水乙醇2 mL,反应20min。然后3 500 r/min离心10min,取上清液在517 nm处测其吸光值为A2。测2 mL 0.04 mg/mL DPPH·和2 mL无水乙醇混合液的吸光值,记为A0。用VC做对照。DPPH·清除率计算公式:

1.2.3.3 超氧阴离子清除率测定[11]
将谷朊粉酶解物稀释成不同浓度,各取0.5 mL于试管中,然后每支试管加入3 mL Tris-HCl缓冲液(pH 8.2),水浴 20 min。再加入0.3 mL 7 mmol/L邻苯三酚,反应4 min,然后各加入100μL,10 mol/L盐酸终止反应,420 nm测吸光值。
超氧阴离子自由基抑制率 =[1-(A2-A1)/A0]×100%
式中:A1为对照组的吸光度;A2为加样品组的吸光度;A0为加样品组在t=0时刻的吸光度。
1.2.3.4 羟自由基清除率测定[12]
将谷朊粉酶解物稀释成不同浓度,各取2 mL于试管中,依次加入 2 mL 6 mmol/L的 FeSO4、2 mL 6 mmol/L的 H2O2,混匀后静置10 min。再加入2 mL 6 mmol/L水杨酸,混匀,静置30 min。在510 nm处测其吸光值记为Ai。用重蒸水代替水杨酸测得的吸光值记为Aj。空白对照组以蒸馏水代替谷朊粉水解物测得的吸光值记为A空白。VC做对照。羟自由基清除率计算如下:

1.2.4 分子质量分布
采用高效液相色谱(HPLC)法测定。分析条件:色谱柱为 TSKgel G2000SWXL(7.8 mm×300 mm);流动相为乙腈∶水∶三氟乙酸(TFA)=45∶55∶0.1;检测波长215 nm;上样量10μL;流速1mL/min;柱温30℃。细胞色素 C(12 500)、抑肽酶(6 500)、杆菌肽(1 450)、乙胺酰氨-乙胺酰氨-精氨酸(451)、乙胺酰氨-乙胺酰氨-乙氨酸(189)为标准品做标准曲线,根据保留时间和分子质量的回归方程计算酶解物的分子质量。
1.2.5 氨基酸分析
采用反相高效液相色谱(RP-HPLC)法分析。DNFB试剂柱前衍生,检测波长360 nm,上样量15μL。
1.2.6 数据处理
应用SPSS软件对数据进行处理。
2 结果和讨论
2.1 酶解条件的单因素试验
2.1.1 底物浓度对溶解性的影响
当加酶量0.4%,酶解时间90 min,酶解温度45℃,pH 8.0时,不同底物浓度对酶解物溶解性的影响如图1所示。随着底物浓度的增加,单酶和双酶水解物的溶解性都呈现先增加后降低的趋势。这可能是由于随着浓度的增加,酶和底物可以充分接触,从而加速反应的进行,而当底物浓度过高时,底物不能被酶充分水解,反而降低了酶解效率,使得其溶解性下降。当底物浓度为8%时,单酶和双酶水解物的溶解性最高,分别达到了57.34%和79.46%。因此,确定酶解的底物浓度为8%。

图1 底物浓度对溶解性的影响
2.1.2 加酶量对溶解性的影响
当底物质量浓度为8 mg/mL,酶解时间90 min,酶解温度45℃,pH 8.0时,加酶量对酶解物溶解性的影响如图2。随着加酶量的增加,酶解物溶解性均有明显的增加,当加酶量达到0.6%时,单酶和双酶水解物的溶解性分别达到了58.36%和80.15%,之后随着加酶量的增加,其溶解性增加幅度很小。这可能是由于当加酶量达到了一定水平之后,大部分大分子蛋白已经水解为了小分子肽,之后再增加酶量,其与蛋白发生作用的几率较小,因此溶解性基本保持不变。SPSS软件分析结果表明,加酶量0.2%~1.0%范围内,单酶和双酶水解物的溶解性均具有显著差异(P<0.05)。当加酶量为1.0%时,单酶和双酶水解物的溶解性分别为61.27%和81.92%,和加酶量0.6%相比,溶解性增加幅度较小,因此,从产品的经济适用性角度考虑,确定加酶量为0.6%。

图2 加酶量对溶解性的影响
2.1.3 酶解时间对溶解性的影响
当底物质量浓度为8 mg/mL,加酶量0.6%,酶解温度45℃,pH 8.0时,酶解时间对溶解性的影响如图3。由图3可知,随着酶解时间的延长,单酶和双酶水解物的溶解性都呈现不断上升的趋势。当酶解时间达到120 min,单酶和双酶水解物的溶解性分别达到了59.08%和81.47%,之后随着时间的延长溶解性变化较小。SPSS软件分析结果表明,酶解时间60~180 min内,单双酶水解物的溶解性均表现出显著差异(P<0.05)。当酶解时间增加到180 min时,单双酶水解物的溶解性分别达到61.95%和83.02%,和酶解120 min的结果相比,溶解性增加不明显,因此,选取酶解时间为120 min。

图3 酶解时间对溶解性的影响
2.2 酶解条件的正交优化试验
根据单因素试验结果,以溶解性为指标,选取底物质量浓度、加酶量、酶解时间3个因素,各取3个水平,进行正交试验,结果见表1。

表1 正交试验条件及结果
根据正交分析结果,影响单酶水解物溶解性的因素主次顺序依次为:加酶量>酶解时间>底物质量浓度,最佳组合为:A3B2C2。影响双酶水解物溶解性的因素主次顺序为:酶解时间>底物质量浓度>加酶量,最佳组合为A3B2C3。即单酶水解的最佳条件为底物质量浓度10 mg/mL,加酶量0.6%,酶解时间120 min;双酶水解的最佳条件为底物质量浓度10 mg/mL,加酶量0.6%,酶解时间150 min。将最佳酶解条件得到的酶解物进行溶解性测定,其单酶和双酶水解物的溶解性分别达到了61.38%和82.21%,可见双酶水解物的溶解性明显高于单酶水解物。与正交表中的结果相比,溶解性达到了最高。
2.3 抗氧化活性
2.3.1 还原力
在700 nm处吸光值越大,还原力越好。图4可以看出,谷朊粉酶解物具有一定的还原力,且随着样品浓度的增加而增大。单酶水解物和双酶水解物在样品浓度达到3 mg/mL时,700 nm处的吸光值分别达到了0.81和1.01。可以看出,样品浓度对酶解物的还原力有很大的影响,双酶水解物的还原力优于单酶水解物,SPSS分析结果也显示,二者具有显著差异(P<0.05)。但在样品质量浓度0.5~3.0 mg/mL范围内,谷朊粉酶解物的还原力均低于抗坏血酸。

图4 不同酶解物的还原力
2.3.2 DPPH自由基清除率
DPPH自由基是少数在室温下能保持稳定的自由基,在517 nm处有最大吸收,其含有单一电子,当它遇到供给质子的物质如抗氧化剂时,该自由基将被清除,因此DPPH自由基常被作为基质来评估抗氧化剂的活性。图5为谷朊粉酶解物在不同浓度下DPPH自由基的清除能力。从图5可以看出,DPPH自由基的清除能力随着样品浓度的增加而增加。也就是说,酶解物的DPPH自由基清除活性与样品浓度呈现正相关。在酶解物质量浓度达到3 mg/mL时,单酶水解物和双酶水解物的DPPH自由基清除率分别达到了71.82%和85.33%,二者差异显著(P<0.05),且双酶水解物的清除活性较单酶水解物更好一些。

图5 不同酶解物DPPH自由基清除率
2.3.3 超氧阴离子清除率
超氧阴离子通过歧化以及其他反应途径可以产生过氧化氢和羟基。超氧阴离子及其衍生物能引起DNA和细胞损伤。而且,超氧阴离子在脂质过氧化中也起到了很大作用。因此,超氧阴离子的清除能力也是检查抗氧化活性的重要指标。图6表明,谷朊粉酶解物的超氧阴离子清除能力和浓度成正比。在蛋白酶解物质量浓度达到3.0 mg/m L时,单酶水解物和双酶水解物的清除率分别达到了56.83%和74.84%,SPSS分析结果表明二者具有显著差异(P<0.05)。该结果表明,谷朊粉酶解物具有一定的超氧阴离子清除活性,且双酶水解物的清除活性更高。

图6 不同酶解物超氧阴离子清除率
2.3.4 羟自由基清除活性
与其他自由基相比,羟自由基是最不稳定的自由基,它几乎可以和体内所有的物质发生反应,引起细胞损伤和疾病,如衰老、癌症等[13],因此,清除羟自由基可能是防止氧化的有效方法。图7为谷朊粉酶解物和抗坏血酸清除羟基的对照试验结果。结果显示,抗坏血酸在低浓度(0.5 mg/mL)下就表现出了很强的清除能力,清除率达到95.83%,之后随着抗坏血酸浓度的增加,清除率基本保持不变。而谷朊粉酶解物羟基的清除能力和浓度呈现相关性。单酶水解物和双酶水解物在样品质量浓度达到3 mg/mL时羟基清除率分别达到了70.82%和84.33%,SPSS结果显示,二者具有显著差异(P<0.05),该结果表明双酶水解物的羟自由基清除活性更好。

图7 不同酶解物羟自由基清除率

图8 不同酶解物的分子质量分布
2.4 分子质量分布
酶解物的分子质量图谱通过高效液相色谱法测定。图8a和图8b分别表示单酶和双酶水解物的分子质量图谱。从图8可以看出,双酶水解物中小分子质量肽的含量明显高于单酶水解物,其中分子质量<1 500 u的小分子肽(图8中 B部分)占61.63%,而该组分在单酶水解物中所占比例仅为39.76%。分子质量是反映蛋白质酶解的一个重要参数,且和酶解物的生物活性密切相关。本试验的结果表明,分子质量较小的酶解物比分子质量大的酶解物表现出更高的抗氧化活性,即抗氧化肽的功能性质很大程度受酶解物分子质量的影响。Xie等[14]从苜蓿叶蛋白酶解物中分离出了3个高抗氧化活性的肽,其分子质量平均<1 000 u。本研究结果和上述的研究结论基本一致。
2.5 氨基酸组成
氨基酸分析旨在研究氨基酸组成对酶解物抗氧化活性高低的影响。表2给出了2种酶解物的氨基酸组成。可以看出,单酶水解物和双酶水解物都富含谷氨酸、脯氨酸、苯丙氨酸、亮氨酸、组氨酸、缬氨酸和丙氨酸,且双酶水解物含有的疏水性氨基酸含量较高,其中脯氨酸、苯丙氨酸、亮氨酸、异亮氨酸和缬氨酸等疏水性氨基酸质量分数达到了33.74%。因此,谷朊粉酶解物中的这些疏水性氨基可能发挥了较重要的抗氧化活性。已有文献报道,组氨酸、酪氨酸、蛋氨酸和胱氨酸对酶解物抗氧化活性的发挥起到了一定的作用[8]。本试验酶解物的抗氧化活性研究结果,双酶水解物表现出较高的抗氧化活性,这可能和这些疏水性氨基酸含量较多有关。
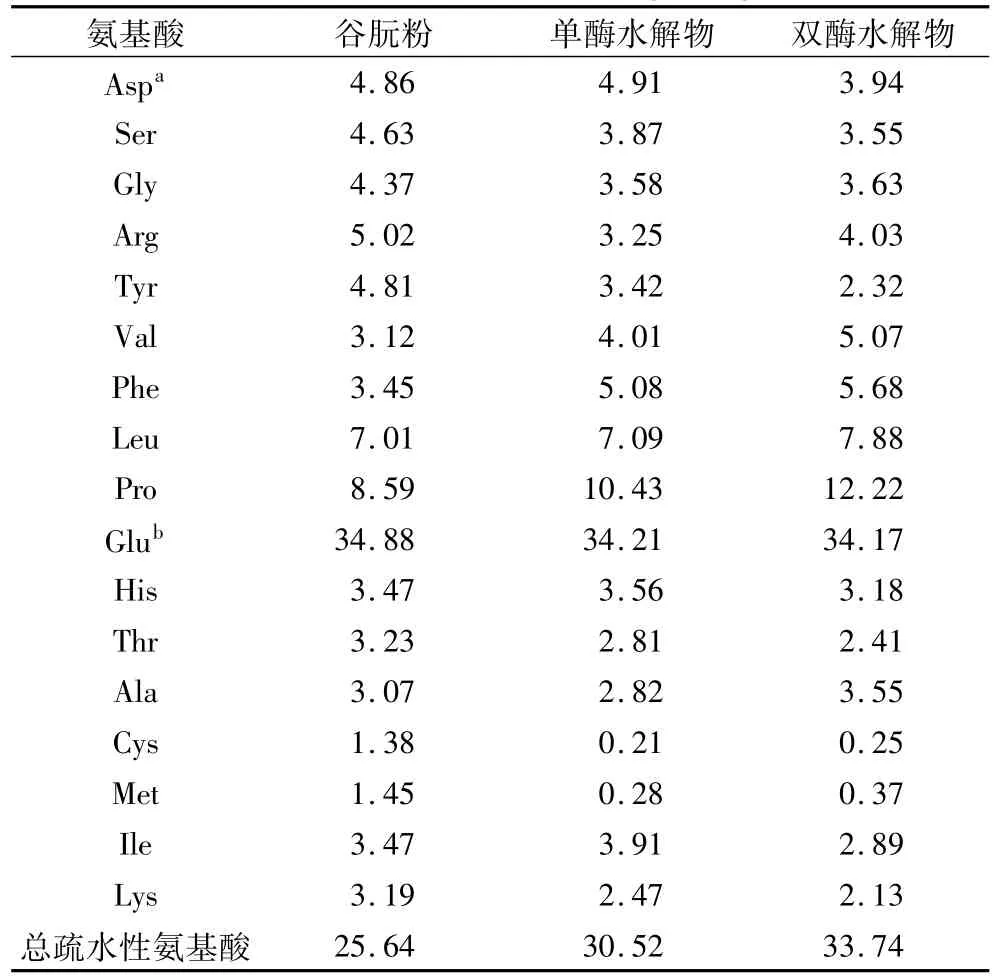
表2 不同酶解物的氨基酸组成/g/100 g蛋白
3 结论
通过不同酶解方法得到的谷朊粉酶解物溶解性试验结果表明,双酶能更有效的水解谷朊粉,其酶解物溶解性高于单酶水解物。最优酶解条件得到的单酶和双酶水解物的抗氧化活性也有一定的差异,双酶水解后的谷朊粉酶解物的还原力、DPPH自由基、超氧阴离子以及羟自由基清除率性都比单酶水解物高。双酶水解物含有更多的小分子肽和疏水性氨基酸,这些可能是双酶水解物具备较高溶解性和抗氧化活性的重要原因。结果表明,双酶水解谷朊粉更有利于制备抗氧化活性肽。
[1]柴华,赵谋明,王金水.食品蛋白质酶解改性提高功能性质的研究进展[J].食品工业科技,2008(1):286-288
[2]周世成,刘国琴,李琳,等.Protamex蛋白酶水解小麦面筋蛋白的工艺及产物抑菌作用的研究[J].河南工业大学学报,2010,31(5):13-17
[3]Pihlanto-LeppäläA.Bioactive peptides derived from bovine whey proteins:opioid and ace-inhibitory[J].Trends in Food Science&Technology,2001,11:347-356
[4]Moure A,Domı’nguez H,Parajo JC.Antioxidant properties ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J].Process Biochemistry,2006,41:447-456
[5]Siddhuraju P.The antioxidant activity and free radicalscavenging capacity of phenolics of raw and dry heated moth bean(Vigna aconitifolia)(Jacq.)Marechal seed extracts[J].Food Chemistry,2006,99:149-157
[6]Nazeer R A,Sampath Kumar N S,Jai Ganesh R.In vitro and in vivo studies on the antioxidantactivity of fish peptide isolated from the croaker(Otolithes ruber)muscle protein hydrolysate[J].Peptides,2012,35:261-268
[7]Kong X Z,Zhou H M,Hua Y F,etal.Preparation ofwheat gluten hydrolysates with high opioid activity[J].European Food Research and Technology,2008,227:511-517
[8]Wang JS,Zhao M M,Zhao Q Z,et al.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Food Chemistry,2007,101:1658-1663
[9]Yildirim A,Mavi A,Kara A A.Determination of antioxidant and antimicrobial activities of Rumex crispus L.extracts[J].Journal of Agricultural and Food Chemistry,2001,49:4083-4089
[10]曹辉,马海乐,曲文娟,等.大米蛋白的木瓜酶酶解及其水解物的抗氧化活性[J].中国粮油学报,2009,24(7):10-13
[11]张玲,黄达明.小麦面筋多肽的分离纯化及抗氧化活性测定[D].镇江:江苏大学,2010:43
[12]牛鹏飞,段玉峰,仇农学,等.玉米须中不同极性黄酮类化合物的抗氧化活性比较[J].西北农业学报,2006,15(5):72-74
[13]Zhu K X,Zhou H M,Qian H F.Antioxidant and free radical-scavenging activities ofwheatgerm protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochemistry,2006,41:1296-1302
[14]Xie Z J,Huang JR,Xu X M,etal.Antioxidantactivity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111:370-376.

