扇贝裙边糖胺聚糖对SH-SY5Y细胞氧化及凋亡影响
,,,,
(1 青岛大学医学院生物化学与分子生物学教研室,山东 青岛 266021;2 青岛大学医学院药理学教研室; 3 青岛市妇女儿童医疗保健中心检验科)
多糖是生物体内重要的生物大分子,几乎一切重要的生命活动过程都有糖的参与。随着海洋药物的兴起,对海洋多糖的活性研究已经成为目前药物研究的热点[1-2]。新近研究结果表明,多种海洋多糖具有保护多巴胺能神经元的作用[3-4]。但关于海洋贝类多糖神经保护活性的研究则鲜有报道。扇贝是一种极具开发潜力的海洋中药材[5]。扇贝裙边糖胺聚糖(SS-GAG)是从海洋贝类栉孔扇贝裙边中提取的活性成分,具有较强清除自由基、抗氧化应激作用[6-8],能抑制6-羟基多巴胺(6-OHDA)诱导的SH-SY5Y细胞线粒体膜电位的下降,具有抑制细胞凋亡的功效[9]。本研究探讨SS-GAG对SH-SY5Y细胞丙二醛(MDA)含量、乳酸脱氢酶(LDH)活性及凋亡相关基因Bax、Bcl-2、Caspase-9表达的影响,现将结果报告如下。
1 材料与方法
1.1 主要试剂
SS-GAG,由青岛大学医学院药理学教研室提供,用无血清DMEM配制成溶液;MDA试剂盒购自碧云天生物技术公司;LDH试剂盒购自宁波瑞源生物科技有限公司;RIPA细胞裂解液购自北京索莱宝生物科技有限公司;RNAiso Plus(Total RNA提取试剂)、实时荧光(real-time)PCR试剂盒购自宝生物工程(大连)有限公司;RT-PCR逆转录扩增试剂盒购自杭州博日科技有限公司;引物由上海生工生物工程技术服务有限公司合成;CaspGLOWTM活化Caspase-9荧光染色试剂盒由美国eBioscince公司提供;SH-SY5Y细胞购自中国协和医科大学基础学院细胞中心;DMEM/HIGH GLUCOSE购自Thermo Hyclone公司。
1.2 实验方法
1.2.1细胞培养及分组 SH-SY5Y细胞用含体积分数0.10胎牛血清(由杭州四季青公司提供)、含有100 kU/L青霉素和100 mg/L链霉素的DMEM/HIGH GLUCOSE培养液,在含有体积分数0.05的 CO2、37 ℃饱和湿度条件下培养。将处于对数生长期的SH-SY5Y细胞消化后,以2×109/L密度接种于6孔培养板,每孔1.5 mL。随机分为对照组(A组)、6-OHDA损伤组(B组)和用SS-GAG(200、400和800 mg/L)处理组(C、D、E组),每组设3个复孔。培养24 h,对照组和6-OHDA损伤组加入无血清培养基,SS-GAG(200、400和800 mg/L)处理组分别加入200、400和800 mg/L的 SS-GAG,24 h后,6-OHDA损伤组和SS-GAG处理组加入终浓度为100 μmol/L的6-OHDA进行损伤,对照组不做任何处理。继续培养24 h。
1.2.2MDA含量和LDH活性测定 培养结束后,刮取细胞于1.5 mL的EP管中,加入细胞裂解液裂解细胞,用酶标仪按试剂盒说明进行MDA含量检测。取20 μL细胞培养液,按LDH试剂盒说明进行操作,采用全自动生化分析仪检测LDH活性。
1.2.3细胞Bcl-2、Bax mRNA相对表达水平检测采用real-time PCR方法。用RNAiso试剂提取细胞总RNA。取1 μg总RNA,按反转录试剂盒说明合成cDNA,以cDNA为模板进行SYBR Green定量PCR扩增,GAPDH作为内参。引物分别为:Bcl-2正向5′-GGAGGATTGTGGCCTTCTTTG-3′,反向5′-GGTGCCGGTTCAGGTACTCA-3′,扩增片段长度为120 bp;Bax正向5′-CCAGCTGCCTTGGACTGTGT-3′,反向5′-GGTTTATTACCCCCTCAAGACCAC-3′,扩增片段长度为143 bp;GAPDH正向5′-TCCTCTGACTTCAACAGCGACACC-3′,反向5′-TCTCTCTTCCTCTTGTGCTCTTGG-3′,扩增片段长度为206 bp。反应体系10 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共45次循环,最后72 ℃延伸5 min。荧光值用Ct值表示,应用2-△△Ct法计算细胞Bcl-2、Bax mRNA相对表达水平。
1.2.4活化Caspase-9蛋白的表达检测 采用流式细胞技术(FCM),操作按照试剂盒说明书步骤进行,重复3次。
1.3 统计学方法
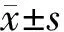
2 结 果
2.1 各组MDA含量和LDH活性比较
与对照组比较,6-OHDA损伤组细胞MDA含量及LDH活性均明显上升;与6-OHDA损伤组比较,各浓度SS-GAG组MDA含量及LDH活性水平均降低;随SS-GAG浓度增高,细胞LDH活性降低,差异均有统计学意义(F=39.014、405.261,P<0.01)。见表1。
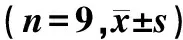
表1 各组MDA含量和LDH活性比较
2.2 各组Bcl-2和Bax mRNA相对表达水平比较
与对照组相比较,6-OHDA损伤组细胞Bcl-2 mRNA表达明显降低,Bax mRNA表达明显升高;与6-OHDA损伤组比较,各浓度SS-GAG组Bcl-2 mRNA表达升高,Bax mRNA表达降低,且呈现剂量依赖关系,差异均有显著性(F=44.881、27.699,P<0.01)。见表2。
2.3 各组活化Caspase-9表达比较
与对照组细胞相比较,6-OHDA损伤组表达活化Caspase-9蛋白的细胞数明显增多,表达未活化Caspase-9蛋白的细胞数减少;与6-OHDA损伤组比较,各浓度SS-GAG组表达活化Caspase-9蛋白的细胞数减少,表达未活化Caspase-9蛋白的细胞数增多,且呈现剂量依赖关系,差异有显著性(F=280.567,P<0.01)。见表3、图1。


组别Bcl-2BaxA组1.00 1.00 B组0.04±0.0115.94±2.34C组0.28±0.0712.60±1.42D组0.45±0.2111.20±1.85E组0.71±0.099.43±1.41
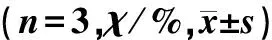
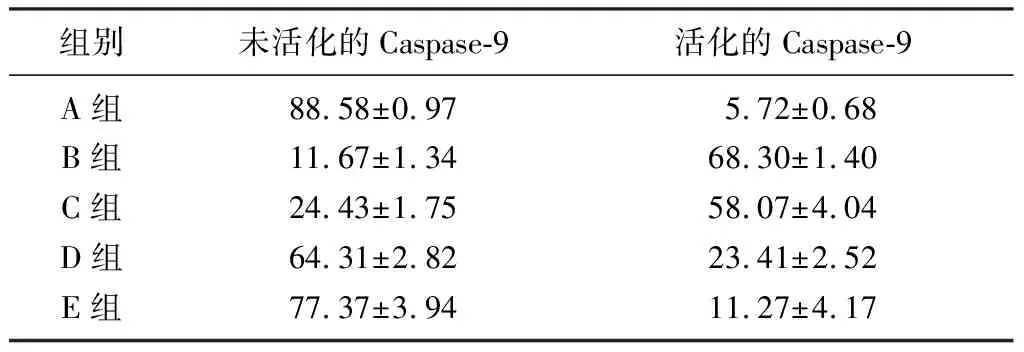
组别未活化的Caspase-9活化的Caspase-9A组88.58±0.975.72±0.68B组11.67±1.3468.30±1.40C组24.43±1.7558.07±4.04D组64.31±2.8223.41±2.52E组77.37±3.9411.27±4.17

图1 各组SH-SY5Y细胞中活化Caspase-9表达FCM检测
3 讨 论
大量研究表明,氧化应激通过多种途径引起黑质DA神经元的凋亡或死亡[10],6-OHDA可通过介导细胞内外的氧化反应产生活性氧和醌类物质,诱导单胺氧化酶产生过氧化氢及对线粒体呼吸链的直接抑制等引发氧化应激反应,最终引发DA神经元细胞凋亡[11]。
MDA是衡量细胞氧化损伤水平的重要指标。过多的氧自由基会直接攻击生物膜脂质分子中的多不饱和脂肪酸,引发脂质过氧化反应,产生代谢物MDA,其含量多少可直接反映机体脂质过氧化的程度。氧化应激导致细胞损伤时,细胞膜完整性遭到破坏,细胞通透性增加,LDH从胞质中释放出来,可通过测定培养液中LDH的活性反映细胞的完整性[12]。本实验结果显示,经6-OHDA诱导的细胞中MDA含量高于对照组,LDH的活性也明显高于对照组,而各浓度SS-GAG组MDA含量及LDH活性均降低,说明SS-GAG可抑制细胞氧化应激水平,保护生物膜的完整性。
本课题组前期研究结果表明,SS-GAG能抑制6-OHDA诱导的SH-SY5Y细胞线粒体膜电位的下降,抑制细胞凋亡。Bcl-2家族蛋白调控线粒体结构与功能的稳定性,是细胞凋亡调控基因的重要成员之一[13],抗凋亡基因 Bcl-2可通过阻滞凋亡信号途径而抑制凋亡的发生,在细胞凋亡过程中发挥重要作用[14]。Bcl-2和Bax表达的改变,能触发线粒体通透性转变孔道开放,诱导线粒体膜电位下降,促进细胞凋亡[15-16]。Caspase家族在介导细胞凋亡的过程中也起着非常重要的作用,其中Caspase-9是级联酶的上游分子,在正常状态下以无活性的酶原形式存在,当细胞发生凋亡时,线粒体向细胞质释放的细胞色素激活Caspase-9,引发Caspase级联反应,导致细胞凋亡[17-20]。本文结果显示, SS-GAG能够升高6-OHDA损伤细胞的Bcl-2 mRNA表达,降低Bax mRNA表达。本课题组前期采用半定量RT-PCR技术检测显示,SS-GAG能降低Bax mRNA的表达,但差异无统计学意义[9]。而本文采用real-time PCR技术检测显示,与6-OHDA损伤组相比较,各浓度SS-GAG组Bax mRNA表达降低,活化Caspase-9蛋白的表达同时减少。
综上所述,SS-GAG能降低6-OHDA诱导的SH-SY5Y细胞氧化应激水平,保护生物膜的完整性。通过上调Bcl-2基因的表达和下调Bax基因的表达,抑制线粒体膜电位的下降,抑制Caspase-9蛋白的活化,从而抑制6-OHDA诱导的SH-SY5Y细胞凋亡,对DA神经元具有重要的保护作用。
[参考文献]
[1]王学宏. 螺旋藻多糖抗氧化作用的实验研究[J]. 青岛医学院学报, 1999,35(4):291-292.
[2]全香花,于霞,李帅,等. 海藻色素糖蛋白制备及其对小鼠肝癌生长抑制作用[J]. 青岛大学医学院学报, 2011,47(4):296-297,300.
[3]张芳,谢俊霞. 螺旋藻多糖对MPTP致多巴胺能神经元损伤的保护[J]. 中国药理学通报, 2007,23(9):1241-1245.
[4]刘宗保,王笑峰,马忠兵,等. 刺参糖胺聚糖抗风疹病毒的初步研究[J]. 齐鲁医学杂志, 2008,23(6):507-508,511.
[5]管华诗,王曙光. 中华海洋本草[M]. 上海:上海科学技术出版社, 2009:878-890.
[6]高莹,刘赛,王海桃,等. 扇贝裙边糖胺聚糖对血管内皮细胞的抗氧化活性[J]. 中国医院药学杂志, 2007,27(6):712-714.
[7]张杰,刘赛,苏玉文,等. 扇贝糖胺聚糖对受氧化损伤的内皮细胞功能的影响[J]. 中国药学杂志, 2006,41(13):990-993.
[8]孙福生,刘赛,鞠传霞,等. 扇贝裙边糖胺聚糖对U937泡沫细胞形成过程中抗氧化酶、NO和细胞内Ca2+的影响[J]. 中国药房, 2007,18(4):256-258.
[9]王大超,侯琳,鞠传霞,等. 扇贝糖胺聚糖对六羟基多巴胺诱导SH-SY5Y细胞凋亡的保护作用[J]. 中国药理学通报, 2014,30(1):145-147.
[10]JINSMAA Y, FLORANG V R, REES J N, et al. Products of oxidative stress inhibit aldehyde oxidation and reduction pathways in dopamine catabolism yielding elevated levels of a reactive intermediate[J]. Chem Res Toxicol, 2009,22(5):835-841.
[11]AHMAD S, KHAN M B, HODA M N, et al. Neuroprotective effect of sesame seed oil in 6-hydroxydopamine induced neurotoxicity in mice model: cellular, biochemical and neurochemical evidence[J]. Neurochem Res, 2012,37(3):516-526.
[12]TROUDI A, BEN AMARA I, SAMET A M, et al. Oxidative stress induced by 2,4-phenoxyacetic acid in liver of female rats and their progeny: biochemical and histopathological studies[J]. Environ Toxicol, 2012,27(3):137-145.
[13]RONG Y, DISTELHORST C W. Bcl-2 protein family members: versatile regulators of Calcium signaling in cell survival and apoptosis[J]. Annu Rev Physiol, 2008,70:73-91.
[14]ADAMS J M, CORY S. Bcl-2-regulated apoptosis: mechanism and therapeutic potential[J]. Curr Opin Immunol, 2007,19(5):488-496.
[15]MIYASHITA T, REED J C. Tumor suppressor p53 is a direct transcriptional activator of the human bax gene[J]. Cell, 1995,80(2):293-299.
[16]KNUDSON C M, BROWN N M. Mitochondria potential, bax “activation” and programmed cell death[J]. Methods Mol Biol, 2008,414:95-108.
[17]SHERIDAN C, MARTIN S J. Mitochondrial fission/fusion dynamics and apoptosis[J]. Mitochondrion, 2010,10(6):640-648.

