环境激素17β-雌二醇分子印迹聚合物的制备及其性能
马洪超,李海普,杨兆光,徐前进,马丽
(中南大学 化学化工学院,湖南 长沙,410083)
环境激素(environmental hormones)是指由于人类的生产和生活活动而释放到周围环境中可干扰生物体内正常分泌机制的外源性化学物质[1],又称为环境荷尔蒙或者内分泌干扰物。此类物质具有类似于雌激素的作用,能干扰人体和各种生物的内分泌,从而导致生物体生殖能力下降,免疫力降低,对于人类和动物的生殖发育具有极大的危害[2]。在诸多环境激素中,17β-雌二醇被认为是最具潜在影响、作用最强烈且在水环境中普遍存在的一种环境激素[3-4]。研究人员发现其在低质量浓度下就可以造成水生生物雌性化[5-6],因此,研究更加有效的方法来分离富集水体中的17β-雌二醇显得尤为重要并具有现实意义。分子印迹技术(molecular imprinting technique)是指为获得在空间结构和结合位点上与某一分子(模板分子)完全匹配的聚合物的实验制备技术。它通过以下方法实现:(1) 首先以具有适当功能基的功能单体与模板分子结合形成单体-模板分子复合物;(2) 选择适当的交联剂将功能单体互相交联起来形成聚合物,从而使功能单体上的功能基在空间排列和空间定向上固定下来;(3) 通过一定的方法将模板分子脱去,这样,就在聚合物中留下一个与模板分子在空间结构上完全匹配并含有与模板分子专一结合功能基的三维空穴。这3 种方法制造的分子印迹聚合物(molecularly imprinting polymers,MIPs)具有高选择性地从结构类似的分子中识别模板分子的功能,MIPs 以其对模板分子具有的立体专一识别性越来越受到人们的青睐。近年来,该技术已广泛应用于目标分子的分离富集[7-9]、色谱分离[10]、痕量物质的检测[11-14]、化学与生物传感器[15-17]等方面。在分子印迹聚合物的制备过程中,功能单体和溶剂的选择尤为关键。模板分子和功能单体之间相互作用程度直接影响着分子印迹聚合物的选择性和亲和性。在功能单体和模板分子不能很好定向配位的印迹聚合物中,功能基团是任意分布的,这样就会形成大量非选择性或弱选择性的结合位点,使印迹聚合物的特定选择性降低。相反,若功能单体和模板分子的配合能力强,则能形成拥有许多高选择性结合位点的聚合物,使聚合物对模板分子的结合能力大大提高。因此,功能单体的选择对分子印迹聚合物的结合性能非常重要。此外,作为致孔剂的溶剂,其性质会影响聚合物颗粒的比表面积、形状、空穴、均一度和刚性等,从而影响分子印迹聚合物对模板分子的结合性能。国内外已经有关于17β-雌二醇分子印迹聚合物合成的报道,如:Celiz 等[18]借助17β-雌二醇分子中的羟基与羧酸基团间的作用,采用分子印迹技术,以甲基丙烯酸作为功能单体,17β-雌二醇为模板分子,乙腈为溶剂,合成了对17β-雌二醇具有选择性结合能力的分子印迹聚合物;Noir 等[19]以4-乙烯基吡啶为功能单体,乙腈为溶剂合成了17β-雌二醇分子印迹聚合物。研究结果表明,采用17β-雌二醇为模板制得的分子印迹聚合物在其富集、萃取中均可发挥优异的作用,并反映优化其分子印迹聚合物的合成、降低合成成本应是研究的重点。国内研究者也已经提出以甲基丙烯酸或者甲基丙烯酸甲酯为功能单体,乙腈、四氯化碳或氯仿为溶剂制备17β-雌二醇分子印迹聚合物[20-21]。但是,如何选择最合适的功能单体和溶剂还没有比较系统的研究方法,对以不同功能单体合成的聚合物的性能差异也没有进行详细比较。为此,本文作者借助紫外分光光度法系统研究模板分子17β-雌二醇与具有羰基基团的3 种常见单体丙烯酰胺(AM)、甲基丙烯酸(MAA)和甲基丙烯酸甲酯(MMA)之间的相互作用,以及模板分子与功能单体在3 种不同极性溶剂(乙腈、四氢呋喃、甲醇氯仿混合液)中的相互作用。进而采用分子印迹技术合成3种17β-雌二醇的分子印迹聚合物和3 种空白印迹聚合物,并运用平衡结合实验研究它们对17β-雌二醇的结合性能,以期为17β-雌二醇分子印迹聚合物的合成及应用提供可靠方法与基础数据。
1 实验
1.1 仪器和试剂
试剂为:17β-雌二醇(Sigma,分析纯即AR);雌三醇(Sigma,AR);α-甲基丙烯酸(MAA,天津市化学试剂研究所生产;AR,使用前用活性炭除去阻聚剂);丙烯酰胺(AM,三井化学株式会社生产,AR,使用前用活性炭除去阻聚剂);甲基丙烯酸甲酯(MMA,天津市科密欧化学试剂有限公司生产,AR,使用前用活性炭除去阻聚剂);偶氮二异丁腈(AIBN,天津市科密欧化学试剂有限公司生产,AR);三羟甲基丙烷三甲基丙烯酸酯(TRIM,国药集团化学试剂有限公司生产,化学纯即CP);甲醇(广东省精细化学品工程技术研究中心生产,AR);乙酸(广东省精细化学品工程技术研究中心生产,AR);乙酸乙酯(国药集团化学试剂有限公司生产,AR);甲苯(衡阳市数信化工试剂有限公司生产,AR);四氢呋喃(西陇化工股份有限公司生产,AR)。
仪器为:UV-450 型紫外分光光度计(上海棱光技术有限公司制造);ZD-85A 恒温水浴振荡器(江西省金坛市荣华仪器制造有限公司制造);Eppendorf centrifuge 5417 R 型高速冷冻离心机。
1.2 紫外光谱分析法对17β-雌二醇和不同功能单体之间的相互作用
以乙腈为参比分别扫描17β-雌二醇的乙腈溶液(0.05 mmol/L),不同功能单体(AM,MAA 和MMA)的乙腈溶液(0.5 mmol/L),以及 17β-雌二醇(0.05 mmol/L)和功能单体(0.5 mmol/L)乙腈溶液混合物的紫外吸收光谱。通过比较17β-雌二醇和不同功能单体之间的紫外吸收峰值的变化,来选择最优功能单体。
1.3 溶剂的选择
通过考察模板分子17β-雌二醇与功能单体(MMA)在3 种溶剂(乙腈、四氢呋喃和甲醇氯仿混合液(V甲醇:V氯仿=1:1)中的紫外光谱吸收曲线,以寻找最合适的溶剂。
1.4 17β-雌二醇分子印迹聚合物的合成
分子印迹聚合物(MIPs)和空白印迹聚合物(NIPs)的制备(以模板分子和功能单体摩尔比1:6 为例)过程如下:将0.25 mmol 17β-雌二醇、1.5 mmol 功能单体、3 mmol TRIM 以及0.024 63 g AIBN 加入到15 mL 乙腈溶液中,超声10 min,通氮除氧5 min。密封后转入60 ℃恒温水浴振荡器中,转速为280 r/min,24 h后离心分离得到聚合物。在索氏抽提器中用含体积分数为10%的乙酸的甲醇溶液抽提48 h,以洗脱除去模板分子,然后真空干燥。空白分子印迹聚合物的合成方法与印迹聚合物的合成方法相同,只是不加模板分子。
1.5 聚合物对模板分子17β-雌二醇的平衡结合实验
称取20.0 mg 17β-雌二醇分子印迹聚合物或空白印迹聚合物,置于100 mL 磨口锥形瓶中,分别加入3 mL 不 同 浓 度 的 17β-雌 二 醇 乙 腈 溶 液(0.2~0.7 mmol/L),放入恒温水浴振荡器中,于室温下振荡12 h。高速离心,取上清液,稀释到可测浓度范围内,用紫外分光光度计测定吸光度,并计算溶液中17β-雌二醇的浓度,根据结合前后溶液中17β-雌二醇的浓度变化可计算聚合物对17β-雌二醇的结合量Q。根据Q 作结合等温线图和Scatchard 图,对聚合物的结合性能进行评价。
1.6 聚合物对模板分子17β-雌二醇的选择性结合性能的影响
分别称取20.0 mg 分子印迹聚合物和空白印迹聚合物,置于100 mL 磨口锥形瓶中,分别加入0.4 mmol/L 的17β-雌二醇乙腈溶液1.5 mL 以及0.4 mmol/L 雌三醇乙腈溶液1.5 mL,放入恒温水浴振荡器中,12 h 后高速离心,将上清液稀释至一定的体积,用紫外分光测其吸光度,并计算溶液中17β-雌二醇以及雌三醇的浓度,根据结合前、后溶液中物质浓度变化可计算聚合物对各物质的结合量Q,以此评判聚合物的选择性结合性能。
2 结果和讨论
2.1 功能单体的选择
17β-雌二醇的分子结构式可知其分子中含有刚性的环形结构和2 个羟基,这是分子印迹聚合物合成中可以利用的作用点。考虑到羟基易于与富含电子的羰基及胺基发生氢键作用以及单体亲疏水性的差异,选择3 种常见的功能单体:甲基丙烯酸(MAA)、甲基丙烯酸甲酯(MMA)以及丙烯酰胺(AM)。它们的分子结构见图1。

图1 模板分子17β-雌二醇和功能单体的结构及电荷分布图Fig.1 Structures and charge distributions of 17β-estradiol and functional monomers
甲基丙烯酸、甲基丙烯酸甲酯以及丙烯酰胺这3种单体的亲水性依次降低,可以调节与雌二醇间的疏水作用;同时,单体中均含有1 个羰基和1 个其他基团,分别是伯胺基、羟基和醚,也可以与雌二醇的羟基作用。图1 中还显示了各单体的分子结构以及采用Materials Studio 软件中的QEq 方法得到分子中各原子电荷优化得到的电荷分布[22]。由图1 可知:单体AM中的羰基氧与胺基氮上的净电荷分别为-0.225 eV 和-0.478 eV,MAA 中的羰基氧与羟基氧的净电荷分别为-0.498 eV 和-0.691 eV,MMA 的羰基氧和醚基氧的净电荷分别为-0.526 eV 和-0.581 eV。这样的富电荷基团易于与雌二醇中缺电子的羟基氢发生氢键作用,并且电荷负电越多,作用应越强。
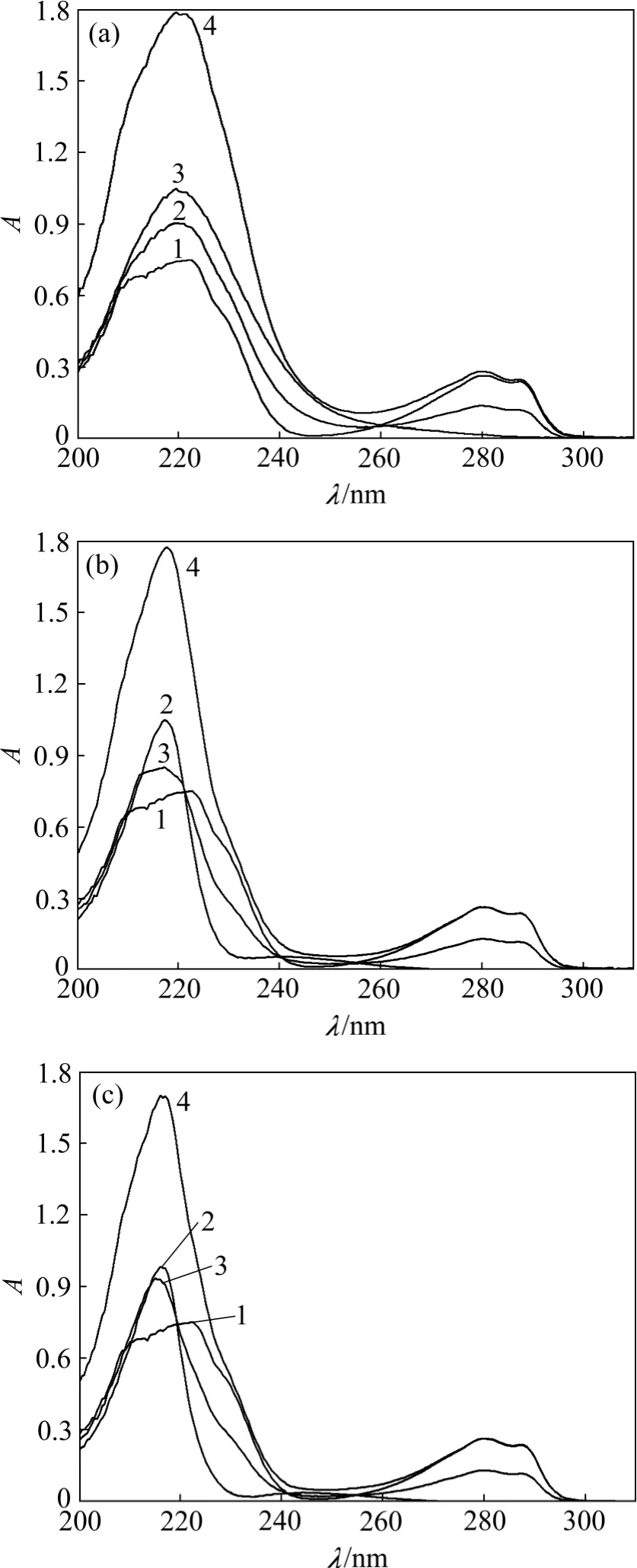
图2 17β-雌二醇和功能单体混合前后的紫外吸收光谱图Fig.2 UV spectra of sterol before and after mixed with different monomers
图2 所示为17β-雌二醇/乙腈、单体/乙腈以及雌二醇-单体混合物/乙腈体系的紫外吸收光谱图。17β-雌二醇和功能单体含有不饱和生色团(如乙烯基、羟基),当含n 电子的助色团(如—OH,—OR 和—X 等)与生色团相连时,电子发生p-π 共轭,将增强生色团的生色能力(吸收波长向长波方向移动,且吸收强度增加)。从图2(a)~(c)中曲线1 和3 对比可以看出:功能单体的加入使得光谱中的最大吸收波长均向长波长方向移动(红移),这表明17β-雌二醇和功能单体之间产生了相互作用,其中图2(c)中的移动波长较多。另外,有研究显示,曲线3 和4 的最大吸收峰值处吸光度相差越大,表明该功能单体与模板分子之间的相互作用越强[23]。图2(a)中曲线3 和4 在219.5 nm 最大吸收峰处吸光度差值为0.886,图2(b)中曲线3 和4 在216 nm最大吸收峰处的吸光度差值为0.772,而在图2(c)中曲线3 和4 在217.5 nm 最大吸收峰处吸光度的差值为0.927。与图2(a)和图2(b)相比,图2(c)中曲线3 和4最大吸收峰处的吸光度差值最大,说明MMA 与17β-雌二醇的相互作用更强。由于MMA 可以与雌二醇发生较强的氢键作用,同时与MAA 相比还具有稍强的疏水作用,因而,对合成17β-雌二醇分子印迹聚合物而言,MMA 是比MAA 和AM 更理想的功能单体。
2.2 溶剂的选择
溶剂是分子印迹聚合物合成中的另一关键因素,不仅要能溶解模板分子和功能单体等物质,而且在聚合过程中发挥致孔剂的作用,同时对模板分子与功能单体之间的非共价键作用力将产生巨大影响,因此,选择一种合适的溶剂对于制备高选择性和强结合力的分子印迹聚合物至关重要。本文同样采用紫外光谱分析法考察了模板分子17β-雌二醇与功能单体(MMA)在3 种溶剂乙腈、四氢呋喃和甲醇-氯仿混合液(V甲醇:V氯仿= 1:1)中相互作用,结果如图3 所示。
从图3 可见:在含有17β-雌二醇的3 种溶剂中逐步加入倍量的功能单体MMA 后,17β-雌二醇的最大吸收峰随单体加入量的增加而逐步红移。具体表现为在四氢呋喃溶液中,最大吸收峰从238.5 nm 移动到240.5 nm 处,仅有2 nm 的红移(见图3(a));在甲醇-氯仿混合溶剂中最大吸收峰从238 nm 红移到240 nm处,也有2 nm 的变化(见图3(b));而在乙腈溶剂中,当MMA 加入量从17β-雌二醇的3 倍体积量增加到6倍体积量时,最大吸收峰从214 nm 红移到218 nm 处,移动了4 nm(见图3(c))。
上述结果表明:模板分子17β-雌二醇与功能单体MMA 在甲醇氯仿混合溶剂以及四氢呋喃中产生的作用力均弱于其在乙腈溶剂中的相互作用,这说明乙腈是17β-雌二醇分子印迹聚合物合成过程中最适用的致孔剂。理论上的解释为:以电荷发生相互作用的非共价聚合,更容易受到溶剂(致孔剂)的影响;当溶剂自身有弱的氢键时,结合能主要受溶剂介电常数的影响。乙腈的介电常数(37.5)大于甲醇-氯仿混合液的介电常数(19.065)和四氢呋喃的介电常数(7.25),且乙腈的极性常数(6.2)也大于甲醇-氯仿混合液的极性常数(5.5)和四氢呋喃的极性常数(4.2)。在含有乙腈的活动相中,介电常数与溶剂极性之间的关系可能倾向于质子转移,会形成带电荷的离子化溶剂,随着溶剂极性的增加会使得离子以较少的能量获得消弱效应,增强模板分子和功能单体之间的相互作用。甲醇-氯仿混合液和四氢呋喃极性小,介电常数小,不易形成质子转移。可见:溶剂的种类对模板分子和功能单体之间的作用力影响很大,只有在适宜溶剂中模板分子与功能单体才能产生强的作用力,由此而获得的聚合物的结合位点选择性才能增强。
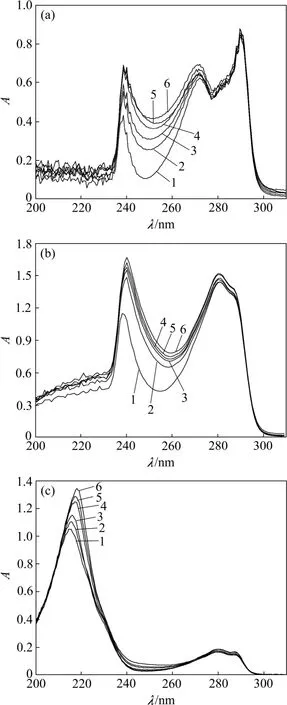
图3 不同溶剂中17β-雌二醇-MMA 混合物的紫外光谱图Fig.3 UV spectra of sterol- monomer mixture in different solvents
2.3 功能单体对印迹聚合物结合性能的影响
为了进一步比较AM,MAA 以及MMA 对分子印迹聚合物结合性能的影响,在相同条件下,分别以AM,MAA 和MMA 为功能单体合成17β-雌二醇的分子印迹聚合物和空白印迹聚合物,并考察它们对17β-雌二醇的结合性能,其结合等温线如图4 所示。

图4 MIPs 和NIPs 的结合等温线Fig.4 Binding isotherm of MIPs and NIPs
从图4(a)可以看出:随着测试浓度从0.2~0.7 mmol/L 不断增大,以AM 为功能单体合成的MIPs 对17β-雌二醇的结合量也逐渐由4.854 μmol/g 增大到12.926 μmol/g,而NIPs对17β-雌二醇的结合量由2.992 μmol/g 增大到9.042 μmol/g,但始终低于MIPs 对模板分子的结合量。同样由图4(b)和图4(c)可以看出:随着测试浓度的增大,以MAA 和MMA 合成的分子印迹聚合物和空白印迹聚合物对模板分子的结合量逐渐增大,但是,空白印迹聚合物对模板分子的结合量始终低于分子印迹聚合物对它的结合量。
分子印迹中常用Scatchard 曲线来评价聚合物对模板分子的结合性能。将不同功能单体合成的聚合物对模板分子的结合等温线进行Scatchard 分析,分析结果如图 5 所示。根据 Scatchard 方程:Q/c=(Qmax-Q)/Kd(其中Kd为结合位点的平衡离解常数,Qmax为结合位点的的最大表观结合常数,c 为浓度),由Q/c对Q 作图可得到1 条直线,从直线的斜率和截距可以计算出Kd和Qmax。计算结果见表1。
从表1 可以看出:以AM,MAA 和MMA 作为功能单体,所合成的MIPs 对模板分子的最大结合量分别为27.077,30.500 和46.050 μmol/g,而NIPs 对模板分子的最大结合量为4.856,5.044 和3.272 μmol/g。由上述结果可以看出分子印迹聚合物对模板分子的最大结合量都大于空白印迹聚合物对模板分子的最大结合量,这充分说明分子印迹聚合物在结合模板分子方面具有明显优势。另外,从表1 中还可以看出用MMA作功能单体所合成的分子印迹聚合物对17β-雌二醇表现出最大结合量,进一步证明在合成17β-雌二醇的分子印迹聚合物的过程中,与AM 和MMA 相比,MMA是更为合适的功能单体。
2.4 聚合物的选择结合性
选用模板分子17β-雌二醇和与其结构类似的雌三醇作为底物,研究利用不同功能单体合成的聚合物对底物的选择结合性能。表2 给出了各聚合物对底物的结合量。
由表2 可以看出:无论是用AM,MAA 还是MMA,作为功能单体合成的MIPs 对模板分子的结合量(分别为21.48,28.17 和40.27 μmol/g)都明显高于NIPs 对模板分子的结合量(分别为3.22,3.07 和3.14 μmol/g);而MIPs 对雌三醇的结合量(分别为15.19,17.46 和16.57 μmol/g)则明显低于其对17β-雌二醇的结合量。应该是分子印迹聚合物中既存在与17β-雌二醇结合的功能基团,又存在与17β-雌二醇的立体结构互补的特定形状孔穴,故此对模板分子具有高选择性结合能力;而空白印迹聚合物中功能基团是任意分布的,因此,对模板分子没有特异选择性。这进一步表明在分子印迹聚合物合成过程中模板分子的重要印迹效应。
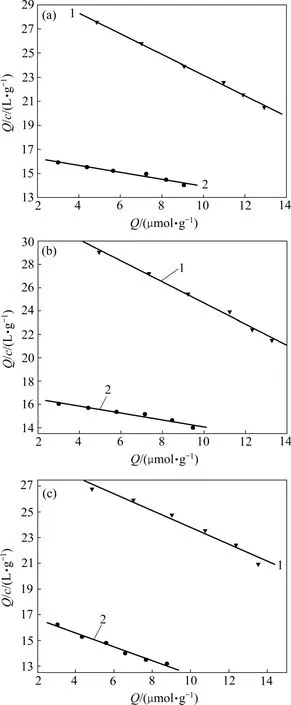
图5 评价MIPs 和NIPs 结合性质的Scatchard 图Fig.5 Scatchard plots to estimate binding nature of MIPs and NIPs
从表2 还可以看出:利用MMA 作为功能单体所合成的分子印迹聚合物对17β-雌二醇的结合量高于以AM 和MAA 为功能单体合成的分子印迹聚合物对17β-雌二醇的结合量。再次印证在合成17β-雌二醇的分子印迹聚合物时,MMA 更适合作为功能单体。
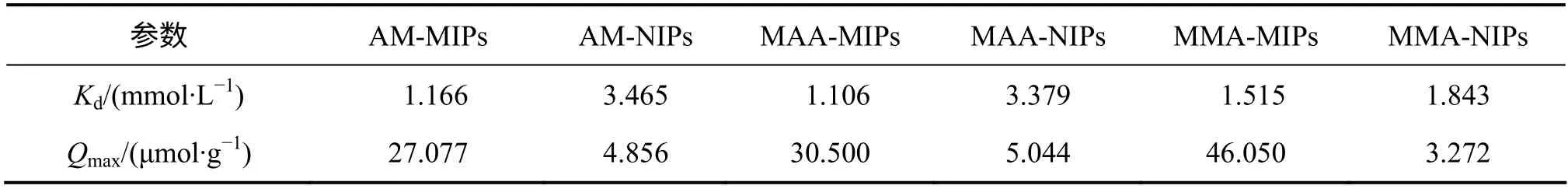
表1 不同MIPs 和NIPs 的Kd 和QmaxTable 1 Kd and Qmax of different MIPs and NIPs

表2 平衡条件下MIPs 和NIPs 对不同底物的结合量Table 2 Binding amounts of tested substrates on different MIPS and NIPs under equilibrium binding conditions μmol/g
3 结论
(1) 甲基丙烯酸甲酯分子中的氧原子上带有较多的负电荷,且具有比丙烯酰胺和甲基丙烯酸稍强的疏水性,故在17β-雌二醇分子印迹聚合物制备过程中是较理想的功能单体;乙腈与四氢呋喃和氯仿甲醇混合液相比极性较大,且介电常数较大,是17β-雌二醇分子印迹聚合物制备过程中更适宜的溶剂。
(2) 以丙烯酰胺、甲基丙烯酸和甲基丙烯酸甲酯为功能单体所制得的MIPs 较NIPs 对模板分子具有较大的结合量和良好的选择性结合性能,它们对17β-雌二醇的最大结合量分别为27.077,30.500 和46.050 μmol/g,平衡离解常数分别为1.166,1.106 和1.515 mmol/L;其中以甲基丙烯酸甲酯为功能单体所制得的MIPs 在选择性结合实验中对17β-雌二醇的结合量可达40.27 μmol/g,而对雌三醇的结合量仅为16.57 μmol/g,显示出其对模板分子的优良选择结合性能。
[1] 方改霞, 李冰冰, 陈兰英. 环境激素的危害与防治研究[J]. 环境科学与管理, 2009, 34(1): 65-67.FANG Gaixia, LI Bingbing, CHEN Lanying. Environmental harm and prevention of environmental hormones research[J].Environmental Science and Management, 2009, 34(1): 65-67.
[2] Tilghman S L, Nierth-Simpson E N, Wallace R, et al.Environmental hormones: Multiple pathways for response may lead to multiple disease outcomes[J]. Steroids, 2010, 75(8/9):520-523.
[3] Yildirim N, Long F, Gao C, et al. Aptamer-based optical biosensor for rapid and sensitive detection of 17β-estradiol in water samples[J]. Environmental Science & Technology, 2012,46(6): 3288-3294.
[4] Li Z, Dvorak B, Li X. Removing 17β-estradiol from drinking water in a biologically active carbon (BAC) reactor modified from a granular activated carbon (GAC) reactor[J]. Water Research, 2012, 46(9): 2828-2836.
[5] Butwell A J, Gardner M J, Gordon-Walker S J, et al. Scoping study for a national demonstration programme on EDC removal[M]. London: UK Water Industry Research Limited,2005: 37-56.
[6] Jobling S, Nolan M, Tyler C R, et al. Widespread sexual disruption in wild fish[J]. Environmental Science and Technology, 1998, 32(17): 2498-2506.
[7] Puoci F, Garreffa C, Iemma F, et al. Molecularly imprinted solid phase extraction for detection of sudan Ⅰ in food matrices[J].Food Chemistry, 2005, 93(2): 349-353.
[8] 胡玉玲, 朱飞, 李家威, 等. 特丁津分子印迹整体萃取棒的研制及其萃取性能[J]. 分析化学, 2009, 37(3): 466-470.HU Yuling, ZHU Fei, LI Jiawei, et al. Preparation of terbuthylazine molecularly imprinted monolithic bar and its extraction property[J]. Chinese Journal of Analytical Chemistry,2009, 37(3): 466-470.
[9] Curcio M, Puoci F, Cirillo G, et al. Selective determination of melamine in aqueous medium by molecularly imprinted solid phase extraction[J]. Journal of Agricultural and Food Chemistry,2010, 58(22): 11883-11887.
[10] QIN Lei, HE Xiwen, LI Wenyou, et al. Molecularly imprinted polymer prepared with bonded β-cyclodextrin and acrylamide on aqueous media[J]. Journal of Chromatography A, 2008,1187(1/2): 94-102.
[11] Barahona F, Turiel E, Cormack P A G, et al. Synthesis of core-shell molecularly imprinted polymer microspheres by precipitation polymerization for the inline molecularly imprinted solid-phase extraction of thiabendazole from citrus fruits and orange juice samples[J]. Journal of Separation Science, 2011,34(2): 217-224.
[12] Pereira L, Rath S. Molecularly imprinted solid-phase extraction for the determination of fenitrothion in tomatoes[J]. Analytical and Bioanalytical Chemistry, 2009, 393(3): 1063-1072.
[13] MEI Surong, WU Da, JIANG Ming, et al. Determination of trace bisphenol A in complex samples using selective molecularly imprinted solid-phase extraction coupled with capillary electrophoresis[J]. Microchemical Journal, 2011, 98(1):150-155.
[14] Moein M M, Javanbakht M, Akbari-adergani B. Molecularly imprinted polymer cartridges coupled on-line with high performance liquid chromatography for simple and rapid analysis of dextromethorphan in human plasma samples[J]. J Chromatogr B, 2011, 879(11/12): 777-782.
[15] Medina-Castillo A L, Mistlberger G, Fernanddez-Sanchez J F,et al. Novel strategy to design magnetic, molecular imprinted polymers with well-controlled structure for the application in optical sensors[J]. Macromolecules, 2010, 43(1): 55-61.
[16] 刘晓芳, 姚冰, 刘国艳, 等. 检测猪肉中地西泮的分子印迹仿生传感器的研制[J]. 分析化学, 2010, 38(5): 683-687.LIU Xiaofang, YAO Bing, LIU Guoyan, et al. Bionic sensor for detection of diazepam in meat using molecularly imprinted film[J]. Chinese Journal of Analytical Chemistry, 2010, 38(5):683-687.
[17] 马秀玲, 陈日耀, 郑曦, 等. 柚皮苷分子印迹传感器的制备与应用[J]. 分析化学, 2010, 38(1): 100-104.MA Xiuling, CHEN Riyao, ZHENG Xi, et al. Preparation and application of naringin sensor based on molecularly imprinted technique[J]. Chinese Journal of Analytical Chemistry, 2010,38(1): 100-104.
[18] Celiz M D, Aga D S, Colón L A. Evaluation of a molecularly imprinted polymer for the isolation/enrichment of β-estradiol[J].Microchemical Journal, 2009, 92(2): 174-179.
[19] Le Noir M, Lepeuple A S, Guieysse B, et al. Selective removal of 17β-estradiol at trace concentration using a molecularly imprinted polymer[J]. Water research, 2007, 41(12): 2825-2831.
[20] 汤坚, 朱秋劲, 顾小红. 一种17β-雌二醇分子印迹聚合物的制备方法及应用: 中国, 200710026142.5[P]. 2007-08-16.TANG Jian, ZHU Qiujin, GU Xiaohong. Preparation method and application of 17β-estradiol molecularly imprinted polymers:China, 200710026142.5[P]. 2007-08-16.
[21] 胡小钟, 王鹏, 林雁飞. 一种雌二醇分子印迹聚合物的制备方法: 中国, 200710053694.5[P]. 2007-10-30.HU Xiaozhong, WANG Peng, LIN Yanfei. Preparation method of estradiol molecularly imprinted polymers: China,200710053694.5[P]. 2007-10-30.
[22] Trogus F J, Schechter R S, Pope G A, et al. Adsorption of mixed surfactant systems[J]. Society of Petroleum Engineers, 1979,31(6): 769-778.
[23] 卢春阳, 何海成, 马向霞, 等. 除草剂靑莠定分子印迹聚合物的合成及结合性能研究[J]. 化学合成, 2004, 62(8): 799-803.LU Chunyang, HE Haicheng, MA Xiangxia, et al. Preparation and evaluation of molecularly imprinted polymers using herbicide picloram as template[J]. Acta Chimica Scnica, 2004,62(8): 799-803.

