过渡金属铁酸盐纳米球的电化学性能
冯慧芬,卢周广, ,杨幼平,古映莹,胡菁,周科朝
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
锂离子电池具有电压高、能量密度大和自放电小[1]等优点而成为目前最具有发展前途的高能二次电池。随着锂离子电池在电动汽车和混合动力汽车中的应用,开发出具有更高容量及更高倍率性能的电极材料成为发展的关键。过渡金属氧化物可以降低其金属态然后再被氧化,因此可以提供高容量和好的循环性能[2]。但长期以来,研究大多集中在一元氧化物的锂离子存储机理和锂电池性能方面,对铁基二元氧化物MFe2O4的研究较少[3]。铁基二元氧化物MFe2O4一般为尖晶石型结构,这些化合物类似于混合氧化物,其脱嵌机理与混合氧化物的嵌锂机理类似,作为锂离子电池负极材料具有较好的电化学性能[4]。商业化石墨碳负极材料具有良好的循环性能,但比容量(372 mA·h/g)较低,不能满足高比能量电池的发展要求,迫切需要进行新型高容量负极材料的研究。过渡金属氧化物在首次充电过程中会发生还原分解反应,形成了纳米尺度的活性金属,虽然在一定程度上有效地提高了其循环性能,但是金属和金属氧化物在循环过程中体积膨胀严重,容易造成“粉化”问题[5]。碳包覆纳米过渡金属氧化物能很好地将纳米金属氧化物颗粒固定在内核中,防止金属氧化物在充放电过程中发生体积膨胀,可以得到比较优越的循环性能。溶剂热法是合成纳米材料的一种重要方法,其特点是制备过程在较低的温度、较高的压力下一次完成,无需后期晶化处理,所得粉体粒径小,且分布均匀、成分纯净、晶型完整,可以满足各种高技术应用的要求[6],且比固相反应节约能源,符合环保要求。本文作者以无机盐为前驱体,乙二醇为还原剂和溶剂,醋酸钠为静电剂,聚乙二醇为分散剂,通过溶剂热还原法制备出350~500 nm 的二元球形过渡金属氧化物,对其进行碳包覆。将其作为锂离子电池负极材料,组装电池进行电化学性能测试。
1 实验
1.1 材料的制备
称取5 mmol FeCl3·6H2O 和2.5 mmol 氯化盐溶解在40 mL 乙二醇形成澄清溶液,再加入3.6 g 醋酸钠和1.0 g 聚乙二醇4 000。搅拌1 h 后密封在50 mL 水热反应釜中,加热至180 ℃时保温8 h,然后冷却到室温,离心分离,用乙醇和蒸馏水洗涤产品数次,于80 ℃干燥24 h。
1.2 碳包覆合成
称取产物质量20%的葡萄糖,加一定量水和乙醇使其充分溶解,搅拌均匀后加入前驱体,碾磨均匀。干燥后将所得样品在惰性气体(99.9%Ar 氛围)下,于450 ℃煅烧6 h,得到碳包覆的材料。
1.3 材料的表征
采用德国Bruker D8 型X 线衍射仪,对样品进行X 线衍射分析,Cu Kα1辐射(λ=0.154 056 nm),扫描范围为10°~80°,扫描速度为0.02 (°)/s;采用FEI Nova 230 Nano 型扫描电子显微镜(SEM)分析产品的形貌以及粒径;采用法国Jobin Yvon LabRAM 公司生产的HR800 UV 微拉曼光谱仪对样品的碳包覆效果进行分析。
1.4 电池组装和电化学表征
将制得的样品、导电炭黑和黏结剂聚偏氟乙烯(PVDF)按质量比7:2:1 混合研磨均匀后,加入适量溶剂N-甲基吡咯烷酮(NMP),研磨成浆均匀涂覆在铜箔上,制得极片先于60 ℃常压干燥8 h,再于90 ℃真空干燥12 h。对电极采用光亮锂箔,电解质为含l mol/L LiPF6的EC+DEC(体积比为1:1),隔膜为聚丙烯薄膜,在充满氩气的手套箱内组装成2032 型扣式电池。采用武汉蓝电电子有限公司生产的蓝电测试系统在电压窗口0.01~3.0 V 范围内对其进行充放电测试。
2 结果与讨论
2.1 XRD 结果分析
图1(a)所示为水热合成得到不同过渡金属铁酸盐的XRD 结果。对比标准卡片可以看出:图1(a)中除了2θ=18.4°,30.1°,35.4°,37.2°,43.1°,53.4°,57.0°,62.6°对应于尖晶石结构的(111),(220),(311),(222),(400),(422),(511)和(440)等衍射峰外,无其他杂峰,说明制备出的Fe3O4,ZnFe2O4,CoFe2O4和MgFe2O4样品的纯度很高。但Fe3O4,ZnFe2O4和MgFe2O4的特征峰较CoFe2O4的特征峰尖锐,说明其结晶度较CoFe2O4的好。
对ZnFe2O4和CoFe2O4样品进行碳包覆,图1(b)所示为碳包覆后的XRD 衍射图谱。由图1(b)可见:其中的衍射峰与标准卡片一致,说明煅烧后得到的仍然是纯相的物质,但ZnFe2O4-C 的特征峰较CoFe2O4-C的特征峰尖锐,说明其结晶性较好。在图1(b)中并没有观察到晶态碳的衍射峰,说明经过高温烧结后生成的碳最终以无定形的形式存在。在10°~30°之间的特征峰较碳包覆之前的尖锐,这也是由于无定形碳的存在造成的[7]。
2.2 SEM 结果分析
图2 所示为不同铁酸盐纳米球的SEM 图。由图2可以看出:所合成的样品均为形貌规整、表面光滑的纳米微球,且颗粒粒径均匀,分散性较好;Fe3O4,ZnFe2O4,CoFe2O4和MgFe2O4的粒径分别为450,450,350 和500 nm。球形结构的电极材料具有许多优点,比如高的振实密度,良好的电接触以及大的电化学反应活性界面,电解液和电极材料之间的接触面积较大,便于锂离子的运输[8-10]等,从而表现出良好的循环稳定性。另外,纳米级的球形结构可以提供较大的比表面积,这也是制得的样品的首次充放电容量较高的原因[11]。
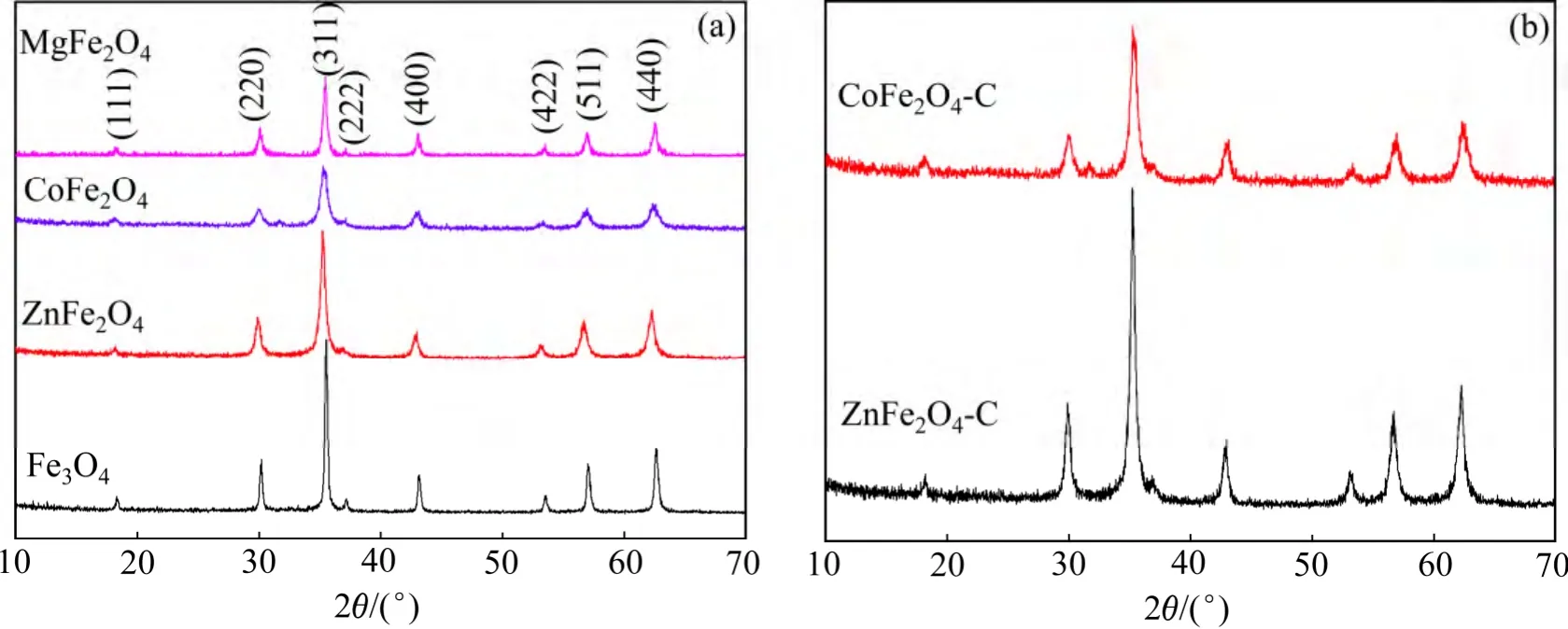
图1 所制备过渡金属铁酸盐包覆碳前后的X 线衍射图Fig.1 XRD patterns of different transition metal ferrite nanospheres before and after carbon coating

图2 不同铁酸盐纳米球的SEM 图Fig.2 SEM images of different ferrite nanospheres
图3 所示为ZnFe2O4和CoFe2O4样品包覆碳后的SEM 图。与包覆碳前的样品(图2)相比:包覆后的铁氧体为球形,且分散均匀,颗粒表面被碳包覆,颗粒之间由碳纤维连接。为进一步确认制备碳包覆的结果,对样品进行拉曼(Raman)光谱测量。

图3 碳包覆后ZnFe2O4 和CoFe2O4 的SEM 图Fig.3 SEM images of carbon-coated ZnFe2O4 and CoFe2O4 nanospheres
2.3 拉曼(Raman)光谱
碳包覆后ZnFe2O4和CoFe2O4的拉曼光谱图如图4 所示。由图4 可知:位于217,282,362,647 cm-1处的Raman 峰来源于ZnFe2O4,分别对应于F2g(1),Eg,F2g(2)和A1g振动[12];221,288,399,539,658 cm-1处的Raman峰来源于CoFe2O4,分别对应于T1g(3),Eg,T1g(2),T1g(1)和A1g(1)振动[13];而1372和1353 cm-1处的D峰归属于碳的A1g振动,表明其无序性;1593和1601cm-1处的G 峰则与sp2杂化的碳原子的E2g拉曼活性相关[14]。这说明碳已经包覆在铁氧体的表面,与XRD 和SEM 测试结果相符。
2.4 电化学性能
图5 所示为所合成不同过渡金属铁酸盐纳米球在0.05C 电流密度下的恒电流充放电曲线。由图5 可见:在第1 次放电过程中,所有样品从开路电压开始放电,工作电压迅速降至0.8 V,这归因于反应MFe2O4+xLi→LixMFe2O4[15-16]。在0.8 V 左右呈现一个较长且平缓的放电平台,平台区间对应的比容量为100~800 mA·h/g,这则归因于反应LixMFe2O4+(8-x)xLi→M+2Fe+4Li2O[15-16]。电压从0.8 V 降至0.01 V,这可能是因为得到的金属单质与电解质形成了凝胶膜和SEI膜[17]。在首次充电过程中,在1.4 V 左右有一个平滑的充电平台,平台区间对应的比容量为 200~700 mA·h/g,可能发生的反应是

图4 碳包覆后ZnFe2O4 和CoFe2O4 的拉曼光谱图Fig.4 Raman patterns of carbon-coated ZnFe2O4 and CoFe2O4 nanospheres
M+2Fe+Li2O= Li++MFe2O4
稳定的充放电平台表明所制备的样品可以作为候选电极的材料。Fe3O4,ZnFe2O4,CoFe2O4和MgFe2O4的首次放(充)电比容量分别约为1 200 (800),1 100(630),1 250 (850)和1 300 (950) mA·h/g,所对应的首次库仑效率分别为66.7%,57.3%,68.0%和73.1 %。首次充放电比容量有所差别可能是因为Li 离子的嵌入和脱嵌不可逆引起的。不可逆的原因可能是电解液被还原形成固态电解液界面层(SEI),电解液在材料表面和残余的氢氧根发生反应生成氧化锂以及界面Li存储等[18-19]。通过对比发现CoFe2O4和MgFe2O4具有相对较高的首次可逆容量及库仑效率。
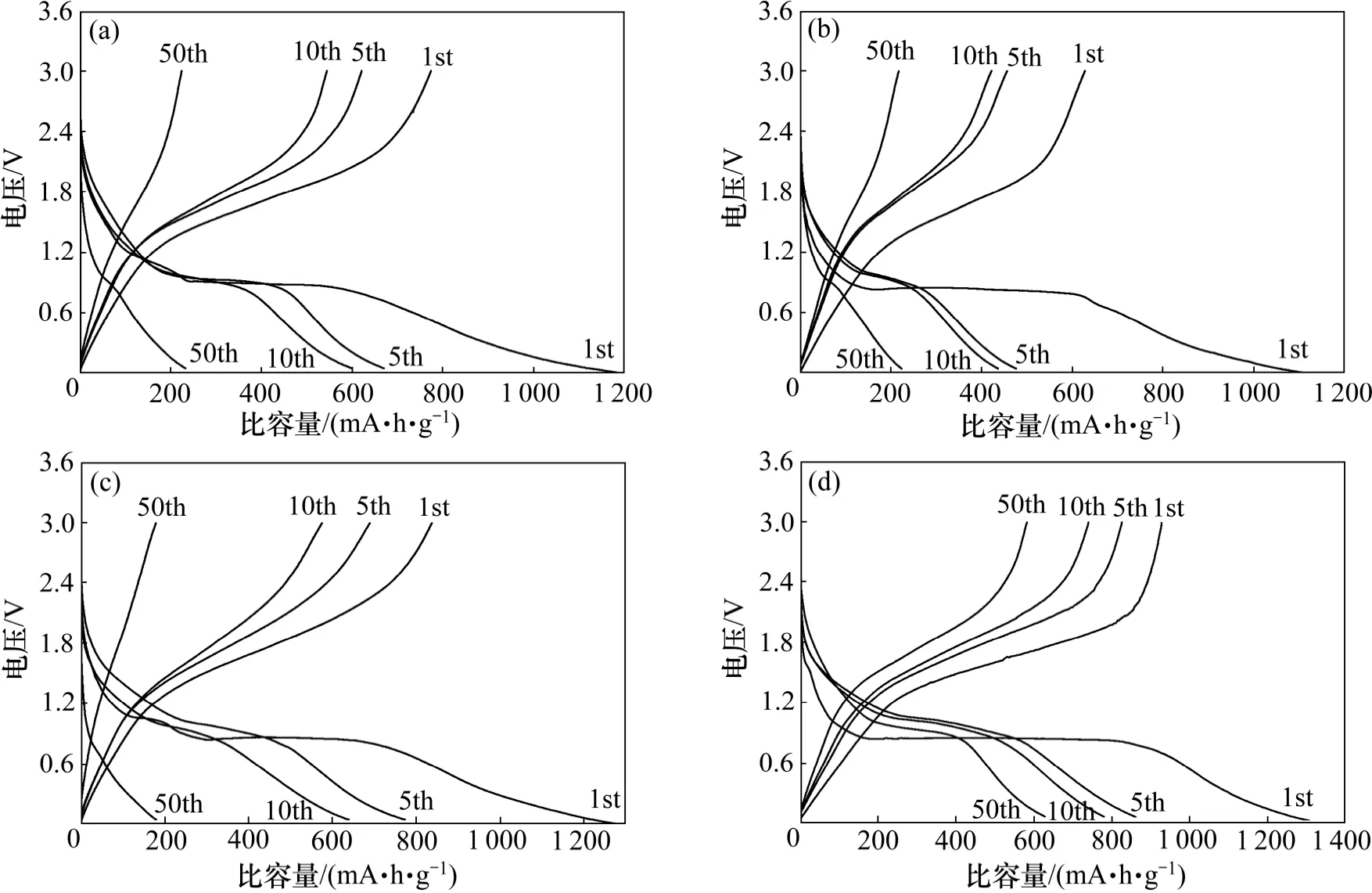
图5 所合成不同过渡金属铁酸盐纳米球在0.05C 电流密度下的充放电曲线Fig.5 Galvanostatic charge-discharge curves of as-synthesized different ferrite nanospheres at current density of 0.05C
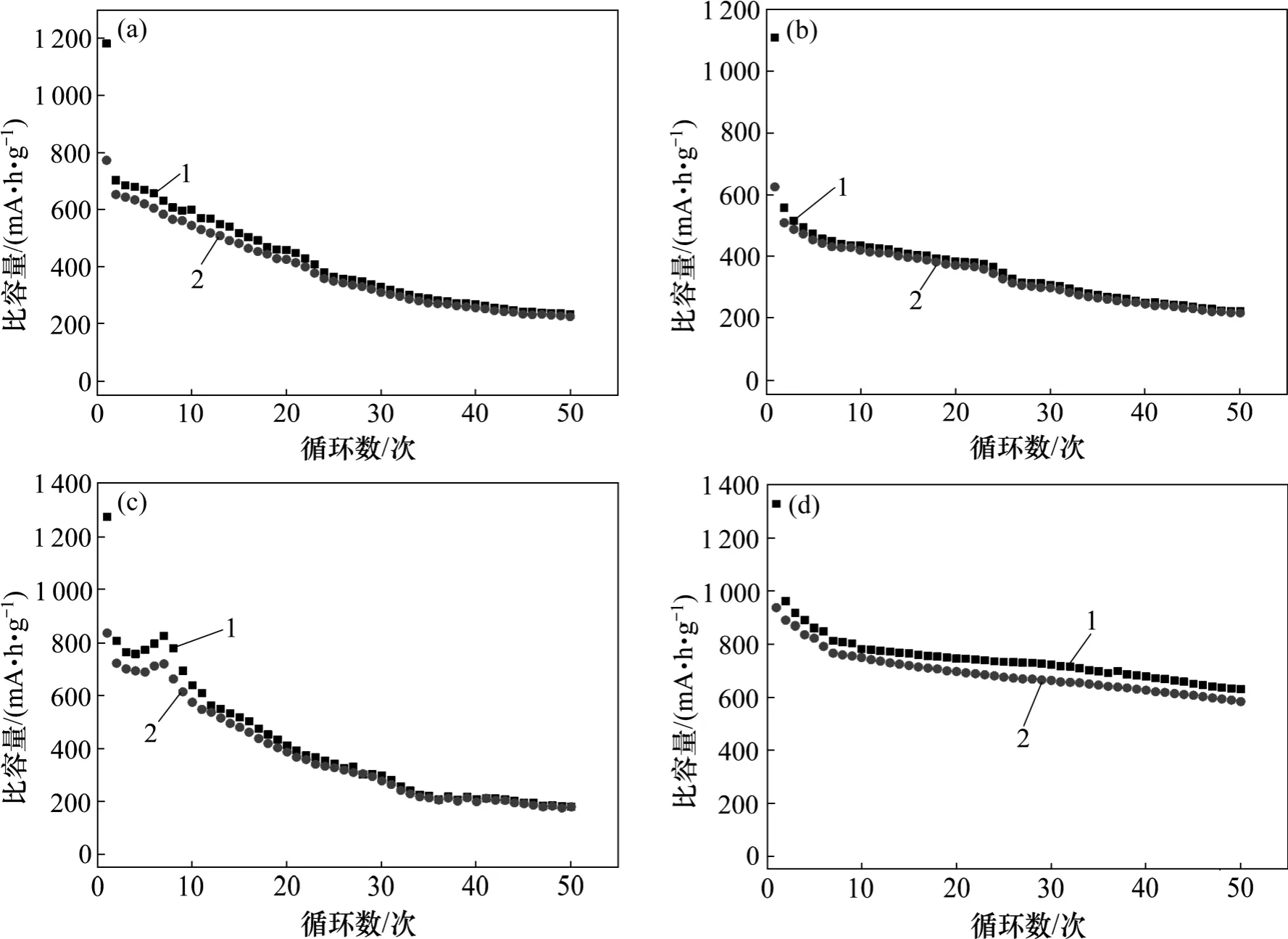
图6 所合成不同过渡金属铁酸盐纳米球在0.05C 电流密度下的循环性能Fig.6 Cycling performance of as-synthesized different ferrite nanospheres at current density of 0.05C
图6 所示为所制备的材料在0.05C 电流密度下的循环性能图。由图6 可见:Fe3O4,ZnFe2O4和CoFe2O4的循环稳定性较差,循环50 次后,其可逆充电容量的保持率分别为20%,20%和14%。而MgFe2O4相对具有较优异的循环稳定性,其循环50 次后的容量保持率接近50%。在相同的实验条件下,MgFe2O4具有较高的电化学活性和循环稳定性,这与Mg 的成分有关,Mg 成分或者Mg 掺杂可有效提高LiNixCoyMnzO2等电极材料的循环稳定性。
为了进一步分析铁氧体纳米颗粒电极充放电循环性能的差异,比较了不同倍率充放电比容量,如图7所示。从图7 可以看出:随着电流密度的增大,充放电容量逐渐下降,循环性能变差。这是由于充放电电流密度越大,Li 离子的嵌入和脱嵌越剧烈,在放电过程中形成的SEI 膜越不稳定,纳米颗粒的结构破坏越严重。但是随着循环次数的增加在每个充放电倍率下的容量都慢慢趋于稳定。通过比较发现:Fe3O4和MgFe2O4的循环性能优于ZnFe2O4和CoFe2O4的循环性能。
本实验合成的球形MgFe2O4在大倍率充放电电流密度下的循环性能很好,与其他几种纳米球相比,其比容量较高且保持较好。在2C 充放电电流下,MgFe2O4在循环50次后的充、放电比容量分别为231.4和232.1 mA·h/g。
为了解决循环性能差的问题,对 ZnFe2O4和CoFe2O4碳包覆以后进行电化学性能测试。图8 所示为在0.05C 的电流密度下ZnFe2O4和CoFe2O4碳包覆电极的充放电曲线。由图8 可见:包碳后的材料充放电曲线较为平缓,充放电平台较长,并且比容量有了很大的提高。包碳ZnFe2O4首次放电比容量高达1 654.9 mA·h/g,平台在0.8 V 附近,首次充电比容量衰减到835.1 mA·h/g,平台在1.6 V 附近,在第2 个循环以后比容量保持率较好。包碳CoFe2O4首次放电比容量为993.1 mA·h/g,平台在0.85 V 附近,首次充电量衰减到721.7 mA·h/g,平台在1.6 V 附近,从第2个循环开始稳定,有较好的比容量保持率。由此可见,碳包覆对其循环性能有较大的提高。
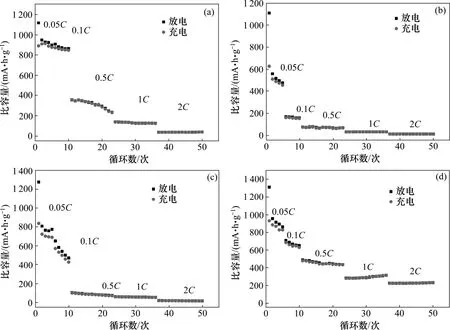
图7 所合成不同过渡金属铁酸盐纳米球的倍率性能Fig.7 Rate capability of different transition ferrite nanospheres
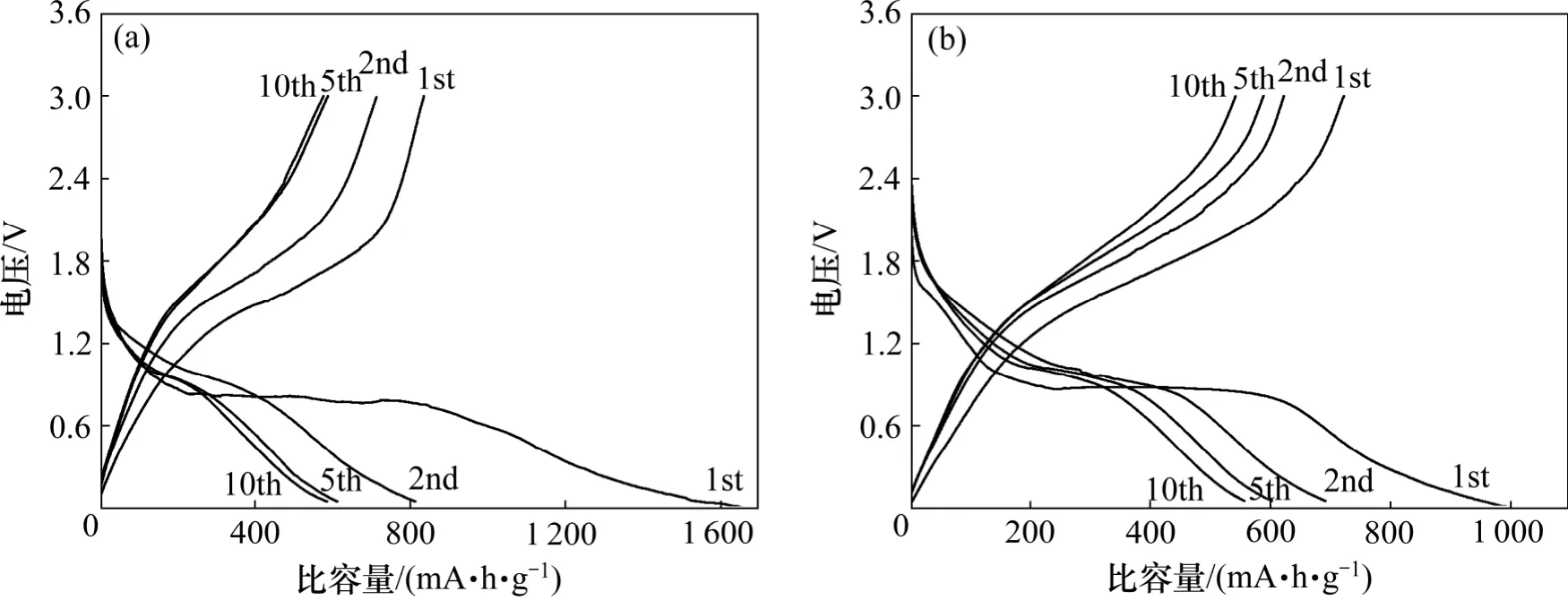
图8 ZnFe2O4-C 和CoFe2O4-C 在0.05C 电流密度下恒流充放电曲线Fig.8 Galvanostatic charge-discharge curves of ZnFe2O4-C and CoFe2O4-C at current density of 0.05C
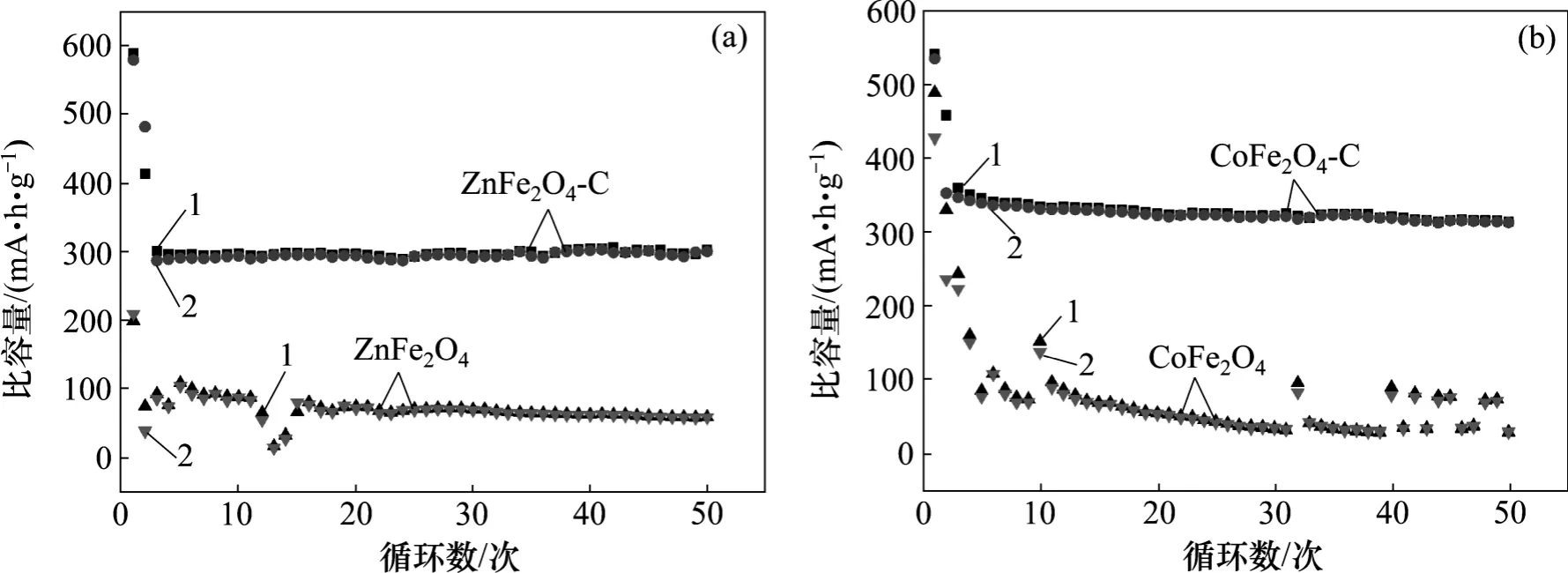
图9 0.5C 电流密度下ZnFe2O4 和CoFe2O4 碳包覆前后的恒流充放电循环性能Fig.9 Cycling performance of as-synthesized ZnFe2O4 and CoFe2O4 before and after carbon coating at current density of 0.05C
0.5C 电流密度下ZnFe2O4和CoFe2O4碳包覆前后的恒流充放电循环性能如图9 所示。由图9 可见:在0.5C 的倍率下,ZnFe2O4碳包覆前(后)的首次充放电比容量为589.1 (198.6) mA·h/g 和579.3 (208.6) mA·h/g,在循环2 次以后趋于稳定,比容量衰减越来越慢,循环50 次后,充放电比容量保持在73.0%(26.1%)和62.4%(27.6%)。CoFe2O4碳包覆前(后)的首次充放电比容量为540.4 (488.4) mA·h/g 和534.5 (427.3) mA·h/g,在循环5 次以后才趋于稳定,比容量衰减越来越慢,在循环50 次以后充放电比容量保持在68.7%(6%)和88.7%(7%)。通过对比可以看出:包覆后其电化学循环性能有很大的提高,其原因主要是过渡金属氧化物容易在充放电过程中发生体积膨胀,使已经形成的SEI 膜破裂,降低其循环性能。表面包覆的无定形碳能够防止溶剂分子与锂离子共插入,避免SEI 膜的破坏。另外,包覆层的无定形碳也有利于减缓锂离子脱/嵌过程中剧烈体积变化所造成的应力,提高其循环性能。
图10 所示为在不同倍率充放电电流密度下的测试结果。由图10 可见:碳包覆以后ZnFe2O4和CoFe2O4的循环性能有很大的提高。在高倍率充放电电流密度(2C)下,循环50 次后,ZnFe2O4充放电比容量仍然高达244.7 和209.5 mA·h/g,CoFe2O4的充放电比容量高达254.4 和208.5 mA·h/g。这是因为碳材料为导体,有利于电子的传输,可以提高材料高倍率充放电性能。但是通过比较发现:ZnFe2O4-C 比CoFe2O4-C 的比容量略高。已有的研究结果表明:Co 属于电化学惰性元素,而Zn 属于电化学活性元素[20-21],因此,ZnFe2O4中的Zn 可以与锂离子形成Li-Zn 合金,从而储存更多的锂离子,表现出更高的比容量[22]。

图10 ZnFe2O4-C 和CoFe2O4-C 倍率性能Fig.10 Rate capability of carbon-coated ZnFe2O4 and CoFe2O4
3 结论
(1) 以无机盐为前驱体,乙二醇为还原剂和溶剂,醋酸钠为静电剂,聚乙二醇为分散剂,通过溶剂热还原法制备出350~500 nm 的二元球形过渡金属铁酸盐复合氧化物MFe2O4(M=Fe, Zn, Co, Mg),以葡萄糖作为碳源进行碳包覆。并将其作为负极材料组装成电池,进行电化学性能测试。
(2) 充放电曲线较为平缓,充放电平台较长,在0.05C 的电流密度下,Fe3O4,ZnFe2O4,CoFe2O4和MgFe2O4的首次可逆比容量分别约为800, 630,850,和950 mA·h/g。在大倍率充放电电流密度(2C)下,MgFe2O4循环50 次后充、放电比容量分别为231.4 和232.1 mA·h/g,与其他几种铁氧体相比,其倍率性能较好。
(3) 碳包覆后,在2C 的高倍率放电密度下,ZnFe2O4的充放电比容量为244.7 和209.5 mA·h/g,CoFe2O4的充放电比容量为254.4 和208.5 mA·h/g,其比容量及容量保持率都有很大的提高,有望作为锂离子电池的新型负极材料。
[1] 方杰, 王志兴, 李新海, 等. 具有电容和脱嵌锂特性的锂离子电池复合负极材料性能[J]. 中南大学学报(自然科学版), 2010,41(6): 2091-2095.FANG Jie, WANG Zhixing, LI Xinhai, et al. Anode composition with capacitance and (de)lithiation for lithium ion battery[J].Journal of Central South University (Science and Technology),2010, 41(6): 2091-2095.
[2] Lavela P, Tirado J L. CoFe2O4and NiFe2O4synthesized by sol-gel procedures for their use as anode materials for Li ion batteries[J]. Journal of Power Sources, 2007, 172(1): 379-387.
[3] Lavela P, Tirado J L, Womes M.57Fe Mössbauer spectroscopy study of the electrochemical reaction with lithium of MFe2O4(M=Co and Cu) electrodes[J]. J Phys Chem C, 2009, 113(46):20081-20087.
[4] YAO Wenli, WANG Jiulin, YANG Jun, et al. Novel carbon nanofiber-cobalt oxide composites for lithium storage with large capacity and high reversibility[J]. Journal of Power Sources,2008, 176(1): 369-372.
[5] WANG Yongguang, LI Huiqiao, HE Ping, et al. Nano active materials for lithium-ion batteries[J]. Nanoscale, 2010, 2(8):1294-1305.
[6] 肖逸帆, 柳松. 纳米二氧化钛的水热法制备及光催化研究进展[J]. 硅酸盐学报, 2007, 26(3): 523-528.XIAO Yifan, LIU Song. The progresses in research survey of photocatalytic properties of nano-titania preparation by hydrothermal method[J]. Builetin of the Chinese Ceramic Society, 2007, 26(3): 523-528.
[7] YUAN Shuming, ZHOU Zhen, LI Guang. Structural evolution from mesoporous α-Fe2O3to Fe3O4@C and γ-Fe2O3nanospheres and their lithium storage performances[J]. Cryst Eng Comm,2011, 13: 4709-4713.
[8] WANG Ying, Takahashi K, SHANG Huamei, et al. Synthesis and electrochemical properties of vanadium pentoxide nanotube arrays[J]. J Phys Chem B, 2005, 109(8): 3085-3088.
[9] Takahash K, Saitoh M, Asakura N. Electrochemical properties of lithium manganese oxides with different surface areas for lithium ion batteries[J]. Journal of Power Sources, 2004, 136(1):115-121.
[10] Huang X H, Tu J P, Zhang C Q, et al. Hollow microspheres of NiO as anode materials for 1ithium-ion batteries[J]. Electrochim Acta, 2010, 55(28): 8981-8985.
[11] ZHAO Hongxiao, ZHENG Zhi, Wong Kawai, et al. Fabrication and electrochemical performance of nickel ferrite nanoparticles as anode material in lithium ion batteries[J]. Electrochemistry Communications, 2007, 9(10): 2606-2610.
[12] WANG Zhongwu, Schiferl D, ZHAO Yusheng, et al. High pressure Raman spectroscopy of spinel-type ferrite ZnFe2O4[J]. J Phys Chem Solids, 2003, 64: 2517-2523.
[13] Chandramohan P, Srinivasan M P, Narasimhan S V. Cation distribution and particle size effect on Raman spectrum of CoFe2O4[J]. J Solid State Chem, 2011, 184: 89-96.
[14] Zhang G Y, Jiang X, Wang E G. Self-assembly of carbon nanohelices: Characteristics and field electron emission properties[J]. Appl Phys Lett, 2004, 84: 2646-2648.
[15] DING Yu, YANG Yifu, SHAO Huixia. High capacity ZnFe2O4anode material for lithium ion batteries[J]. Electrochimica Acta,2011, 56: 9433-9438.
[16] WANG Suqing, ZHANG Jingying, CHEN Chunhua. Fe3O4submicron spheroids as anode materials for lithium-ion batteries with stable and high electrochemical performance[J]. Journal of Power Sources, 2010, 195(16): 5379-5381.
[17] Laruelle S, Grugeon S, Poizot P, et al. On the Origin of the extra electrochemical capacity displayed by MO/Li cells at low potential[J]. J Electrochem Soc, 2002, 149(5): A627-A634.
[18] ZHENG Shufa, HU Jinsong, ZHONG Liangshu, et al.Introducing dual functional CNT networks into CuO nanomicrospheres toward superior electrode materials for lithium-ion batteries[J]. Chem Mater, 2008, 20(11): 3617-3622.
[19] Maier J. Nanoionics: Ion transport and electrochemical storage in confined systems[J]. Nat Mater, 2005, 4(11): 805-815.
[20] Park C M, Kim J H, Kim H, et al. Li-alloy based anode materials for Li secondary batteries[J]. Chem Soc Rev, 2010, 39:3115-3141.
[21] Tirado J L. Inorganic materials for the negative electrode of lithium-ion batteries: State-of-the-art and future prospects[J].Mater Sci Eng B, 2003, 40(3): 103-136.
[22] WANG Jiqiang, King P, Huggins R A. Investigations of binary lithium-zinc, lithium-cadmium and lithium-lead alloys as negative electrodes in organic solvent-based electrolyte[J]. Solid State Ion, 1986, 20(3): 185-189.

