小鼠淋巴瘤 tk 基因突变试验检测雄黄的致突变性
商庆华, 黄盼华, 吴文斌, 汤家铭*
(1.上海基赛生物医药科技有限公司, 上海 201203; 2.上海中医药大学实验动物中心, 上海 201203)
小鼠淋巴瘤 tk 基因突变试验检测雄黄的致突变性
商庆华1, 黄盼华1, 吴文斌2, 汤家铭2*
(1.上海基赛生物医药科技有限公司, 上海 201203; 2.上海中医药大学实验动物中心, 上海 201203)
目的 用小鼠淋巴瘤 tk基因突变试验检测雄黄浸出液的致突变性。 方法 在加或不加 S9 (萃巴比妥钠 +β萘黄酮诱导鼠肝匀浆上清液) 条件下, 用不同质量浓度雄黄浸出液可溶性砷处理小鼠淋巴瘤 L5178Y细胞, 采用微孔板法进行细胞毒、平板接种效率和突变频率测定,用统计学方法进行评价。结果 非活化条件下用雄黄浸出液处理3 h和24 h后, 随着浸出液可溶性砷质量浓度的增加, 小鼠淋巴瘤细胞的平板效率 (PE0和 PE2)、 相对存活率 (RS0)、 相对悬浮生长 (RSG)、 相对总生长率 (RTG) 逐渐下降, 24 h 作用后最高剂量 3.0 μg/mL的 RS0仅为 6.72%、 RSG仅为 3.94%、 RTG仅为 0.34%, 表明雄黄对小鼠淋巴瘤细胞有明显的毒性, 且作用时间长细胞毒性更明显。 随着浸出液可溶性砷质量浓度的上升, 抗性突变频率 (MF) 呈现上升趋势, 表明雄黄具有致突变性。 延长处理时间, 雄黄的致突变性增强。 活化条件下小鼠淋巴瘤细胞的 PE0、 PE2、 RS0、 RSG、 RTG和 MF的变化与非活化条件下结果相似,表明浸出液可溶性砷的毒性和致突变性不依赖于 S9 的活化。 结论 雄黄浸出液可溶性砷对小鼠淋巴瘤 L5178Y细胞具有致突变性。
小鼠淋巴瘤 L5178Y细胞; tk基因突变; 雄黄; 可溶性砷; 致突变
小鼠淋巴瘤细胞 tk基因突变试验 (mouse lymphoma tk genemutation assay,MLA)是一种体外哺乳动物细胞遗传毒性评价试验方法,已被广泛用于检测药物和化合物的遗传毒性,被认为是最敏感的体外致突变试验之 一[1-4]。该方法不但可检 出点突变、染色体畸变和重组等,而且还可检出非整倍体诱导剂等依赖于细胞周期的突变剂,因此早已被药品注册审批国际协调组织 (ICH) 推荐的标准实验系列组成 部分[5]。 在 ICH最新版的 《指导原则》中, MLA被认为可以替代体外 CHL细胞染色体畸变试验或体外微核试验,与其他遗传毒性试验组合使用。特别是当受试物为抗生素时,抗生素的抑菌作用影响 Ames试验的判断,需要增加 MLA进行检测[6]。
雄黄是一味常用的矿物类中药,主含二硫化二砷,具有抗菌、抗肿瘤、镇痉、止痛和杀虫等功效, 在2010 年版的 《中华人民共和国药典》 收录的中成药中有 24 种含雄黄,占全部中成药的4.6%[7]。为了全 面 评 价雄 黄 的 遗 传 毒 性, 采 用ICH和我国 《药物遗传毒性研究技术指导原则》[8]推荐的多种遗传毒性试验方法进行了研究。现将其中用 MLA检测雄黄的致突变性试验结果报道如下。
1 材料
1.1 受 试 物 雄 黄 浸 出 液, 将 批 号 为H2007052401 的雄黄 (产自湖南石门雄黄矿业)1.0 g溶于10mL的平衡盐溶液 (HBSS)中形成混悬液, 37 ℃水浴摇床以 100 r/min 水浴震荡 4 h 后静止20 h, 取上清液过滤后制成雄黄浸出液, 经上海市食品药品检验所测定可溶性砷质量浓度为1.20 mg/mL,冷藏保存备用。 阳性对照甲基磺酸甲 酯 ( MMS, sigma, 批 号 78697 ) 、 环 磷 酰 胺(CP, 江苏恒瑞), 选择突变剂三氟胸苷 (TFT,sigma, 批号 T2255)
1.2 细胞 小鼠淋巴瘤 L5178Y tk+/-,购自中国科学研究院细胞库。
1.3 培养基和试剂 RPMI1640 培养基、 马血清、双抗 (GIBCO公 司)、 丙 酮 酸 钠 ( sigma公 司),NaHCO3、胸腺嘧啶脱氧核苷、 次黄嘌呤、 甘氨酸(均为国药集团化学试剂有限公司) 和甲氨喋呤(sigma公司) 组成的 THMG和 THG培养液。
1.4 代谢活化剂 S9 由苯巴比妥钠与 β-萘黄酮联合诱导大鼠,取肝匀浆后离心获得上清,临用前S9 与 180 mg/mL的 6-磷酸葡萄糖、 25 mg/m L的NADP、 150 mmol/L的 KCl以体积比 2 ∶1 ∶1 配制成 S9 混合液,S9 混合液终体积分数为 2%。
2 方法
2.1 细胞培养 取清除自发突变细胞后的对数生长期 细 胞, 以 2 ×105个/mL的 密 度 在 THMG(0.1 μg/mL甲氨喋呤、3 μg/mL胸腺嘧啶脱氧核苷、 5 μg/mL次黄嘌呤和 7.5 μg/mL甘氨酸) 培养液中培养 1 d, 条件为 37 ℃、 5%CO2、 饱和湿度。 1 000 r/min, 10 min 离心细胞, 弃去上清, 用RPMI 1640 培养基洗涤细胞, 转入 THG (3 μg/mL胸 腺 嘧 啶 脱 氧 核 苷、5 μg/mL次 黄 嘌 呤 和7.5 μg/mL甘氨酸) 培养基中, 培养 2 d, 每日计数细胞, 并调整细胞密度为 2 ×105个/m L。
2.2 细胞的受试物暴露 取对数生长期的细胞调整密度为 5 ×105个/mL, 按 1%体积加入受试物使雄黄浸出液可溶性砷终质量浓 度为 0.75、 1.5、3.0、 6.0 μg/mL, 同时设立阴性对照组和阳性对照 组 (-S9:3 h, 10 μg/mL MMS, 24 h, 5 μg/mLMMS; +S9:3 μg/mL CP), 37 ℃震摇处理3/24 h, 离心, 弃上清液, 用 RPMI1640 培养基洗涤细胞 2 遍, 重新悬浮细胞于含 10%马血清的RPMI1640 培 养 液 中, 并 调 整 细 胞 密 度 为 2 × 105个/mL。
2.3 0 天平板接种效率 PE0测定 取适量细胞悬液, 作梯度稀释至 8 个细胞 /mL, 接种 96 孔板(每孔加 200 μL, 即平均 1.6 个细胞/孔), 每个剂量做2块板, 阴性及阳性对照做 4 块板, 37 ℃,5%CO2, 饱和湿度条件下培养 12 d, 计数每块平板有集落生长的孔数。
2.4 表达培养 将步骤 “2.2”项所得细胞悬液作2 d表达培养,每天计数细胞密度并保持密度在106个 /m L以下。 计算相对悬浮生长 ( Relative Suspension Growth, RSG) 。
2.5 第2 天平板接种效率 PE2测定 2 d 表达培养结束后, 取适量细胞悬液, 按步骤 “2.3”项作梯度稀释并接种 96 孔板, 培养 12 d 后计数每块平板有集落生长的孔数。
2.6 TFT抗性突变频率测定 2 d 表达培养结束后, 取适量细胞悬液, 调整细胞密度为 1 ×104个/m L, 加入 TFT(终质量浓度为 3 μg/m L), 混匀, 接种 96 孔板 (每孔加 200 μL, 即平均 2 000个细胞/孔), 96 孔板四周各孔加 200 μL PBS,每个剂量做2块板,阴性及阳性对照做4块板,于37 ℃, 5%CO2, 饱和湿度条件下培养 12 d, 计数有突变集落生长的孔数。 突变集落按大集落 (LC:直径 ≥ 1/4 孔 径, 密 度 低) 和小 集 落 (SC: 直径 <1/4 孔径,密度高) 分别计数, 极小集落可再继续培养3 d后计数。
2.7 结果计算和统计学处理
2.7.1 平板效率 ( PE0和 PE2) PE={ [ -ln(EW/TW)] /1.6} ×100% 式中 EW 为无集落生长的孔数; TW为总孔数; 1.6 为每孔接种细胞数。2.7.2 相对存活率 (RS) RS= [PE(处理) / PE(对照)] ×100%
2.7.3 相对悬浮生长(RSG) RSG= (处理组表达期间细胞增殖倍数/对照组表达期间细胞增殖倍数) ×100%
2.7.4 相对总生长率(RTG)RTG=RSG×RS2×100%, 式中 RSG为相对悬浮生长, RS2为第二天的相对存活率。
2.7.5 TFT抗性突变频率 (MF) MF( ×10-6) =[ -ln(EW/TW)] /2 000/PE2式中: EW 为无集落生长的孔数; TW 为总孔数; 2 000 为每孔接种细胞数。
2.7.6 统计学处理 用 IBM SPSSStatistics19 对突变频率进行统计分析,受试物各剂量组与阴性对照比较, P<0.05 为具有显著意义,P<0.01 为具有极显著意义。
3 结果
3.1 非活化条件下用雄黄浸出液 3 h/24 h 处理小鼠淋巴瘤 L5178Y细胞结果 表 1、 表 2 显示, 非活化条件下 用 雄黄浸出液 处 理3 h 和24 h后, 随着浸出液可溶性砷质量浓度的增加,小鼠淋巴瘤细胞的 PE0、 PE2、 RS0、 RSG、 RTG逐 渐 下 降, 其 中3 h作用后浸出液可 溶 性砷质量浓度在 3.0 μg/mL以上时 PE0、 PE2均在 60%以下; 24 h 作用后雄黄浸出液可溶性砷质量浓度在 0.75 μg/mL以上时PE0、 PE2均 在 60%以 下。 24 h 作 用 后 最 高 剂 量3.0 μg/mL的 RS0仅为 6.72%、 RSG仅为 3.94%、RTG仅为 0.34%,表明雄黄对小鼠淋巴瘤细胞有明显的毒性,且作用时间长细胞毒性更明显。
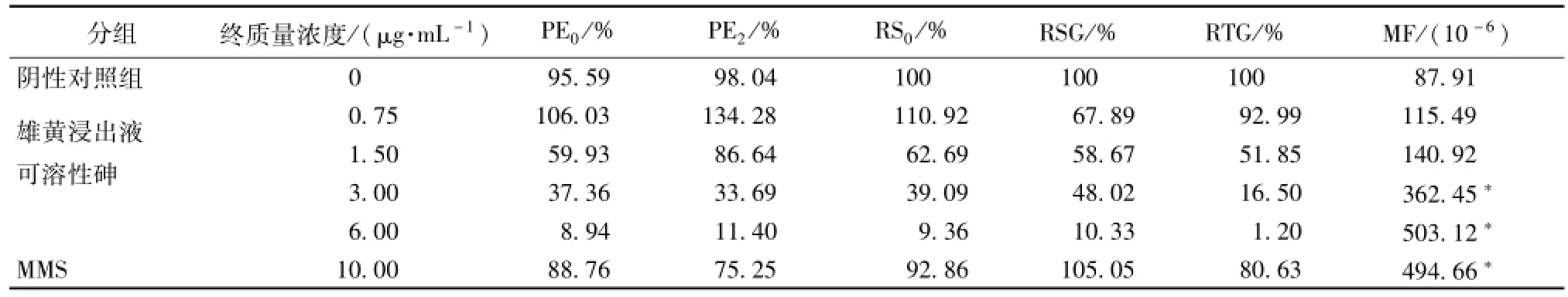
表 1 -S9/3 h条件下 雄 黄浸出液 的 小鼠淋巴 瘤 tk 基因突 变 试验Tab.1 M ouse lym phoma tk genemutation assay by using realgar extract under the condition of 3 h co-culture w ithout S9

表 2 -S9/24 h条 件 下雄黄浸 出 液的小鼠 淋 巴瘤 tk 基 因 突变试验Tab.2 M ouse lym phom a tk genemutation assay by using realgar extract under the condition of 24 h co-cultu re w ithout S9
随着浸出液可溶性砷质量浓度的上升,MF呈现上升趋势,表明雄黄具有致突变性。用雄黄浸出液处理3 h 后, 可溶性砷质量浓度达到3 μg/mL以上时,各剂量组与阴性对照比较,差异有极显著意义(P<0.01);处理 24 h 后,可溶性砷质 量浓度达到0.75 μg/mL以上时,各剂量组与阴性对照比较,差异有极显著意义 (P<0.01), 说明延长处理时间,雄黄的致突变性增强。3.2 活化条件下用雄黄浸出液 3 h 处 理小鼠淋巴瘤 L5178Y细胞结果表3显示, 在活化条件下用雄黄浸出液处理3 h后, 随着浸出液可溶性砷质量浓度的增加,小鼠淋巴瘤细胞的 PE0、 PE2、 RS0、RSG、 RTG逐渐下降,与非活化条件下的结果相似,表明雄黄可溶性砷对小鼠淋巴瘤细胞的毒性不依赖于S9的活化。

表 3 +S9/3 h条件下 雄 黄浸出液 的 小鼠淋巴 瘤 tk 基因突 变 试验Tab.3 M ouse lymphoma tk genemutation assay by using realgar extract under the condition of 3 h co-culture with S9
随着浸出液可溶性砷质量浓度的上升, MF亦呈现上升趋势,但与非活化条件下相比,同一剂量的MF并没有明显上升,说明雄黄的致突变性亦不依赖于S9的活化。
4 讨论
MLA是用于检测药物或化合物致突变试验方法, 被 ICH推荐为药物遗传毒性评价的哺乳动物细胞体外试验之一[6]。 我国在食品、保健食品、药品、化妆品等安全性评价领域也将此试验列入推荐方法之一[9]。 特别是对一些抗生素类药物或本身具有抗菌、抑菌作用的中药、天然药物进行致突变性评价时, Ames试验所用的各鼠伤寒沙门氏菌株会受到受试物的抑制而无法获得可靠的结果,此时应用MLA就具有独特的优势。 本课题组在研究中药雄黄的遗传毒性, 用 Ames试验时就发现此现象, 因而增加 MLA检测方法, 从致突变性方面评价其遗传毒性。
在先前的研究中已经证实雄黄的毒性存在于可溶性砷部分[10], 因而可直接用雄黄浸出液作为供试品进行研究。
据文献报道, MLA可采用短期处理 (3 h) 和长期处理 (24 h) 结合的方法, 以提高检测的敏感性, 检出短 期 处 理呈 阴 性 的某 些 化 学 物[11-13]。 本研究分别采用短期 (3 h) 和长期 (24 h) 处理、有或无代谢活化系统 (S9) 处理评价雄黄的致突变性。
本次试验中, 无论是有或无 S9, 3 h 或 24 h,小鼠淋巴瘤细胞的 PE0、 PE2、 RS0、 RSG、 RTG随着可溶性砷的质量浓度升高而逐渐下降,最高质量浓度时这些指标均在 20%以下, 表明可溶性砷对细胞的毒性较大,这与此前的研究中发现可溶性砷对 CHL细胞毒性较大[14]相一致。
本试验结果表明,随着雄黄浸出液可溶性砷浓度增大, 小鼠淋巴瘤细胞 tk基因的突变频率有升高的趋势。
在非活化条件下3 h处理后,可溶性砷终质量浓度为 3.0 μg/mL以上时, 即对淋巴瘤细胞表现出明显的诱变性,其 MF为阴性对照的4倍以上。24 h 处理后, 可溶性砷终质量浓度降 至 0.75 μg/mL以上时, 亦可对淋巴瘤细胞表现出明显的诱变性, MF高于阴性对照 100 ×10-6以上; 当可溶性砷终质量浓度为 3.0 μg/mL以上时, 其 MF为阴性对照的6倍以上,表明可溶性砷与小鼠淋巴瘤细胞作用时间越长,其毒性就越大。
在活化条件下3 h处理后,可溶性砷终质量浓度为 1.5 μg/mL以上时, 即对淋巴瘤细胞表现出明显的诱变性,其MF为阴性对照的2倍以上。考虑到在活化条件下的MF与同剂量下非活化条件下的MF并没有明显增大,另外可溶性砷是无机物,在体内并不需要在肝脏代谢,因而认为可溶性砷的致突变性可能是药物直接对细胞作用的结果。
在先前的研究中,用小鼠骨髓细胞微核试验和彗星试验、 CHL细胞染色体畸变试验和仓鼠体内染色体畸变实验均证实了雄黄具有较强的遗传毒性[14-15]。 本次 实 验结 果 表 明, 雄 黄 浸出 液 对 小 鼠淋巴瘤 L5178Y细胞也具有致突变性。
[ 1 ] Moore M M, Clive D, Hozler JC, et al.Analysis of trifluothymidine-resistant( TFT) mutants of L5178Y/TK+/-mouse lymphoma cell[ J] .Mutat Res, 1985, 151 ( 1 ):161-174.
[ 2 ] Combes R D, Stopper H, Caspary W J.The use of L5178Y mouse lymphoma cells to assess themutagenic, clastogenic and aneugenic propertics of hemicals[ J] .Mutagenesis, 1995, 10(5): 403-408.
[ 3 ] Zhang L S, Honma M, Matsuoka A, et al.Chromosome painting analysis of spontaneous and methyl methanesulfonateinduced trifluorothymidine-resistant L5178Y cell colonies[ J]. Mutat Res, 1996 , 370(3/4) : 181-190.
[ 4 ] Honma M, Sofuni T.Themouse lymphoma assay( MLA) using themicrowellmethod in Genetic Toxicology and Cancer Risk Assessment[ M] .New York: Marcel Dekker Inc, 2001:141-161.
[ 5 ] Muler L, Kikuchi Y, Probst G, et al.ICH-Harmonised guidances on genotixicity testing of pharmaceuticals: evolution, reasoning and impact[ J].Mutat Res, 1999, 436(3) : 195-225.
[ 6 ] International conference on harmonisation of technical requirenents for registration of pharmaceuticals for human use: guidance on genotoxicity testing and data interpretation for pharmaceuticals intended for human useS2( R1) [ S] .2011-11-09.
[ 7 ] 国家药典委员会.中华人民共和国药典: 2010 年版一部[S].北京: 中国医药科技出版社, 2010: 667.
[8] 《药物遗传毒性研究技术指导原则》 课题研究组.药物遗传毒性研究技术指导原则 (第二稿) [S].2006.
[ 9 ] GB15193.20-2003, TE基因突变试验[S].
[10] 顾晶晶, 黄珍祯, 谷颖敏, 等.雄黄可溶性砷和价态砷与小鼠急性毒性关系的研究[J].中国实验方剂学杂志,2011, 17(8): 266-269.
[11 ] Honma M, Zhang L S, Sakamoto H, et al.The need for longterm treatment in themouse lymphoma assay[ J] .Mutagenesis,1999, 14(1): 23-29.
[12] 王怡净, 张立实.用 tk基因突变试验评价长春新碱和秋水仙碱的遗传毒性[J].卫生研究, 2006, 35(2): 179-181.
[13] 王亚男, 郭亚杰, 张立实.长春花碱 3 和24 h 处理 TK6 细胞 TK基因突变试验比较研究[J].现代预防医学, 2008,35(17): 3373-3378.
[14] 赵 源, 吴文斌, 汤家铭.雄黄致仓鼠体内外染色体畸变的研究 [ J].中 国 实 验方剂 学 杂 志, 2012, 18 (14 ):245-249.
[15] 吴文斌, 张超超, 汤家铭.微核试验和彗星试验检测雄黄的遗传毒性[J].中国药理学毒理学杂志, 2012, 26(4):550-554.
Detection ofmutagenicity of realgar by mouse lym phoma tk genemutation assay
SHANG Qing-hua1, HUANG Pan-hua1, WUWen-bin2, TANG Jia-ming2*
(1.Shanghai Gene-cell Biotech Co., Ltd., Shanghai201203, China; 2.Laboratory Animal Center, Shanghai University of TCM, Shanghai201203,China)
mouse lymphoma L5178Y cell; tk genemutation; realgar; soluble arsenic; mutagenicity
R285.5
: A
: 1001-1528(2014)05-0917-04
10.3969/j.issn.1001-1528.2014.05.007
2013-04-17
科技部重大新药创制基金 (2009ZX09502-002)
商庆华 (1985—) , 女, 硕士, 主要从事细胞药理研究。 E-mail: shangqinghuajisai@163.com
*通信作者: 汤家铭 (1952—) , 男, 研究员, 主要从事中药毒理方面研究。 E-mail: tangjiaming@hotmail.com

