木薯叶致突变作用研究
杨 娟,丁晓雯,*,龙 悦,黄先智
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,重庆400716;2.西南大学蚕学与系统生物研究所,重庆北碚400716)
木薯(Manihot esculenta Crantz)又称木番薯、树薯,地下部分结薯。人们种植木薯主要是为了获取木薯根用来生产淀粉和酒精[1]。大量木薯茎、叶没能得到充分的利用,尤其是木薯叶,它富含蛋白质、维生素及矿物质,其中蛋白质含量在4.0%~9.6%之间,干叶中为 20.6% ~36.4% 之间[2-3]。因此木薯叶可以养蚕、作为蛋白质补充剂用于禽畜饲料[4-6]。但由于木薯茎叶中含有氰化物,其含量为58.9~162.3mg/kg鲜样,占全株的2.1%[7]。一定量的氰化物进入人和动物体内,将导致组织细胞窒息,使木薯叶的利用存在一定的安全隐患[8],相关报道[9-11]显示,山羊、家兔、耕牛等动物进食过量木薯叶后可发生氢氰酸中毒。由此可见,木薯叶存在着不可忽视的安全隐患,而现国内外对于其安全利用的研究却微乎其微。仅有报道称用沸水处理可以降低木薯叶中氰化物的含量[12]。
本实验室对木薯蚕进行安全性分析时发现蚕蛹具有一定的致突变性,追其原因发现跟木薯叶相关。因此,实验室对木薯叶进行了安全性分析。在测定木薯叶氰化物含量基础上,对木薯叶的遗传毒性进行了研究,以期实验结果对木薯叶的安全利用提供参考数据。
1 材料与方法
1.1 材料与仪器
昆明种清洁级小白鼠,体重18~30g,重庆市中药研究院动物研究所,许可证号SCXK(渝)2007-0006。
干木薯叶:西南大学蚕学与系统生物研究所提供,产地为广西南宁。
甲醇(AR)成都科龙化工试剂厂;碱性品红 温州市东升化工试剂厂;环磷酰胺(AR)山西普德药业有限公司;小牛血清 北京燕生政博生物科技有限责任公司;Giemsa染液 上海馨晟试化工科技有限公司;其他常用试剂均为分析纯。
XSN-3G显微镜 重庆光电仪器有限公司;HH-8数显恒温水浴锅 常州欧化仪器有限公司;KQ5200DB超声波清洗机 昆山市超声仪器有限公司;RE52CS-1旋转蒸发器 上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 干木薯叶中氰化物含量的测定 按照参考文献[13]的方法进行测定。
1.2.2 蚕豆根尖微核试验 称取干木薯叶,粉碎加水,分别制成浓度为 1.58、3.16、6.32、15.80、31.59mg/mL 的木薯叶粉溶液,超声30min(常温,160W),过滤,收集滤液备用。
蚕豆根尖微核试验(micronucleus,MCN)的方法[14]:选择饱满、大小均匀的蚕豆种子,置于蒸馏水中浸泡26~30h使其吸胀,于25℃水浴锅中恒温培养。用制备好的滤液对蚕豆进行染毒处理,同时做阳性对照(10.0μg/mL环磷酰胺溶液)处理和阴性对照(蒸馏水)处理。各处理组染毒6h之后,每组取发芽种子6~8粒,从根尖顶端切下1cm的幼根用卡诺固定液固定24h,置70%乙醇中,4℃冰箱保存。幼根经过5mol/L盐酸软化,席夫氏试剂浸染,二氧化硫洗涤液浸洗,常规制片,显微镜观察。每个处理观察5个以上根尖,每个根尖至少观察1000个间期细胞,统计细胞微核数,按下式计算微核率:
微核率(MCN)(‰)=某测试样品(包括对照组)观察到的MCN数/某测试样品(或对照)观察的细胞数×1000

试验结果的判定:样品的微核率与阴性对照的微核率进行比较,如果差异有显著性并且微核指数在1.5以上,认为样本具有致植物细胞突变的作用[15]。
1.2.3 小鼠骨髓细胞微核试验 采用GB 15193.5-2003《骨髓细胞微核试验》[16]。
选用健康昆明种小鼠60只,体重25~30g,随机分成6组,每组10只小鼠,雌雄各半。设一个阴性对照组(蒸馏水)和一个阳性对照组(40mg/kg·bw环磷酰胺溶液),木薯叶受试物分为四个浓度组,各组均以小鼠最大灌胃体积20mL/kg进行灌胃,两次灌胃时间间隔为24h。
于第2次灌胃后6h处死动物,取小鼠胸骨,去肉,用止血钳挤出骨髓液与玻片一端的小牛血清混匀涂片,自然干燥后放入甲醇中固定5~10min,取出晾干。放入Giemsa应用液中染色10~15min,立即用纯水冲洗晾干。先以低倍镜、高倍镜粗检,再用油镜检查计数。嗜多染红细胞(PCE)呈灰蓝色,成熟红细胞(RBC)呈粉红色,微核呈紫红色或蓝紫色。每张片计数1000个嗜多染红细胞,并计算含微核的嗜多染红细胞数,微核率计算公式:
嗜多染红细胞微核率(‰)=有微核的嗜多染红细胞总数/嗜多染红细胞总数×1000
用t检验比较各组供试小鼠微核率的差异[17-19]。与阴性对照组相比,若结果为显著性差异或极显著性差异,即p<0.05或p<0.01,则认为样本具有致动物体细胞突变的作用;若结果为p>0.05,则说明样本不具有致动物体细胞突变的作用。
1.2.4 小鼠精子畸形试验 采用GB 15193.7-2003《小鼠精子畸形试验》[20]。
选用健康昆明种成年雄性小鼠30只,体重25~35g,随机分成6组,每组5只。设阴性对照组(蒸馏水)和阳性对照组(40mg/kg·bw环磷酰胺溶液),木薯叶受试物分为四个浓度组。各组均以小鼠最大灌胃体积40mL/kg进行灌胃,两次灌胃时间间隔为24h。
连续灌胃5次,随后饲养30d。饲养过程中自由摄食、饮水,于35d颈椎脱臼处死,分别取小鼠两侧附睾,制成精子悬液,常规涂片,甲醇固定,用1%的伊红染色,于10×40倍显微镜下观察形态。每张片观察1000个头、尾完整的精子,记录畸形精子数,计算精子畸形率,计算公式如下。
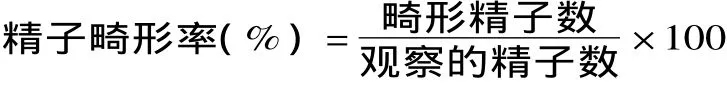
试验结果的判定是以样品的精子畸变率与阴性对照的精子畸变率进行比较,对比较结果进行统计学分析。如果差异有显著性,即认为实验样品为阳性,可能具有一定的致突变性。
1.2.5 数据统计分析方法 采用SPSS软件进行分析。
2 结果与分析
2.1 干木薯叶中氰化物的含量
木薯叶中含氰化物使其存在一定的安全隐患。测定结果显示,实验用木薯叶中氰化物含量为(5.26±0.59)mg/kg干样,这与陈建新等[7]测定结果相差较大,原因可能实验用木薯叶是烘干的,有学者发现烘干可使木薯叶中氰化物的损失率达到50% ~70%[21]。
由此可计算出实验设计中所取的不同浓度木薯叶中氰化物的含量,如表1~表3所示。
2.2 木薯叶对蚕豆根尖细胞微核率的影响
蚕豆根尖细胞微核试验与染色体畸变实验有良好的相关性[22],蚕豆和动物之间对环境致突变物所引起的染色体畸变等定性反应的一致性可达99%以上[23],且蚕豆根尖微核试验快速、简便、重复性好和灵敏度高,现大量学者将蚕豆根尖微核试验应用于食品中化学物质致突变性的检测,作为一种方便快捷的体外试验方法[24-26]。

表1 木薯叶的蚕豆根尖微核试验结果Table 1 The results of Cassava leaves of broad bean root tip micronucleus test
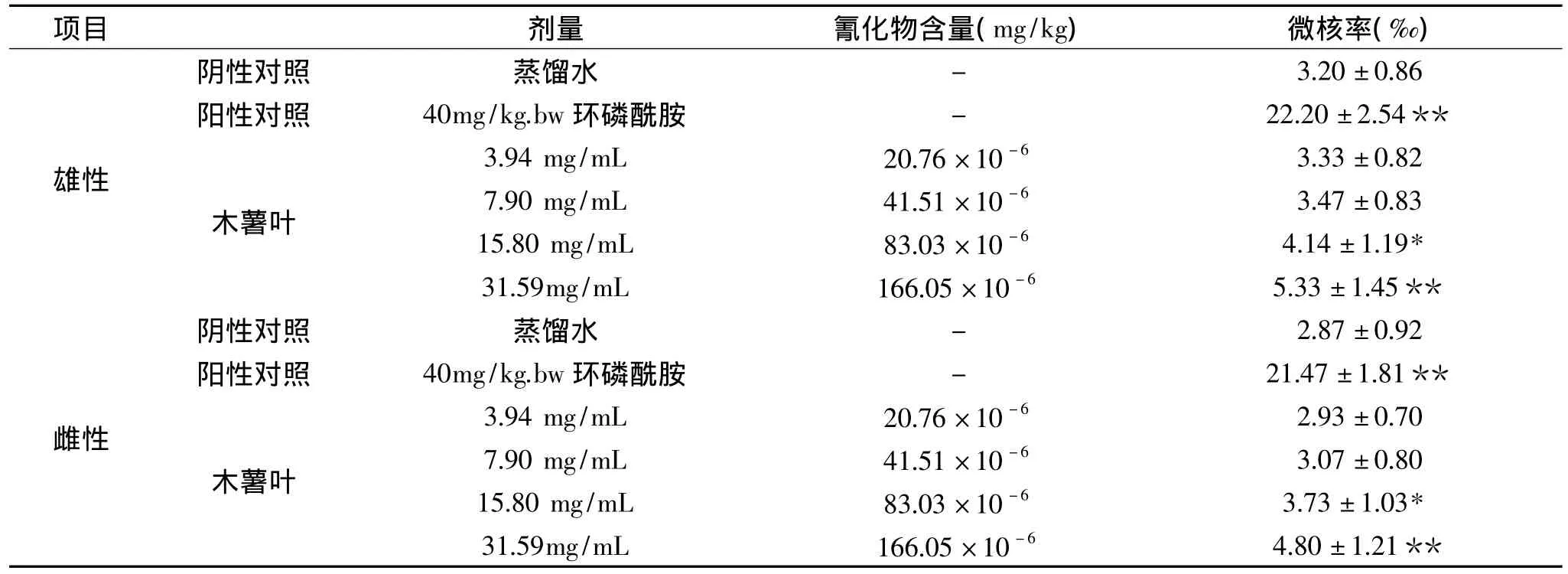
表2 木薯叶致小鼠骨髓微核率试验结果Table 2 The results of mouse bone marrow micronucleus on cassava leaf
木薯叶对蚕豆根尖细胞微核率的影响结果见表1。
从表1可以看出,木薯叶在1.58~31.59mg/mL实验浓度范围内,对蚕豆根尖微核率的影响呈现明显的剂量-效应关系。当木薯叶样品浓度为15.80、31.59mg/mL(氰化物含量为 83.03 ×10-6、166.05 ×10-6mg/mL)时,与阴性对照比较具有极显著性差异(p<0.01)且蚕豆根尖微核指数分别为1.77、2.16。由此判定当木薯叶浓度大于15.80mg/mL以上,对蚕豆根尖细胞可能具有致突变作用。
2.3 木薯叶对小鼠骨髓细胞微核率的影响
小鼠骨髓微核试验是通过测定骨髓嗜多染红细胞微核发生率以检测细胞遗传损伤的体内微核试验方法[22]。当红细胞受到外界诱变因子作用,成熟红细胞发展为红细胞时,主核排出,微核仍留在胞浆中。通过小鼠骨髓微核试验,确认木薯叶是否具有致哺乳动物体细胞突变性。
木薯叶对小鼠骨髓细胞微核率的影响结果见表2。
从表2中可知,阳性对照组中小鼠的骨髓微核率最高,与阴性对照组比较存在极显著性差异(p<0.01),说明在此条件下实验结果是可靠的。
在雌、雄性小鼠试验中,木薯叶浓度为15.80和31.59mg/mL时,与阴性对照相比分别存在显著性差异(p<0.05)和极显著性差异(p<0.01),而当木薯叶浓度7.90和3.94mg/mL时,与阴性对照均不存在显著性差异(p>0.05)。
木薯叶在3.94~31.59mg/mL实验浓度范围内,对小鼠骨髓微核率的影响呈现明显的剂量-效应关系。当木薯叶浓度超过15.80mg/mL以上,即木薯叶中氰化物含量高于83.03×10-6mg/kg时,可能对雌、雄小鼠的体细胞均具有致突变作用。
2.4 木薯叶的小鼠精子畸形试验
通过观察精子形态变化来判断木薯叶对小鼠精子生成、发育的影响,判断木薯叶对雄性生殖细胞的致突变作用。
木薯叶对小鼠精子畸形影响结果见表3。
如表3所示,阳性对照组对小鼠精子畸变率较阴性对照组存在显著差异(p<0.01),说明在此条件下实验结果是可靠的。
当木薯叶浓度大于7.90mg/mL,与阴性对照组比均存在极显著性差异(p<0.01)。表明木薯叶浓度在7.90mg/mL以上,对小鼠生殖细胞可能具有致突变作用。
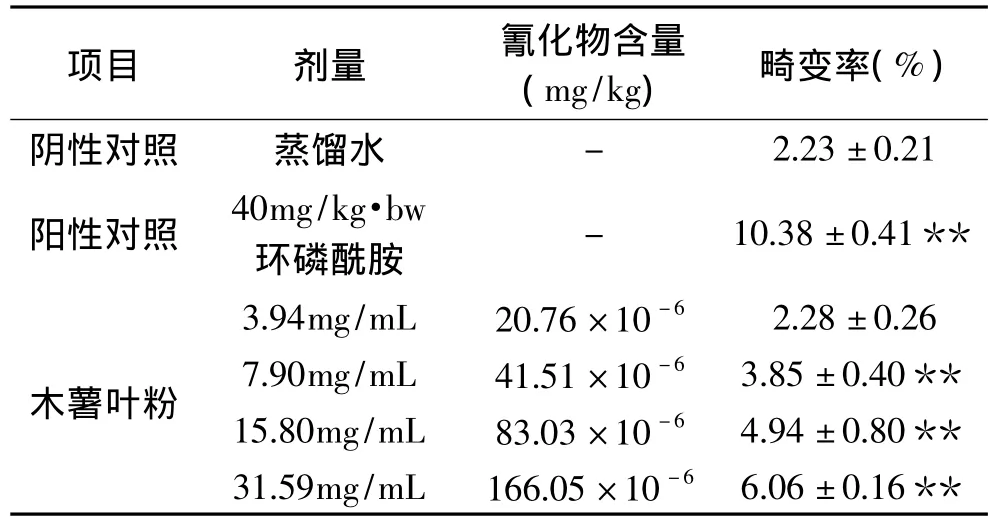
表3 木薯叶对小鼠精子畸变发生率的影响Table 3 Effects of cassava leaf on mouse sperm shape abnormality rates
3 结论
由此判定,当木薯叶浓度超过7.90mg/mL(含氰化物浓度41.51×10-6mg/kg)时对小鼠生殖细胞可能具有致突变作用;木薯叶浓度超过15.80mg/mL(含氰化物83.03×10-6mg/kg)时对植物细胞、动物体细胞及动物生殖细胞均可能具有致突变作用。所以,在对木薯叶进行使用的过程中,应注意浓度的限制。另外,虽已证实木薯叶具有致突变作用,且对其有毒物质氰化物进行了测定,但仍不能完全确定其毒性是否与氰化物的含量有关,就木薯叶安全性考量,理应进一步确定木薯叶中氰化物的影响,进一步确定木薯叶致突变性与其氰化物含量之间的关系。
目前,木薯叶作为饲料生产的过程中几乎未经过任何前处理,安全性极低,这应该引起广大学者的注意,找出恰当的前处理方法用于木薯叶的开发利用。
国内外学者提出,可利用木薯叶的营养保健功能开发木薯叶营养保健品,将其列为新的食物资源,而开发的过程中遇到诸如口感、安全性方面的问题,有待更多学者致力其中。
[1]Achidi AU,Ajayi OA,Bokanga M,et al.The use of cassava leaves as food in Africa[J].Ecology of Food and Nutrition,2005,44:423-435.
[2]Lancaster PA,Brooks JE.Cassava leaves as human food[J].Economic Botany,1983,37:331-348.
[3]陶海腾,吕飞杰,台建祥,等.木薯叶营养保健功效的开发[J].中国农学通报,2008,24(6):78-81.
[4]Bounenberger L,Gomes SD,Coelho SRM,et al.Cassava leaf protein concentrate in Nile tilapia diets during sex reversal phase[J].Brazilian Journal of Science,2010,39(6):1169-1174.
[5]Carvalho PLPF,Silva R L,Damasceno FM,et al.Nutritional value of root and leaves of cassava for nile tilapia[J].Boletim Do Instituto De Pesca,2012,38(1):61-69.
[6]Nguyen Thi Hoa Ly,Le Duc Ngoan Verstegen,Martin Wilhelmus Antonius,et al.Pig performance increases with the addition of DL-methionine and L-lysine to ensiled cassava leaf protein diets[J].Tropical Animal Health and Production,2012,44(1):165-172.
[7]陈建新,刘是帼,刘家运,等.木薯不同植龄及品种氢氰酸含量分析[J].牧草与饲料,1993,2:31-33.
[8]Umar F.Yusuf,Fakhru’l-Razi Ahmadun,Rozita Rosli,et al.An in vitro inhibition of human malignant cell growth of crude waterextractofcassava(Manihotesculenta Crantz)and commcricial linamatin[J].Nutraceutical and Functional Food,2006,28(1):145-155.
[9]杨志.耕牛木薯叶中毒治疗方法[J].动物门诊,2012,(9):25-26.
[10]肖秀汇.一起家兔木薯叶中毒的诊治[J].福建兽牧兽医,2003,25(1):31-32.
[11]Soto- Blanco,Gorniak SL.Toxic effects of prolonged administration of leaves of cassava(Manihot esculenta Crantz)to goats[J].Experimental and Toxicologic Pathology,2010,62(4):361-366.
[12]Bradbury JH,Denton IC.Mild methods of processing cassava leaves to remove cyanogens and conserve key nutrients[J].Food Chemistry,2011,127(4):1755-1759.
[13]蒋治国,何飞燕,李兴芳.饲料中氢氰酸含量测定方法的研究[J].饲料工业,2005,26(22):41-42.
[14]范雪涛,马丹炜,刘爽,等.蚕豆根尖微核试验在辣子草化感作用研究中的应用[J].生态环境,2008(1):323-326.
[15]丁晓雯,李红,王海燕.环磷酰胺对蚕豆根尖细胞微核率的影响[J].食品科学 2010,31(1):194-197.
[16]中华人民共和国卫生部.GB 15193.5-2003骨髓细胞微核试验[S].北京:中国标准出版社,2003.
[17]曹佳,林真,余争平.微核试验原理方法及其在人群监测和毒性评价中的应用[M].北京:医学科学出版社,2000,56-64.
[18]沈建忠.动物毒理学[M].北京:中国农业出版社,2002,227-234.
[19]俞渭江.生物统计附实验设计[M].北京:农业出版社,1980,29-80.
[20]中华人民共和国卫生部.GB 15193.7-2003小鼠精子畸形试验[S].北京:中国标准出版社,2003.
[21]Nambisana B.Strategies for elimination of cyanogens from cassava for reducing toxicity and improving food safety[J].Food and Chemical toxicology,2011,49(3):690-693.
[22]王爽,诸葛坚,余应年.微核与微核试验在遗传毒理学中的应用[J].癌变 畸变 突变,2000,12(4):253-256.
[23]祝庆蕃,常福聚,赵庆夏.蚕豆根尖细胞微核试验[J].遗传,1989,11(2):7-8.
[24]Pomain M,Picelli CE,Pourrut BE,et al.Assessment of the genotoxicity of Cu and Zn in raw and anaerbically digested slurry with the Vicia faba miconucleus onucleus test[J].Mutation Research/Genetic Toxicology Environmental Mutagenesie,2009,(2):113-118.
[25]桂明英,郭永红,朱萍,等.美味牛肝菌致突变作用研究[J].食用菌学报,2008,15(2):42-46.
[26]王海燕,丁晓雯,黄先智.桑蚕蛹品质及其安全性评价研究[D].重庆:西南大学,2011.

