10种心血管类中药注射剂对人细胞色素P4507种亚型的体外抑制作用Δ
刘丽雅,韩永龙,余奇,朱金辉,郭澄1,#(1.上海中医药大学,上海0103;.上海交通大学附属第六人民医院药剂科,上海 0033)
中药注射剂是国内独创的,以中医药理论为指导,采用现代科技从单方或复方中药材中提取有效物质制成的可供注入人体内的制剂。由于其疗效独特,在临床上广泛应用。目前,获得国家食品药品监督管理总局批准的中药注射剂有121种、866个批准文号。这些中药注射剂在临床经常与化学药联合使用,引起较多不良反应。药物相互作用(Drug drug interactions,DDI)引起的不良反应日益受到关注,其中代谢性DDI发生率最高,约占40%[1]。细胞色素P450(CYP)被抑制或被诱导是导致药物代谢性相互作用的主要原因,酶抑制作用约占代谢性相互作用的70%[2-3]。CYP主要存在于肝脏中,涉及药物代谢的主要有CYP1、CYP2、CYP3家族中7种重要的亚型,包括CYP1 A2(占CYP代谢药物的8.9%)、CYP2 B6(7.2%)、CYP2 C8(4.7%)、CYP2 C9(12.8%)、CYP2 C19(6.8%)、CYP2 D6(20%)与CYP3 A4/5(30.2%)[3],美国食品药物管理局在其2012版《药物相互作用研究指南草案》中也重点关注了这7个亚型。
目前,研究中成药对CYP作用的报道中,大多使用大鼠、小鼠或家兔作为体内、外实验对象,由于CYP活性存在较大的种属差异,其研究结果往往不能准确反映对人的影响。笔者研究的丹红注射液等10种心血管类中药注射剂是临床中使用量较大、存在多药联用现象的药物,通过研究它们对人肝微粒体中上述7种主要的CYP亚型的体外抑制作用,可以为临床合理用药提供参考,避免代谢性药物相互作用的发生。
1 材料
1.1 仪器
Agilent QQQ液相色谱-质谱联用仪,包括G6410 B型三重串联四级杆质谱、G1311 A型四元输液泵、G1322 A型脱气机、G1367 B型自动进样器、G1316 A型柱温箱,配有电喷雾源和MassHunter软件工作站(美国Agilent公司);BP211 D型电子天平(德国Sartorius公司);BR 4 i型高速冷冻离心机(法国Jouan公司);Vortex Genie 2型涡旋混悬器(美国Vortex公司);MDF-U32 V型超低温冰箱(日本Sanyo公司);Q型纯水系统(美国Millipore公司);DKZ-1型电热恒温振荡水槽(上海一恒科技有限公司)。
1.2 药品与试剂
丹红注射液(DH,菏泽步长制药有限公司,批号:12091003);红花注射液(HH,太原华卫药业有限公司,批号:11102701);丹参注射液(DS,上海中西制药有限公司,批号:130307);注射用丹参多酚酸盐(DSDF,上海绿谷制药有限公司,批号:12120221);灯盏细辛注射液(DZXX,云南生物谷灯盏花药业有限公司,批号:20121235);注射用灯盏花素(DZHS,昆明龙津药业股份有限公司,批号:20120918-1);参麦注射液(SM,正大青春宝药业有限公司,批号:1207115);参附注射液(SF,雅安三九药业有限公司,批号:120802);舒血宁注射液(SXN,神威药业集团有限公司,批号:130204 A2);疏血通注射液(SXT,牡丹江友搏药业有限公司,批号:2012042521);对乙酰氨基酚(批号:100018-200408)、双氯芬酸(批号:100334-200302)、咪达唑仑(批号:171250-200401)、槲皮素(批号:100081-200907)、噻氯匹定(批号:100542-200301)、酮康唑(批号:100294-200602)、维拉帕米(批号:100223-300102)均购自中国食品药品检定研究院;氧化型辅酶Ⅸ(NADP)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)、葡萄糖-6-磷酸(G-6-P)、4-羟基美芬妥英、右啡烷、非那西丁、右美沙芬、呋拉茶碱、塞替派、磺胺苯吡唑均购于美国Sigma公司;去甲阿莫地喹、阿莫地喹、s-美芬妥英均购自加拿大TRC公司;羟基安非他酮(美国Cerilliant公司);4-羟基双氯芬酸(美国TLC公司);1-羟基咪达唑仑(美国IL公司);安非他酮(日本TCI公司);奎尼丁(中国百灵威科技有限公司);其余无机盐均为分析纯,有机溶剂均为色谱纯,水为超纯水。
1.3 微粒体
混合人肝微粒体(上海瑞德肝脏疾病研究有限公司)。
2 方法
2.1 待测药物溶液的制备[4]
10种心血管类中药注射剂除DSDF 200mg和DZHS 50mg分别用10ml的0.9%NaCl溶解作为贮备液外,其余都以原液作为贮备液,用pH7.4的100mmol/L PBS逐步稀释至9个不同浓度的工作液。DSDF的质量浓度范围为2~4000μg/ml;DZHS的质量浓度范围为0.5~1000μg/ml;DH、HH和DZXX的体积分数范围为0.001%~1.6%;DS与SXT的体积分数范围为0.01%~20%;SM、SF和SXN的体积分数范围为0.015%~30%。
2.2 体外人肝微粒体孵育体系
终体积为250μl的体外孵育体系包括混合人肝微粒体蛋白(0.25mg/ml)、MgCl2(5mmol/L)、G-6-PDH(1u/ml)、G-6-P(5mmol/L)、PBS(100mmol/L)、混合探针底物(非那西丁、安非他酮、阿莫地喹、双氯芬酸、s-美芬妥英、右美沙芬、咪达唑仑终浓度分别为20、30、0.1、1、40、2、2 μmol/L)和不同质量浓度的待测药物或阳性抑制剂,在37Ⅸ水浴中预孵化5min后加入尼克酰胺腺嘌呤二核苷酸磷酸(NADP+,1mmol/L)启动反应,孵化10min,整个孵育体系控制有机溶剂的体积分数在1%以内。用25μl含内标维拉帕米的终止液[H2O∶CH3CN∶HCOOH=42∶55∶3(V/V/V)][5]在冰上终止反应,然后涡旋混合30 s后,4Ⅸ下、20000×g离心15min,取上清液20μl进样。生成相应的7种代谢产物对乙酰氨基酚、羟基安非他酮、去阿莫地喹、4-羟基双氯芬酸、4-羟基美芬妥英、右啡烷、1-羟基咪达唑仑,用高效液相色谱-串联质谱(LC-MS/MS)定量分析。
2.3 色谱与质谱条件[5]
2.3.1 色谱条件色谱柱:Agilent XDBC18(50mm×2.1mm,3.5μm);流动相A:水(0.1%甲酸),流动相B:乙腈(0.1%甲酸),采用梯度洗脱[0→4.0min,5%→80%(B);4.0→4.2min,80%(B);4.2→6.0min,80%→5%(B)];流速:0.3ml/min ;柱温:40Ⅸ。
2.3.2 质谱条件 离子源:ESI源;扫描方式:多反应监测(MRM);喷雾电压:4kV;喷雾起压:40psi;雾化器温度:350Ⅸ;气流速度:11 L/min。7个探针药物代谢产物及内标的MRM质谱参数见表1。
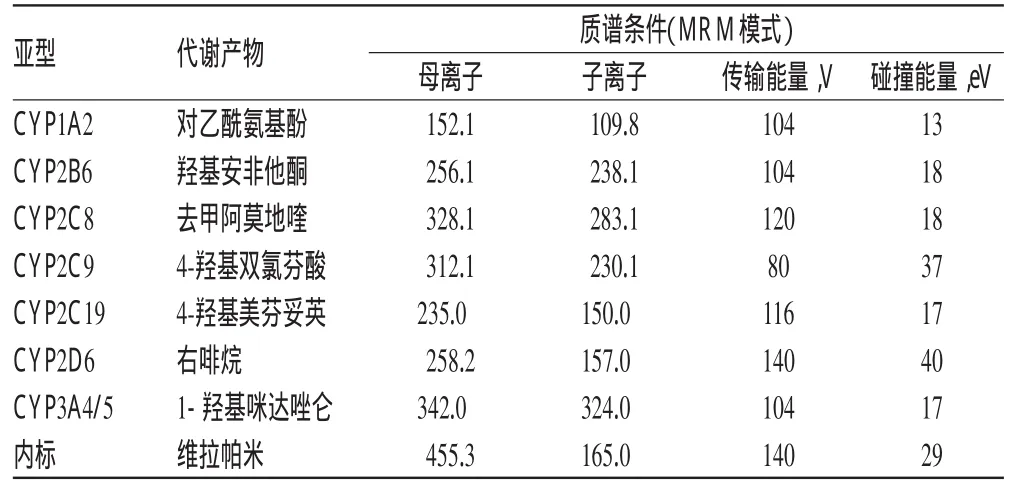
表1 7个探针药物代谢产物及内标的MRM质谱参数Tab 1 Multiple reaction response monitoring spectrum parameters of 7probe substrates and internal standard
2.4 阳性抑制剂半数抑制浓度(IC50)测定
将7个不同浓度的阳性抑制剂[呋拉茶碱(0.0192~19.2μmol/L)、塞替派(0.528~528μmol/L)、槲皮素(0.015~15μmol/L)、磺胺苯吡唑(0.0075~7.5μmol/L)、噻氯匹定(0.0176~17.6μmol/L)、奎尼丁(0.0008~0.75μmol/L)和酮康唑(0.0003~0.3 μmol/L)]分别与“2.2”项下混合底物共同孵化,对照加入等体积100mmol/L PBS代替,每个样品平行操作3次,余下孵育处理程序同”2.2”项下方法,测定同”2.3”项下方法。使用GraphPad Prism v5.0软件按照非线性回归,作图并计算IC50。
2.5 10种心血管类中药注射剂半数抑制体积分数/质量浓度(IC50)的测定
取“2.1”项下10种心血管类中药注射剂9个不同质量浓度的工作液,逐个与“2.2”项下混合底物及体外人肝微粒体孵育体系共同孵化,对照加入等体积100mmol/L的PBS代替,每个样品平行操作3次,余下孵育处理程序同“2.2”项下方法,测定同“2.3”项下方法。使用GraphPad Prism v5.0软件按照非线性回归,作图并计算IC50。
3 结果
3.1 阳性抑制剂对CYP7个亚型活性的抑制作用
为评价方法的合理性,在测定药物对CYP 7个亚型抑制作用的同时也测定了阳性抑制剂的抑制作用。结果表明,CYP1 A2、CYP2 B6、CYP2 C8、CYP2 C9、CYP2 C19、CYP2 D6和CYP3 A4/5的阳性抑制剂呋拉茶碱、塞替派、槲皮素、磺胺苯吡唑、噻氯匹定、奎尼丁和酮康唑对相应酶型均表现出明显的抑制作用。阳性抑制剂的IC50见表2。
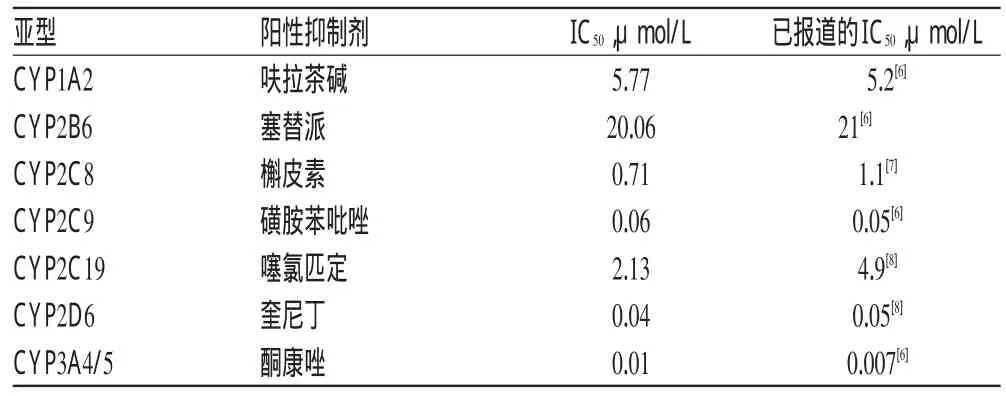
表2 阳性抑制剂的IC50Tab 2 IC50of positive inhibitors
3.2 10种心血管类中药注射剂对CYP7个亚型活性的抑制作用
10种心血管类中药注射剂中DH对7种CYP均有明显抑制作用,其中对CYP2 C8的抑制作用最强,其次依次是CYP1 A2、CYP3 A4/5、CYP2 B6、CYP2 D6、CYP2 C19和CYP2 C9;HH对CYP2 C8有明显抑制作用;其余8种中药注射剂对CYP各亚型活性无明显抑制作用(IC50均大于日用药量)或无抑制作用。DH对CYP7种亚型与HH对CYP2 C8的体外抑制效果见图1;心血管类中药注射剂IC50见表3。
4 讨论
Cocktail探针药物法主要用于评价药物对CYP活性的影响,该方法可以使多个代谢途径的信息综合反映在单个实验过程当中,明显地缩短分析周期,提高分析效率,节省人力物力,更重要的是这种方法可以减少个体间差异对研究结果的影响[9]。本研究中选用的7种CYP的已知特异性抑制剂,分别与混合探针底物共同孵化,计算得到的IC50与文献[6-8]报道值具有较好的一致性,表明笔者建立的Cocktail探针药物法可以用于研究药物对CYP 7种亚型的体外抑制作用。

图1 DH对CYP7种亚型与HH对CYP2 C8的体外抑制效果A~G.DH对CYP7种亚型的体外抑制效果;H.HH对CYP2 C8的体外抑制效果Fig 1 Inhibitory effects of Danhong injection on 7 subtypes of human CYPand that of Honghua injection on CYP2 C8A~G.Inhibitory effects of Danhong injection on 7subtypes of human CYP;H.Innhibitory effects of Honghua injection on CYP2 C8
在预试验中,笔者采用10种心血管类中药注射剂的日用药量研究了对CYP各亚型的抑制作用,结果显示不同中药注射剂对CYP活性影响差异大,同一种中药注射剂对7种CYP亚型活性影响也不尽相同,若选用统一的体积分数/质量浓度范围进行测定,将会影响IC50的计算。因此根据上述抑制作用结果,针对每种中药注射剂筛选出不同的体积分数/质量浓度范围进行测定。文献[4,10]采用在体外微粒体孵育体系中直接加入不同体积比的注射剂评估其对CYP各亚型的影响,并计算出相应的IC50(以加入中药注射剂原液体积占孵育体系的总体积的体积分数表示)。笔者采用此法计算出了8种心血管类中药注射剂对CYP 7个亚型的IC50。另外2种注射剂,DSDF和DZHS用适当溶媒稀释后作为注射液进行上述测定,最后经换算以μg/ml表示IC50。表3中的日用药体积分数/质量浓度为这些心血管类中药注射剂说明书中规定的临床每日用药剂量与人体中血液5 L的比值,DH对7种CYP的IC50范围为0.09%~0.98%,均低于日用体积分数1.6%。提示在正常剂量下,DH对CYP1 A2、CYP2 B6、CYP2 C8、CYP2 C9、CYP2 C19、CYP2 D6和CYP3 A4/5均可能有抑制作用。余小翠等[11]研究表明,DH对大鼠肝微粒体CYP1 A2活性有抑制作用,其IC50为0.54%且为混合型抑制,对CYP2 C9有弱抑制作用,对CYP2 D6、CYP2 E1、CYP3 A4活性无明显影响。本研究中DH对CYP1 A2的IC50为0.49%,结果与上述文献相近。大鼠与人共有的CYP亚型仅有CYP1 A2与CYP2 E1[12],Turpeinen M等[13]的体外肝微粒体研究结果表明,与人CYP1 A2、CYP3 A活性相关性好的动物模型分别为大鼠和小鼠,这可能是导致丹红注射液对CYP2 C9、CYP2 D6和CYP3 A4/5结果与文献[11]差异的原因,最终还需临床试验进一步验证。

表3 心血管类中药注射剂IC50Tab 3 IC50of cardiovascular TCM injections
研究表明,临床近90%的化学药物经由CYP1 A2、CYP2 B6、CYP2 C8、CYP2 C9、CYP2 C19、CYP2 D6和CYP3 A4/5这7种CYP亚型代谢[3],因此此类化学药物联合使用DH或HH时需谨慎,以避免产生代谢性药物相互作用导致的药物不良反应。
[1]Zhang L,Reynolds KS,Zhao P,et al.Drug interactions evaluation:an integrated part of risk assessment of therapeutics[J].Toxicol Appl Pharmacol,2010,243(2):134.
[2]Wienkers LC,Heath TG.Predicting in vivo drug interactions from in vitro drug discovery data[J].Nat Rev Drug Discov,2005,4(10):825.
[3]Zanger UM,Schwab M.Cytochrome P450enzymes in drug metabolism:regulation of gene expression,enzyme activities,and impact of genetic variation[J].Pharacol Ther,2013,138(1):103.
[4]韩永龙,孟祥乐,李丹,等.清开灵注射液及其主要成分黄芩苷和栀子苷对人肝微粒体CYP450酶6种亚型的体外抑制作用研究[J].中国药学杂志,2011,46(19):1486.
[5]De Bock L,Boussery K,Colin P,et al.Development and validation of a fast and sensitive UPLC-MS/MS method for the quantification of six probe metabolites for the in vitro determination of cytochrome P450activity[J].Talanta,2012(89):209.
[6]Kozakai K,Yamada Y,Oshikata,et al.Reliable high-throughput method for inhibition assay of 8cytochrome P450isoforms using cocktail of probe substrates and stable isotope-labeled internal standards[J].Drug Metab Pharmacokinet,2012,27(5):520.
[7]Otten J,Hingorani G,Hartley D,et al.An in vitro,high throughput,seven CYP cocktail inhibition assay for the evaluation of new chemical entities using LC-MS/MS[J].Drug Metab Letters,2011,5:17.
[8]李丹.五味子及其制剂与尼洛替尼的代谢性药物相互作用研究[D].上海:上海中医药大学,2012.
[9]王亮,郭姣,石忠峰,等.“Cocktail”探针药物法的研究思路与应用[J].辽宁中医药大学学报,2011,12(11):30.
[10]樊慧蓉,和凡,刘昌孝.“Cocktail”探针药物法用于评价细胞色素P450同工酶影响的研究进展[J].中国药学杂志,2006,41(14):1045.
[11]余小翠,黄丽军,刘高峰,等.丹红注射液对大鼠肝微粒体5种CYP亚型酶活性的影响[J].医药导报,2012,31(3):277.
[12]Martignoni M,Groothuis GM,de Kanter R.Species differences between mouse,rat,dog,monkey and human CYP-mediated drug metabolism,inhibition and induction[J].Expert Opin Drug Metab Toxicol,2006,2(6):875.
[13]Turpeinen M,Ghiciuc C,Opritoui M,et al.Predictive value of animal models for human cytochrome P450(CYP)-mediated metabolism:a comparative study in vitro[J].Xenobiotica,2007,37(12):1367.

