兴国红鲤MHCⅡ类α基因多态性、表达及其与鱼体抗病力关系的分析
刘 俊 刘至治 王成辉 项松平 王 剑
兴国红鲤MHCⅡ类α基因多态性、表达及其与鱼体抗病力关系的分析
刘 俊1刘至治1王成辉2项松平3王 剑3
(1. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306; 3. 浙江龙泉省级瓯江彩鲤良种场, 龙泉 323700)
对41尾感病和22尾抗病兴国红鲤的308个有效克隆进行测序, 获得171条不同的MHC Ⅱ类α基因编码序列, 分属26个不同的等位基因, 其中Cyca-DXA24—Cyca-DXA36为新发现的13个等位基因。MHCⅡ类α基因片段的长度为624 bp, 包括第1—4个外显子, 分别编码信号肽、α1和α2结构域及连接肽/跨膜区。α1结构域的变异明显大于α2结构域, 表现在α1结构域中核苷酸和氨基酸变异位点比例(55.16%和79.76%)明显高于α2结构域的变异位点比例(45.96%和68.42%)。α1结构域的PBR区的非同义碱基替换率(N)与同义碱基替换率(S)的比值(=N/S)为5.742, 远远高于非抗原结合位点(non-PBR)及α2结构域的0.755、0.592, 揭示兴国红鲤MHC Ⅱ类α基因的α1结构域在进化过程中受到正向选择作用。等位基因Cyca-DXA24 (<0.01)与兴国红鲤对嗜水气单胞菌的抗性相关, 等位基因Cyca-DXA3 (<0.05)、Cyca-DXA4 (<0.01)、Cyca-DXA6 (<0.05)、Cyca-DXA33 (<0.05)与兴国红鲤对嗜水气单胞菌的易感性相关。荧光定量PCR结果表明, MHCⅡ类α基因在健康兴国红鲤的肾、肝、鳃等10个组织均能普遍表达。人工感染嗜水气单胞菌后, 肾、肝、脾3个组织中的MHCⅡ类α基因的表达量均发生了不同程度的变化, 表明MHCⅡ类α分子在兴国红鲤的免疫反应中起到重要作用。
兴国红鲤; MHC; 多态性; 表达; 抗病力
兴国红鲤(var.)为“江西三红”之一, 其分布于江西省兴国县, 已有1300余年的养殖历史[1]。据报道, 从1972—1984 年, 相关单位已对其进行了6代定向选育, 培育出性状稳定的品种[2], 目前已选育至20代。兴国红鲤是重要的杂交亲本, 在我国鱼类杂交育种中具有重要作用。
在淡水养殖中, 嗜水气单胞菌为主要病原菌之一, 目前没有针对该菌的有效疫苗[3, 4]。因此, 有必要从绿色水产的角度出发, 努力寻找一种安全的新方法, 增加鱼体对嗜水气单胞菌等病原菌的抵抗力。研究证明, 主要组织相容性复合体(Major histocompatibility complex, MHC)在鱼类机体的免疫中发挥着极为重要的作用, 与许多疾病的抗性、易感性、免疫应答都密切相关, 已成为抗病力相关研究的重要候选基因[5—8]。本研究以兴国红鲤为对象, 人工感染嗜水气单胞菌后, 分析MHCⅡ类α基因序列多态性与抗病力之间的关系, 同时采用荧光定量PCR技术, 检测健康鱼体不同组织中MHCⅡ类α基因mRNA表达水平上的差异性, 并分析鱼体感染嗜水气单胞菌后, MHCⅡ类α基因在肾、肝、脾等组织中mRNA水平的变化。研究结果将为兴国红鲤抗病基因的筛选及抗病育种提供依据。
1 材料与方法
1.1 材料
2010年10月从江西省兴国红鲤良种场引入2 龄兴国红鲤, 养殖于浙江省龙泉省级瓯江彩鲤良种场。2011年8月, 随机选取健康鱼(体重约601 g), 腹腔注射嗜水气单胞菌(由上海海洋大学国家水生动物病原库提供)进行人工感染。具体方法: 实验组鱼63尾, 每尾每100 g体重注射0.1 mL浓度为1.5×109cfu/mL的嗜水气单胞菌; 对照组鱼15尾, 每尾则注射相应量的磷酸生理盐水。13h后实验组鱼开始死亡, 而对照组鱼在整个实验过程中生长正常, 无任何生病或死亡症状。这里, 感染96h后不出现发病症状的个体为抗病个体, 而96h内出现口鳃出血、体表出血、皮肤溃疡、游动迟缓等症状且直至临死的个体为感病个体。最终, 共得到41尾感病和22尾抗病个体。在感染过程中, 随着感病个体的死亡, 及时取肾、肝、脾等组织, 迅速放入液氮中冻存, 转至−80℃冰箱备用; 而抗病个体的相关组织, 则在感染完毕后采集。
1.2 方法
总RNA的提取和cDNA的合成 Trizol法提取实验鱼肾中的总RNA, 1%琼脂糖凝胶电泳检测RNA的完整性, 分光光度计测定RNA浓度及OD值, 要求在1.8—2.0。以总RNA为模板, 利用反转录试剂盒PrimeScript First Strand cDNA Synthesis Kit (Takara)合成cDNA。
引物设计, PCR扩增, 产物的纯化、克隆及测序 根据van Erp[9]已获得的鲤MHCⅡ类α基因(GenBank登录号为X95432), 设计一对特异性引物: DXAF (5′-TGCTTATGCTCGCTCTTATTGTC-3′)和DXAR (5′-ACCCACTCCACAAAACACAGCTG-3′) (由上海生工生物工程服务有限公司合成), 用于扩增荷包红鲤MHCⅡ类α基因的片段。PCR反应总体积为25 μL, 包括: 1.0 μL cDNA (100 ng), 1.0 μL上、下游引物 (10 μmol/L), 2.0 μL dNTP Mixture (2.5 mmol/mL), 2.5 μL 10×Buffer, 0.6 μLDNA聚合酶(Tiangen, 5 U/μL), 16.9 μL去离子水。PCR 程序如下: 94℃预变性3min; 94℃1min、54℃1min、72℃2min, 35 个循环; 72℃延伸10min。所有PCR 反应均在Mastercycler ep gradient S (Eppendorf)型PCR仪上进行。
参照文献[10]的方法, 进行PCR产物的纯化、目的片断的连接和转化、阳性克隆的鉴定等操作。每尾个体随机挑选5个阳性克隆, 由上海美吉生物医药科技有限公司的ABI3730测序仪测序。
实时荧光定量 PCR 分别在人工感染后12、24、48、72和96h 随机选取3尾兴国红鲤, 取其肾、肝和脾组织, 以及对照组鱼的10个组织(脑、眼、鳃、心脏、肠、肾、肝、肌肉、脾和胃)。提取各组织RNA, 选取高质量且等量的RNA, 根据Prime ScriptTMRT Master Mix (Perfect Real Time) (TaKaRa)试剂盒附带的说明书, 进行反转录实验制备cDNA模板。PCR 反应体系: 5× PrimeScript RT Master Mix 2 µL、500 ng RNA 最后加RNase Free dH2O 至10 μL。反应条件: 37℃ 15min, 85℃ 5s, 4℃保存。
实时荧光定量PCR使用SYBR Premix ExTMⅡ(Perfect Real Time) (TaKaRa)试剂盒, 反应扩增引物为DXA-ex-F (5′-AGGTGATGTGGTGCTGGGTG-3′)和DXA-ex-R (5′-AGCGAGGAGAAGATGTTGAAGG-3′), 产物长度为171 bp。20 μL PCR 反应体系为: 2 µL cDNA、10 µL SYBR Premix ExTMⅡ、0.4 µL ROXⅡ、0.8 µL上下游引物(10 μmol /L)和6.0 µL ddH2O。PCR 扩增条件为: 95℃预变性30s; 95℃ 5s, 60℃ 34s, 40个循环; 60—95℃ 15min进行溶解曲线检测。每个样本3个重复, 空白对照采用ddH2O作为模板。目的基因的标准曲线以肾组织的cDNA 10 倍系列(1.0 × 10–1、1.0 ×10–2、1.0 ×10–3、1.0 ×10–4、1.0 ×10–5倍)稀释为模板得到, 通过标准曲线来检测实时荧光定量PCR引物的特异性和试验的可靠性。反应在7500实时荧光定量PCR仪(Applied Biosystems)上进行。每个目的基因的相对表达以内参β-actin为参考基因, 引物序列: β-actin-ex-F (5′-TGCTATGTGGCTCTTGA- CTT-3′)和β-actin-ex-R (5′-CTGGGCACCTGAACCT- CT-3′), 产物长度为127 bp。数据由7500PCR 仪自带的软件分析得到, 数据处理采用2–△△Ct法[11]。
MHCⅡ类α基因的命名与数据分析 已知鲤MHCⅡα有MHC-DXA一种基因型, 故兴国红鲤MHCⅡ类α基因的命名参照文献[10]中的方法进行。
登录NCBI, 用BLAST对所获得的序列进行同源检索, 确定所得的基因片段。用Clustal X[12]对蛋白质序列进行多序列比对。利用MEGA 4.0[13]分析核苷酸序列和氨基酸序列的变异位点, 确定等位基因, 计算核苷酸的错义和同义替换率、氨基酸的组成比例; 参照人类HLAⅡ类分子的晶体三维结构[14], 对获得的兴国红鲤MHCⅡ类基因序列的α1结构域的抗原结合位点(PBR)进行界定, 然后用MEGA 4.0软件中改进的Nei-Gojobori (Jukes-Cantor)方法, 计算非同义碱基替换率(N)和同义碱基替换率(S)的比值(=N/S)。利用DnaSP 5.0[15]进行第二外显子和第三外显子序列的多态性分析。
2 结果
2.1 兴国红鲤MHCⅡ类α基因序列测定
本研究对63尾兴国红鲤的308个有效克隆进行了测序与分析。所得序列经NCBI中BLAST同源比对, 确认为MHCⅡ类α基因片段。序列经对位排列和变异检测后, 没有发现任何插入、缺失或异常的密码子。该核苷酸序列长度为624 bp, 编码11个氨基酸的部分信号肽、84个氨基酸的完整α1结构域、95个氨基酸的完整α2结构域和18个氨基酸的完整连接肽及部分跨膜区, 共208个氨基酸。推断的氨基酸序列经比对后, 分属26个不同的等位基因, 其中有13个等位基因为新发现的等位基因, 命名为Cyca-DXA24*01—Cyca-DAB36*01 (GenBank登陆号为KF154087-KF154099)。
2.2 兴国红鲤MHCⅡ类α基因多态性
分析表明, 兴国红鲤MHCⅡ类α的26个等位基因所包含的亚型数量多少不均。如等位基因Cyca-DXA24含有47个亚型, 频率高达40.58%; 而Cyca-DXA19的亚型仅有1个, 频率为0.32%。此外, 各亚型的出现频率高低不一。在总共171个亚型中, Cyca-DXA24*01出现的频率最高, 为24.03%, 其次是Cyca-DXA4*01 (4.87%), 其余大多数亚型仅出现一次(0.32%)。值得注意的是, 我们发现单一个体中最多存在5个等位基因, 表明兴国红鲤个体中至少存在3个DXA基因座。
在所得的MHCⅡ类α基因核苷酸序列中, 分别检测到297个核苷酸变异位点和197个简约信息位点。MHCⅡ类α基因的核苷酸变异位点比例为47.60%(297/624), 而氨基酸相对应的值则高达69.23% (144/208) (表1)。MHCⅡα序列间的碱基及氨基酸变异范围分别为0—9.6%和0—16.8%, 平均值为5.3%和9.5%。此外, α1结构域的核苷酸/氨基酸位点变异率为55.16%/79.76%, 明显大于α2结构域的45.96%/68.42% (表1)。MHCⅡ类α 的信号肽、CP及TM变异都不大, 属于保守序列。对全部序列的分析表明, 兴国红鲤MHCⅡ类α基因的单倍型多样度(H)、核苷酸多样度(P)及平均核苷酸差异数目()分别是0.9831、0.05332、33.275。
分析表明(表2), 在含有21个氨基酸位点的PBR区中, 变异位点数高达20个(95.24%), 而在non-PBR区的63个位点中, 变异位点数却只有46个(73.01%), PBR区的变异率明显高于non-PBR。计算表明, α1结构域的PBR区的值为5.742远大于1, 而它们的non-PBR区(0.755)和α2结构域(0.592)的值却都小于1, 表明兴国红鲤MHCⅡα基因(尤其是α1结构域)在进化过程中受到正向选择(Positive selection)作用。
2.3 兴国红鲤MHCⅡ类α基因与抗病力的关系
在所得的26个不同的MHCⅡ类α基因中(图1), 其中有11个等位基因在感病群体和抗病群体中都出现, 剩余的Cyca-DXA3、Cyca-DXA5、Cyca- DXA8、Cyca-DXA10、Cyca-DXA17、 Cyca-DXA19、Cyca-DXA20、Cyca-DXA22、Cyca-DXA30—Cyca- DXA36等15个等位基因则为感病群体所特有, 没有发现只存在于抗病群体的等位基因。等位基因Cyca-DXA3、Cyca-DXA33的频率为9.00%和5.00%,显著存在于感病群体中(<0.05); 等位基因Cyca- DXA4、Cyca-DXA6在感病群体中出现的频率(27.00%、6.50%), 分别极显著(<0.01)和显著(<0.05)地高于抗病群体中出现的频率(3.70%、0.93%); 等位基因Cyca-DXA24在抗病群体中出现的频率(81.48%)极显著(<0.01)高于感病群体中出现的频率(18.50%)。
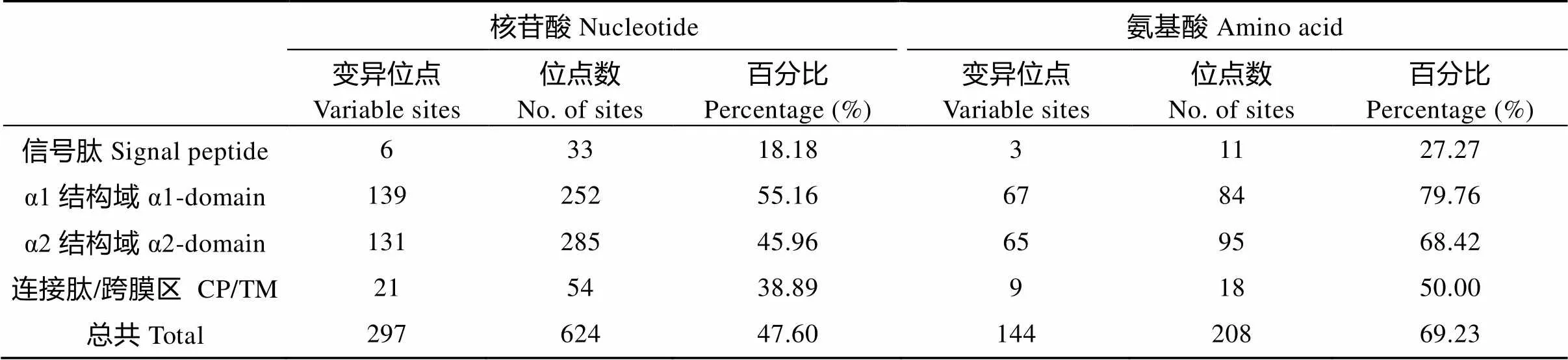
表 1 兴国红鲤核苷酸和氨基酸的变异位点
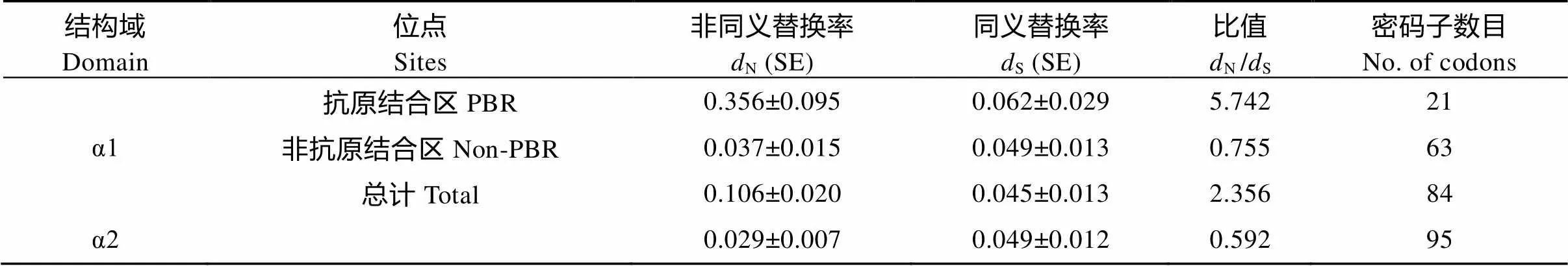
表2 兴国红鲤MHCⅡ类基因α1结构域的PBR、non-PBR及α2结构域的dS和dN值
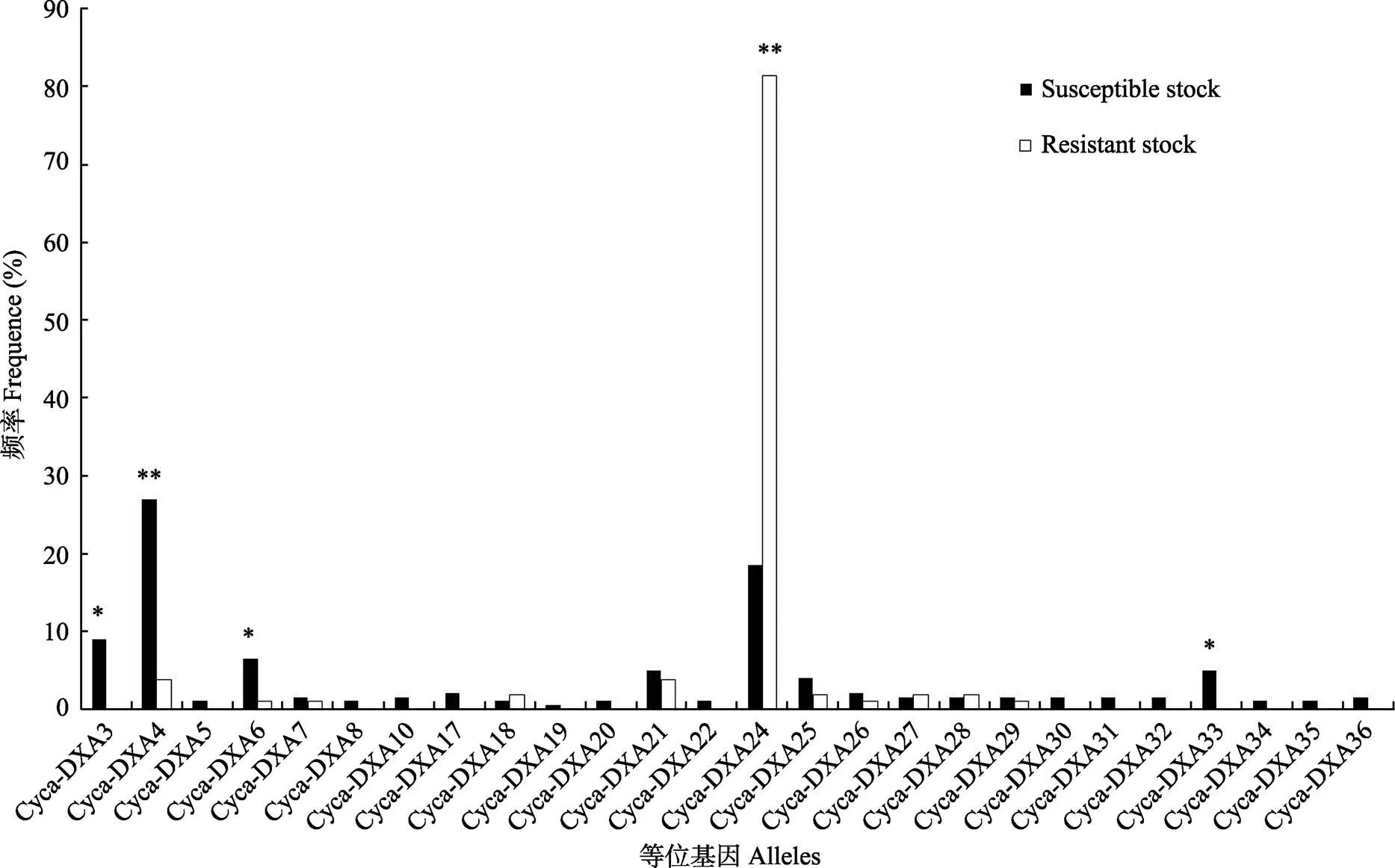
图 1 不同等位基因在抗病群体与感病群体的分布频率(%)
**< 0.01;*< 0.05
2.4 兴国红鲤MHCⅡ类α基因mRNA在组织中的表达
以兴国红鲤的肾cDNA为模板, 将模板做10倍梯度稀释, 通过引物β-actin-ex-F、β-actin-ex-R 和DXA-ex-F、DXA-ex-R 进行实时荧光定量PCR, 制作内参基因和目的基因的标准曲线。经优化, β-actin和MHCⅡ类α基因的扩增效率分别为95.15%和96.18%, 标准曲线的相关系数都为1, 斜率分别为–3.444和–3.417, 表明可以用2–△△法进行相对定量分析。溶解曲线中没有杂峰出现, 未出现非特异性扩增, 试验条件达到实验要求, 可靠性较高。
通过实时荧光定量PCR技术的分析结果表明, 兴国红鲤的10 个组织中均扩增出MHCⅡ类α 基因目的片段, 但表达量有所不同, 其中较强表达于肾、肝、鳃、肠、脾, 中等强度表达于心脏、胃、脑, 而在眼和肌肉中表达较弱(图2A)。
人工感染嗜水气单胞菌后的不同时期, 兴国红鲤肾、肝、脾这三个组织中的MHCⅡ类α 基因表达水平均发生了不同程度的变化(图2B)。在肾组织中, MHCⅡ类α基因表达水平在12h表达水平最高, 接着发生下降, 在72h表达量最低, 呈先上升后下降的变化趋势。在肝和脾组织中, MHCⅡ类α基因表达水平都是先下降后上升的趋势, 96h之后恢复到原来的水平, 只是肝、脾组织中最低表达水平分别在感染后48h和24h。
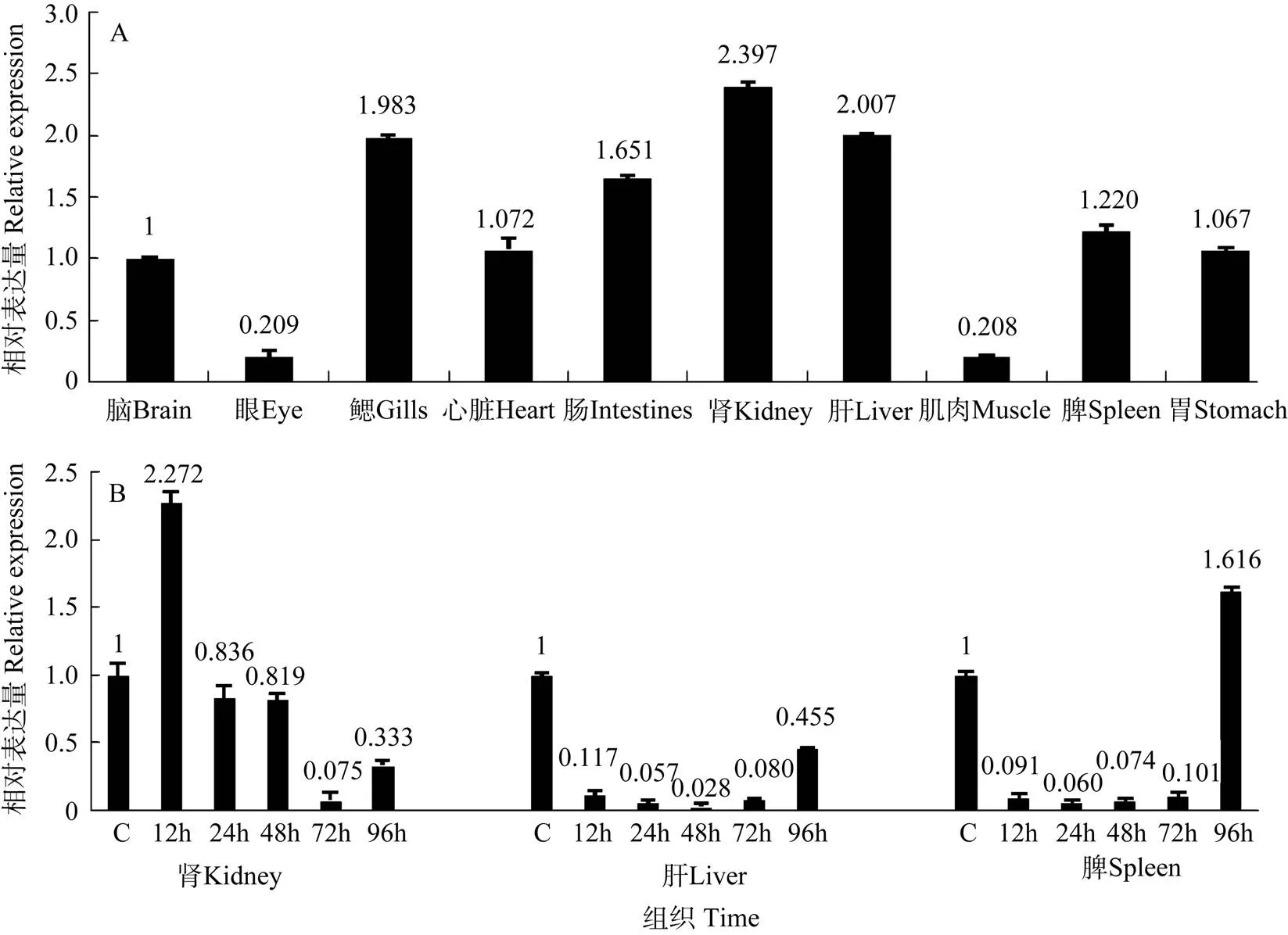
图 2 MHCⅡ类α 基因在健康(A)和感染(B)后兴国红鲤的各组织中的相对表达量
3 讨论
MHC 是基因组中多态性最丰富的区域之一, 这主要表现为多基因座及每个基因座含有相当数量的等位基因[10]。本研究发现每尾鱼体中存在1—5个等位基因, 表明兴国红鲤MHCⅡ类α基因至少含有3个基因座。这一结果与条纹鲈()[16]、大菱鲆()[17]、牙鲆()[18]等的研究结果不同, 这些鱼类的个体中含有MHCⅡ类等位基因的数量最多不超过4个, 推测至少含有2个基因座。而对于同是鲤的全红体色瓯江彩鲤(var.), 李雪松等[8]的报道推测单个个体中也是至少含有2个基因座。可见, 鱼类物种间含有MHC等位基因座的数量, 仅靠测序还无法确定, 需要设计核酸探针进行原位杂交来验证。关于鱼类MHCⅡ类α基因多态性的研究已有不少报道。Stet,.[19]从84尾大西洋鲑个体中检测到7个等位基因; 徐田军和陈松林[20]从45尾牙鲆个体得到129条序列, 共编码30个等位基因; Pang,.[21]从6尾尼罗罗非鱼()个体检测到10个等位基因。本实验从63尾兴国红鲤中共得到26个不同的等位基因, 虽较牙鲆、尼罗罗非鱼的多态性低, 却远远高于大西洋鲑。不同鱼类MHCⅡ类α基因的多态性高与低, 可能是该物种的故有特征, 或者是跟它们的生长进化史有关, 如奠基者效应、基因漂流、基因选择等。

MHC是一个与抗病相关的基因家族, 不同的等位基因可能具有不同的抗病能力。作为抗病相关的分子标记候选基因, MHC已经被国内外学者越来越多地应用于各种海、淡水鱼类的抗病辅助育种的研究中。有关于MHCⅡ类α 基因与鱼体抗病力之间关系的研究, 多集中于牙鲆[18]与大西洋鲑[26, 27]。Xu,.[18]在研究牙鲆MHCⅡ类α基因与鳗弧菌()抗病力的关系时, 发现Paol-DAA* 1301、Paol-DAA*1401、Paol-DAA*2201与抗病性相关, Paol-DAA*1001、Paol-DAA*1501与感病性相关; Kjøglum,.[26]研究MHCⅠ类和MHCⅡ类联合基因型与大西洋鲑疖病(Furunculosis)的抗病性的关系, 发现含有DAA*0301的鱼抵抗力显著强于DAA*0201的鱼; Wynne,.[27]发现, 含有Sasa-DAA-3'UTR中单倍型239/259和259/259的大西洋鲑, 对阿米巴鳃病的感染度明显低于其他不含有该单倍性的个体。本研究在探讨兴国红鲤MHCⅡ类α 基因与嗜水气单胞菌抗性的相关性时, 获得了5个与鱼体抗病力相关的等位基因, 其中Cyca- DXA3、Cyca-DXA4、Cyca-DXA6、Cyca-DXA33与兴国红鲤对嗜水气单胞菌的易感性相关, 而Cyca- DXA24则与抗病性相关。虽然不能排除会有另外的连锁基因可能导致本研究的结果, 但它们为筛选抗病相关MHCⅡ类α 基因标记提供了重要的参考依据。
许多研究表明, 不同鱼类的MHCⅡ类α基因的mRNA表达水平存在组织特异性。Srisapoome,.[28]检测牙鲆的MHCⅡ类α基因在鳃、脾、肾、肠、胃中表达较高, 在肌肉和眼中表达较低; Li,.[29]的研究显示, 在健康的圆斑星鲽()的肾、鳃、脾中表达量最高, 在肝、心脏和皮肤中度表达, 在肌肉和脑中表达量最低。在本研究中, 兴国红鲤MHCⅡ类α基因的表达特异性, 与上述研究结果基本相符。肾和脾是最重要的免疫器官, 肝和黏膜上皮组织等也是重要的免疫防线, 而肌肉组织的免疫功能则是较低的。可见, 鱼类MHCⅡ类α基因在不同组织中表达量的高低与其免疫细胞的分布有关, 揭示肾、肝、鳃、脾、肠等在鱼类免疫过程中起重要作用。
致谢:
在感染实验及样品采集过程中, 本院研究生毕祥、李雪松、赵雪锦、朱丽艳、胡建尊等同学提供了很多帮助, 在此表示衷心感谢。
[1] Wang C H, Li S F, Zou S M. RAPD analysis of genetic diversity of red common carp in China [J]., 2003, 27(3): 329—331 [王成辉, 李思发, 邹曙明. 中国红鲤遗传多样性的PAPD分析. 水生生物学报, 2003, 27(3): 329—331]
[2] Lou Y D, Sun J C. Progress on studies of origin and genetic diversity of three breeds of red carp in Jiangxi Province [J]., 2001, 25(6): 570—575 [楼允东, 孙景春. 江西三种红鲤起源与遗传多样性研究进展. 水产学报, 2001, 25(6): 570—575]
[3] Poobalane S, Thompson K D, Diab A,. Protein expression byduring growth inand in[J]., 2008, 45(1): 60—69
[4] Zhang X J, Yang W M, Li T T,. The genetic diversity and virulence characteristics ofisolated from fishponds with disease outbreaks in Hubei province [J]., 2013, 37(3): 458—466 [张旭杰, 杨五名, 李彤彤, 等. 湖北地区暴发病池塘中嗜水气单胞菌的遗传多样性和毒力特征研究. 水生生物学报, 2013, 37(3): 458—466]
[5] Zhao H J, Li H, Yu H,. Advance of MHC class II genes associated with immunity and disease resistance in fish [J]., 2010, 3(5): 111—115 [赵红娟, 李华, 于辉, 等. 鱼类MHC II类基因与免疫抗性的研究进展. 水生态学杂志, 2010, 3(5): 111—115]
[6] Juul-madsen H R, Glumann J, Madsn H O,. MHC class II beta-chain expression in the rainbow trout [J]., 1992, 35(6): 687—694
[7] Hetland D L, Jørgensen S M, Skjødt K,. In situ localization of major histocompatibility complex class I and class II and CD8 positive cells in infectious salmon anaemia virus (ISAV)-infected Atlantic salmon [J]., 2010, 28(1): 30—39
[8] Jorgensen S M, Hetland D L, Press C M,. Effect of early infectious salmon anaemia virus (ISAV) infection on expression of MHC pathway genes and type I and II interferon in Atlantic salmon (L.) tissues [J]., 2007, 23(3): 576—588
[9] van Erp S H M, Egberts E, Stet R J M. Characterization of class II A and B genes in a gynogenetic carp clone [J]., 1996, 44(3): 192—202
[10] Li X S, Liu Z Z, Zhao X J,. Major histocompatibility complex DAB allele polymorphism and it association with resistance/susceptibility toin “whole red” color patterns ofvar.[J]., 2011, 35(9):1293—1301 [李雪松, 刘至治, 赵雪锦, 等. “全红”体色瓯江彩鲤MHC-DAB 基因多态性及其与鱼体抗病力关系的分析. 水产学报, 2011, 35(9): 1293—1301]
[11] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–△△CTmethod [J]., 2001, 25(4): 402—408
[12] Thompson J D, Dibson T J, Plemniak F,The CLUSTAL X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J]., 1997, 25(24): 4876—4882
[13] Tamura K, Dudley J, Nei M,. MEGA 4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]., 2007, 24(28): 1596—1599
[14] Brown J H, Jardetzky T S, Gorga J C,. Three- dimensional structure of the human class II histocompatibility antigen HLA-DR [J]., 1993, 364(6432): 33—39
[15] Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data [J]., 2009, 25(11): 1451—1452
[16] Hardee J J, Godwin U, Benedetto R,. Major histocompatibility complex class II A gene polymorphism in the striped bass [J]., 1995, 41(4): 229—238
[17] Zhang Y X, Chen S L. Molecular identification, polymorphism, and expression analysis of major histocompatibility complex class IIA and B genes of turbot () [J]., 2006, 8(6): 611—623
[18] Xu T J, Chen S L, Zhang Y X. MHC class IIa gene polymorphism and its association with resistance/ susceptibility toin Japanese flounder () [J]., 2010, 34(10): 1042—1050
[19] Stet R J M, Vries B D, Mudde K,. Unique haplotypes of co-segregating major histocompatibility class II A and class II B alleles in Atlantic salmon () give rise to diverse class II genotypes [J], 2002, 54(5): 320—331
[20] Xu T J, Cheng S L.Genomic structure of DAAgene and polymorphism within MHC-DAAalleles in Japanese flounder () [J]., 2009, 31(10): 1020—1028 [徐田军, 陈松林. 牙鲆MHC-DAA 结构及其等位基因多态性. 遗传, 2009, 31(10): 1020—1028]
[21] Pang J C, Gao F Y, Lu M X,. Major histocompatibility complex class IIA and IIB genes of Nile tilapia: genomic structure, molecular polymorphism and expression patterns [J]., 2013, 34(2): 486—496
[22] Cuesta A, Esteban M A, Meseguer J. Cloning, distribution and up-regulation of the teleost fish MHC class II alpha suggests a role for granulocytes as antigen-presenting cells [J]., 2006, 43(8): 1275—1285
[23] Kruiswijk C P, Hermsen T, Fujiki K,. Analysis of genomic and expressed major histocompatibility class Ia and class II genes in a hexaploid Lake Tana African ‘large’ barb individual () [J], 2004, 55(11): 770—781
[24] Xu T J, Sun Y N, Shi G,. Characterization of the major histocompatibility complex class II genes in Miiuy Croaker [J]., 2011, 6(8): e23823
[25] Parham P, Ohta T. Population biology of antigen presentation by MHC class I molecules [J]., 1996, 272(5258): 67—74
[26] Kjøglum S, Larsen S, Bakke H G,. The effect of specific MHC class I and class II combinations on resistance to furunculosis in Atlantic Salmon () [J]., 2008, 67(2): 160—168
[27] Wynne J W, Cook M T, Nowak B F,. Major histocompatibility polymorphism associated with resistance towards amoebic gill disease in Atlantic salmon (L)[J]., 2007, 22(6): 707—717
[28] Srisapoome P, Ohira T, Hirono I,Cloning, characterization and expression of cDNA containing major histocompatibility complex class I, IIα and IIβ genes of Japanese flounder[J]., 2004, 70(2): 264—276
[29] Li H J, Jiang L X, Han J B,. Major histocompatibility complex class IIA and IIB genes of the spotted halibut: genomic structure, molecular polymorphism, and expression analysis [J]., 2011, 37(4): 767—780
THE ANALYSIS OF THE POLYMORPHISM AND EXPRESSION OF MHC CLASSGENE AND ITS ASSOCIATION WITH RESISTANCE/SUSCEPTIBILITY TOIN XINGGUO RED COMMON CARP
LIU Jun1, LIU Zhi-Zhi1, WANG Cheng-Hui2, XIANG Song-Ping3and WANG Jian3
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China; 2. Key Laboratory of Freshwater Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Agriculture, Shanghai 201306, China; 3. Oujiang Color Common Carp Provincial Farm, Longquan 323700, China)
We cloned 171 sequences of MHC class IIα gene were determined from 41 susceptible and 22 resistant individuals ofvar.. These sequences belonged to 26 alleles, thirteen of which were novel (Cyca-DXA24-Cyca-DXA36). The total length of the sequence was 624 bp, consisting of a 33 bp exon1, a 252 bp exon2, a 285 bp exon3, and a 54 bp exon4. These exons encoded a partial signal peptide, a α1 domain, a α2 domain and a connecting peptide (CP)/partial transmembrane (TM), respectively. The mutation-Prone positions of nucleotide or amino acid sites in α1 domain (55.16%, 79.76%) significantly out number than those in α2 domain (45.96%, 68.42%). Thevalues (=N/S) were 5.742 for peptide-binding region (PBR), 0.755 for non-PBR in the α1 domain and 0.592 for the α2 domain, implying that the positive selection pressure probably had occurred in the PBR region of the α1 domain. Cyca-DXA24 (<0.01) was significantly correlated with the carp’s resistance to, while Cyca-DXA3 (<0.05), Cyca-DXA4 (<0.01), Cyca-DXA6 (<0.05) and Cyca-DXA33 (<0.05) alleles were significantly associated with the fish’s susceptibility to the disease. Real-time quantitative PCR demonstrated that MHC IIα genes were ubiquitously expressed in ten tissues. The expression was up-regulated in kidney, down-regulated in liver and spleen during infection. Our results indicated that the MHC class IIα gene might play an important role in the immune reactions ofvar..
var.; MHC; Polymorphism; Expression; Disease resistance
2013-08-09;
2013-11-02
农业部公益性行业科研专项(200903045); 上海市教育委员会科研创新基金(11YZ152); 上海高校水产一流学科建设项目资助
刘俊(1987—), 女, 河南信阳人; 硕士研究生; 研究方向为鱼类分子进化与免疫遗传学。E-mail: liujunhnsd@126.com
刘至治, E-mail: zzliu@shou.edu.cn; 王成辉, E-mail: wangch@shou.edu.cn
Q346+.5
A
1000-3207(2014)02-0241-08
10.7541/2014.36

