双氟沙星对异育银鲫血脑屏障渗透性及消除规律
阮记明 胡 鲲 杨先乐 章海鑫 王 祎 周爱玲 赵依妮
双氟沙星对异育银鲫血脑屏障渗透性及消除规律
阮记明1, 2胡 鲲1杨先乐1章海鑫3王 祎1周爱玲1赵依妮1
(1. 上海海洋大学国家水生动物病原库, 上海 201306; 2. 江西农业大学动物科学技术学院, 南昌 330045; 3. 江西省水产科学研究所, 南昌 330039)
以异育银鲫()为研究对象, 采用组织匀浆法和高效液相色谱法, 研究了双氟沙星 (Difloxacin, DIF)通过异育银鲫血脑屏障情况, 并比较分析了大脑和外周组织中DIF消除差异。结果显示, 根据DIF 96h 半数致死剂量(2840 mg/kg b.W)给药后, 第96h时异育银鲫大脑组织匀浆中DIF的含量为(10.49±0.35) μg/g; 同时在临床推荐用药剂量(20 mg/kg)给药后的15个时间点(0→960h)上均能从大脑组织匀浆中检测出DIF。上述结果表明DIF能渗透通过血脑屏障而进入异育银鲫大脑组织。另外, 在大脑和外周组织消除过程上, 以大脑组织中的DIF消除过程最为平缓(按照 20 mg/kg给药)。到试验第960h, 大脑组织中DIF含量最高, 为(0.392±0.007) μg/g, 且大脑中的消除半衰期最长, 为1157.713h。因此, 异育银鲫大脑组织可作为DIF药物残留分析的靶组织。另根据欧盟关于食品中DIF最大残留限量(MRL)之规定, 实验条件下DIF休药期至少为25d。结果为研究鱼类血脑屏障作用, DIF神经毒性及其在水产养殖上的临床应用提供了参考。
双氟沙星; 组织匀浆法; 高效液相色谱法; 渗透性; 异育银鲫
氟喹诺酮类(Fluorine quinolones, FQNS)药物是自1984年诺氟沙星上市以来相继涌现出的一大类含氟的氟喹诺酮类衍生物的总称。近年来, FQNS因其具有抗菌谱广、抗菌活性强、与其他抗菌药物无交叉耐药性等特点而被广泛使用。随着其广泛被使用, 其毒副作用也逐渐显现。有研究认为, 氟喹诺酮类药物的毒性主要有中枢神经毒性、胃肠道毒性、肝脏毒性、软骨毒性、生殖毒性等[1]。神经毒性方面, 邓艳萍[2]研究发现, 在小鼠脑内注射依诺沙星、环丙沙星、氧氟沙星与司巴沙星等5种氟喹诺酮类抗菌药能引起致惊厥作用。在生殖毒性上, 黄文颐等[3]按300、150、50 mg/kg的盐酸二氟沙星给受孕大鼠灌胃, 结果高剂量组胎鼠存活率明显降低, 盐酸二氟沙星显著影响胚胎的生长发育, 其严重程度具有剂量效应关系。
双氟沙星 (Difloxacin, DIF), 又称二氟沙星, 属第三代氟喹诺酮类抗菌药物, 是我国农业部2000年批准的国家三类新兽药。因其对大多数革兰氏阳性菌和阴性菌、支原体及某些耐药菌株有很好的抗菌活性[4], 是水产养殖上常用的抗菌药物之一。目前, 虽然在猪[5]、鸡[6]以及水产养殖例如中华绒螯蟹[7]、牙鲆[8]、鲫鱼[9, 10]等水产经济动物上有大量关于DIF药代动力学方面的研究, 但对于DIF是否能渗透通过鱼类血脑屏障(Blood-Brain Barrier, BBB) 进入其大脑组织的研究还未见有报道。另外有研究认为, DIF的作用机制与抑制性神经递质γ-氨基丁酸(γ-Aminobutiric acid, GABA)相关[2, 11], 而GABA主要集中于大脑中。目前, 用于评价药物BBB通透性主要有体内评价、体外评价以及数学模型法等方法, 其中体内评价方法主要是测定实验动物脑组织及脑脊液中的药物成分, 脑组织匀浆法是考察药物BBB通透性的体内评价方法之一[12]。因此, 本文拟以异育银鲫()为研究对象, 通过研究96h LD50及临床推荐用药剂量(20 mg/kg)下DIF是否能通过异育银鲫血脑屏障; 如能通过血脑屏障, 其在大脑组织和外周组织中的消除过程差异如何, 本文拟为鱼类血脑屏障、DIF神经毒性研究及其在水产养殖上的临床应用提供参考。
1 材料与方法
1.1 主要仪器和药品
主要仪器 Agilent-1100型高效液相色谱仪(四元泵、自动进样器、柱温箱、二极管阵列检测器)、高速冷冻离心机(Allegrax-15R)、漩涡混合器、氮气吹干仪、超纯水系统(Purelab Prima120)和精密电子天平(METTLER AB104-N)等。
主要试剂和药品 DIF标准品购自Sigma公司; DIF原料药(纯度为98%)由浙江国邦药业有限公司提供。正己烷、二氯甲烷、氯化钠、柠檬酸、柠檬酸三钠、磷酸、磷酸氢二钠和磷酸二氢钠为分析纯; 乙腈、四丁基溴化铵为HPLC级(由国药集团化学有限公司购进)。
1.2 实验动物
540条体重为(60.04±5.02) g健康异育银鲫, 购自江苏省南通市某农场, 运至实验室经2% NaCl溶液浸泡10min后, 暂养2周。试验用水为充分曝气的自来水, 暂养及试验期间控制水温为(18±1)℃, 自然光照, 连续24h充气, 每两天换1次水, 每次换水量1/4, 试验用水族箱规格为100 cm×80 cm×80 cm。
1.3 给药方式
将DIF按照相应剂量(96h LD50和20 mg/kg)根据对应体重用细导管将双氟沙星灌入试验鱼前肠, 无回吐现象的留作试验。其中96h LD50(2840 mg/kg b.W)由前期DIF急性毒性试验得到。
1.4 样品采集
96h LD50组织样品 试验分为3组, 每组20尾; 按照DIF 96h LD50给药, 并于试验第96h采集大脑、肝脏、肾脏和肌肉等4种组织样品用于DIF含量测定; 其中每6尾同一组织样品混合为1个液相检测样品, 即每个时间点可以得到3个液相检测样品, 放入–20℃冷冻保藏以用于HPLC检测。另在给药前采取同一批试验鱼对应空白组织样品。
临床推荐剂量(20 mg/kg)组织样品 DIF在鱼类的临床用药剂量为5—20 mg/kg[13], 因此, 本次采用临床用药剂量上限(20 mg/kg)给药。选择480尾经过暂养的健康异育银鲫随机分成6组, 分别于给药后0.083、0.25、0.5、1、2、3、6、12、24、48、72、96、120、144、196、240、288、336、408、480、600、720、840和960h等24个时间点分别采集大脑、肝脏、肾脏和肌肉组织样品(样品采集同上), 放入–20℃冷冻保藏至样品处理; 给药前采取同一批试验鱼对应空白组织样品。
1.5 组织样品处理[9]
精确称取各组织匀浆样品1.0 g, 置于离心管中, 加入1 mol/L NaCl和0.2 mol/L PBS缓冲溶液(pH 7.4)各1 mL, 再加入5 mL二氯甲烷进行药物萃取, 旋涡混合振荡10min后, 4℃条件下8000 r/min离心10min, 取有机相; 剩余残渣中再加入5 mL二氯甲烷, 重复以上操作步骤进行第二次萃取, 并合并两次有机相, 于45℃恒温氮气条件下吹干, 加1 mL流动相溶解后, 加5 mL正己烷脱脂; 混匀、离心后将下层液体经0.45 μm有机微孔滤膜过滤, 4℃保存至HPLC分析。
1.6 色谱条件
色谱柱为: ZORBAX SB2C-18分析柱(150 mm× 4.6 mm, 5 μm); 流动相为: 乙腈: 四丁基溴化氨(0.030 mol/L、pH3.1)=5︰95(); 检测波长278 nm; 流速1.5 mL/min; 柱温40℃; 进样量10 μL。
1.7 标准曲线、回收率和精密度
标准曲线 配制0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0和100.0 μg/mL系列DIF标准品溶液, 经0.45 μm滤膜过滤后HPLC分析。以峰面积()为纵坐标, 质量浓度()为横坐标绘制双氟沙星标准曲线。
回收率和精密度 将0.1、1.0和10.0 μg/mL的DIF标准品添加到大脑、肝脏、肾脏及肌肉空白组织样品中, 每个浓度3个平行, 每个平行设一个空白对照, 按照1.5组织样品处理方法操作, 以测定回收率、日内及日间精密度。
回收率(%)=样品实测浓度/样品理论浓度× 100%。
1.8 数据处理
采用Microsoft Excel绘制药物标准曲线, 利用DAS 3.0药代动力学软件计算药物代谢动力学参数。
2 结果
2.1 DIF检测方法
高效液相色谱图显示DIF能与杂质较好地分离, 基线平稳, 重现性好, 其保留时间分别为10.54min (图1)。结果显示, DIF标准溶液在0.01— 100 μg/mL浓度范围内呈线性关系(图2), 其回归方程为:=43.885+1.6226, 相关系数:R=1, 其最低检测限为0.01 μg/mL。各组织样品按1.5处理方法操作后, 其平均回收率均处于90.2%—102.3%, 日内精密度系数不大于3%, 日间精密度系数不大于5.8%; 以上数据提示本方法的灵敏度、精密度、稳定性均符合本试验药代动力学研究技术要求。
2.2 96h LD50 剂量下DIF组织含量
根据前期急性毒性试验所得到的96h LD50(2840 mg/kg b.W)给药后, 运用本文所建立的方法测定大脑、肝脏、肾脏、肌肉4种组织中DIF含量分别为(10.49±0.35)、(73.36±2.17)、(4.33±0.35)、(26.48±2.07) μg/g。结果表明, 按照DIF 96h LD50剂量给药后, 在第96h时DIF能从大脑组织中被检测出来, 说明在96h LD50剂量条件下DIF能渗透通过异育银鲫血脑屏障而进入其大脑组织; 另外, 在96h LD50剂量下, 4种组织中DIF的含量高低次序为: 肝脏>肌肉>大脑>肾脏; DIF在肝脏组织中的残留量最高(73.36±2.17) μg/g; 而作为机体主要排泄器官的肾脏, 其DIF含量最小, 仅为(4.33±0.35) μg/g。
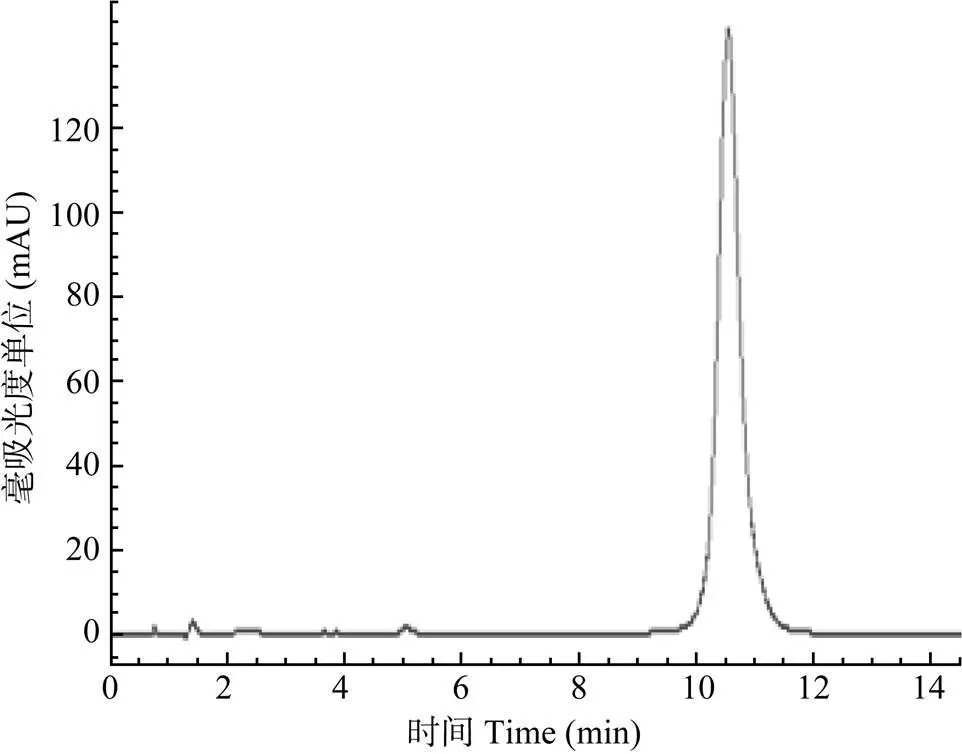
图1 双氟沙星标准色谱图
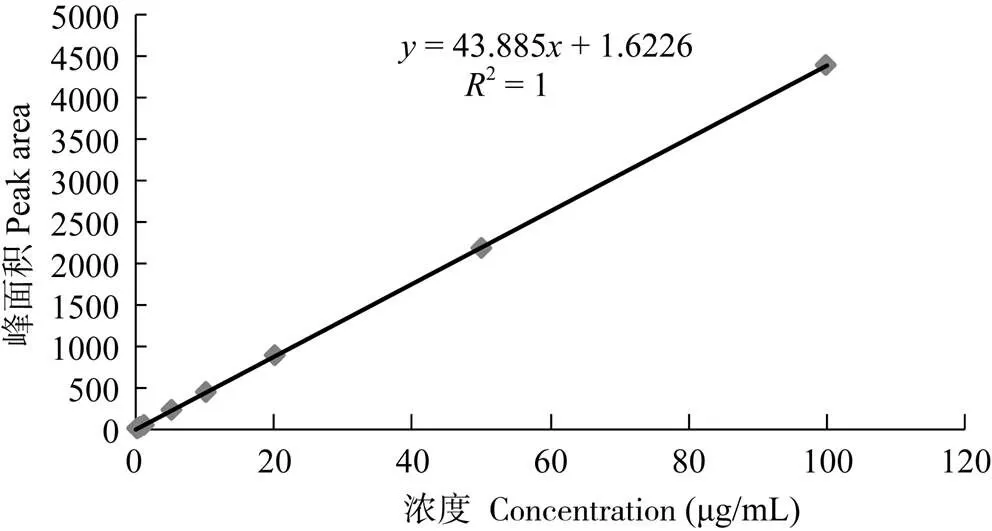
图2 双氟沙星标准曲线
2.3 大脑与外周组织中DIF消除结果
DIF采用临床用药剂量上限(20 mg/kg)单次前肠投喂给药, 其各组织浓度-时间数据经DAS 3.0药物代谢动力学软件拟合均符合一级吸收开放性二室房室模型。另外, 各组织中DIF主要代谢动力学参数(表1)表现为: ①达峰时间(max): 大脑=肾脏>肌肉>肝脏; ②达峰浓度(max): 肝脏>肾脏>肌肉>大脑; ③消除半衰期(1/2β): 大脑>肌肉>肾脏>肝脏; ④药时曲线下面积(AUC): 肌肉>肾脏>肝脏>大脑。各组织中DIF消除过程(图3)显示, 在4种组织中, 以大脑组织中的DIF消除过程最为平缓; 且到试验第960h, 大脑组织中DIF含量最高, 为(0.392± 0.007) μg/g, 极显著高于肝脏及肌肉中相应时间点DIF含量。另外试验期间后5个时间点各组织中DIF含量见表2。
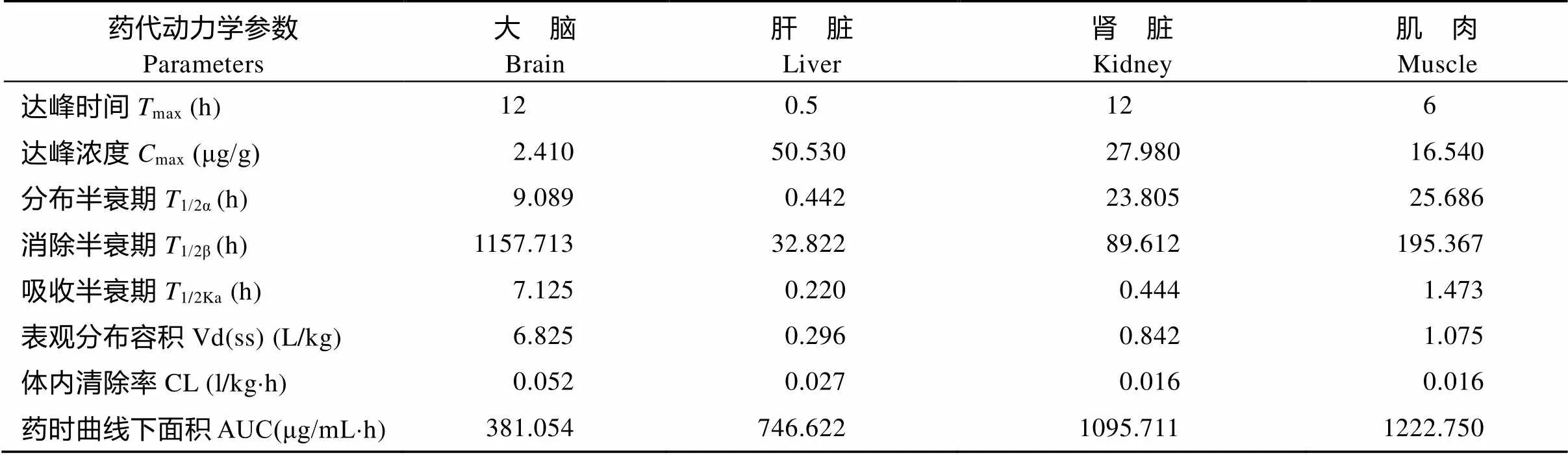
表1 DIF (20 mg/kg)单次前肠投喂给药后各组织药物代谢动力学参数
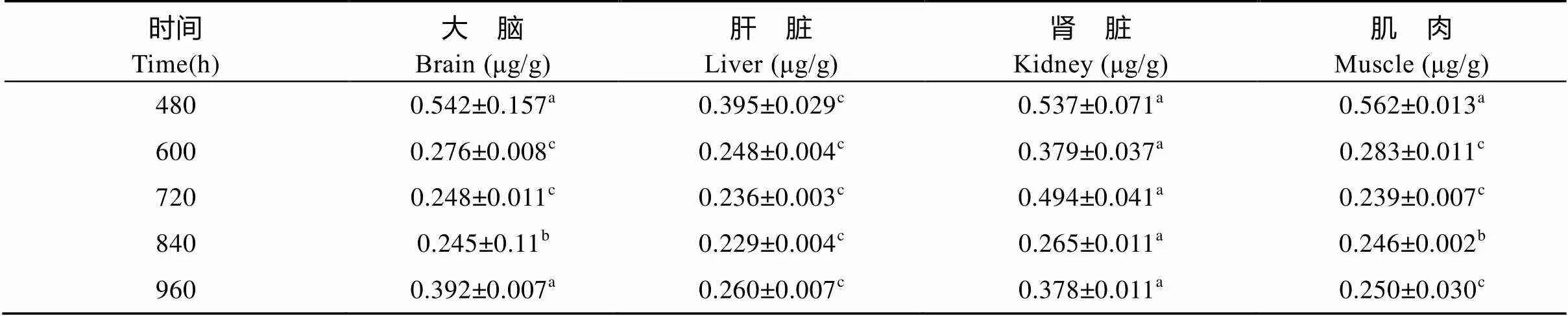
表 2 双氟沙星(20 mg/kg)单次前肠投喂给药最后5个时间点各组织含量
注: 同一行上标字母相同者差异不显著(>0.05), 字母不同者差异显著(<0.05或<0.01)
Note: Values with same letter superscripts in the same row mean no difference (>0.05), with different letters superscripts mean significant difference (<0.05 or<0.01)
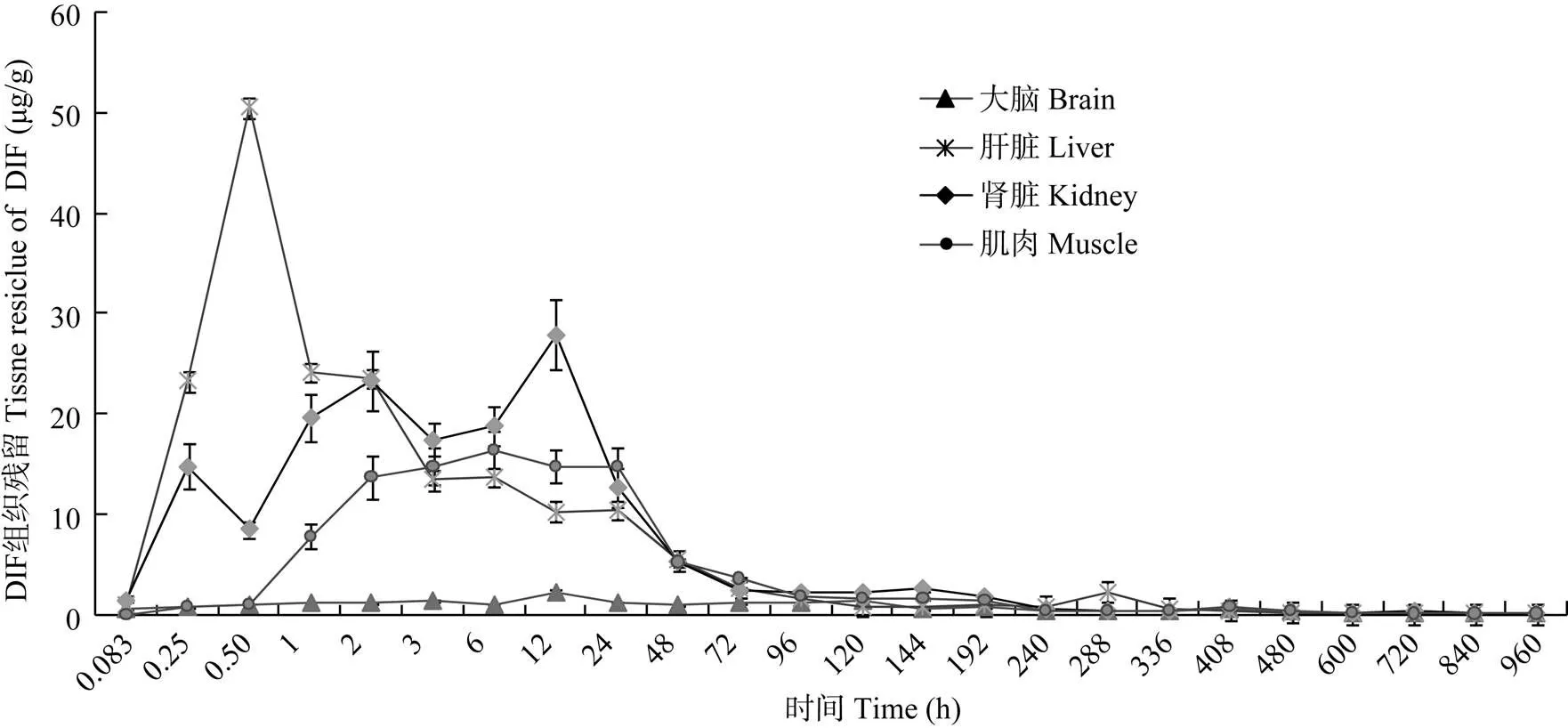
图 3 双氟沙星(20 mg/kg)单次前肠投喂给药后大脑、肝脏、肾脏及肌肉组织药时曲线
3 讨论
3.1 DIF血脑屏障渗透性
目前, 关于药物透过机体屏障方面已有大量研究。在血乳屏障研究上, 在克罗地亚, 从初乳中检测出了包括阿莫西林在内的多种兽药[14]。Escudero,.从哺乳山羊的乳中检测到双氟沙星表明其能透过血乳屏障。Hoy,.[16]研究表明阿维菌素能透过血睾屏障而产生毒性效应。而在血脑屏障研究上, 丁明玉等[17]采用反相高效液相色谱法测定了实验动物脑匀浆中的川芎嗪, 说明川芎嗪能够透过血脑屏障。大鼠动脉灌注培氟沙星、诺氟沙星、环丙沙星、氟罗沙星和司帕沙星等氟喹诺酮类药物后, 在其大脑组织中可以检测到相应药物的存在[18]。另外, 在体外也有关于FQNS透过血脑屏障的研究[19]。
目前, 还未见有关于DIF是否能通过鱼类血脑屏障进入其大脑组织的报道。而用于药物BBB通透性的评价方法主要有体内评价、体外评价以及数学模型等方法, 其中体内评价方法主要是测定实验动物脑组织及脑脊液中的药物成分, 脑组织匀浆法是考察药物BBB通透性的体内评价方法之一[12]。本文采用脑组织匀浆法, 测定了96h LD50及临床推荐用药剂量下, 异育银鲫大脑组织中DIF存在与否。结果显示, 在 96h LD50剂量(2840 mg/kg b.W)下, 大脑组织中DIF含量为(10.49±0.35) μg/g, 说明DIF能透过异育银鲫血脑屏障进入大脑组织; 而作为机体主要排泄器官, 肾脏中DIF含量最小, 仅为(4.33±0.35) μg/g。这可能是由于在体内, DIF能被代谢为沙拉沙星(Sarafloxacin, SAR)而以DIF原型及其代谢产物(SAR)等两种形式排泄出体外[7, 9], 因而在肾脏组织中DIF残留量最少。另外, 在临床推荐用药剂量(20 mg/kg)下的不同时间点均能从异育银鲫大脑组织中检测到DIF存在, 表明低剂量的DIF也能透过异育银鲫血脑屏障。另一方面, 大脑组织在达峰时间(12h)最长、达峰浓度(2.410 μg/g)最小, 这可能正是因为血脑屏障的存在而引起的。
DIF血脑屏障通透性一方面预示DIF可以应用于异育银鲫或其他水产动物脑部疾病的治疗上, 另一方面也提示在临床使用DIF的时候应考虑其中潜在的风险(例如神经毒性)。邓艳萍[2]研究发现, 在小鼠脑内注射依诺沙星、环丙沙星、氧氟沙星与司巴沙星等5种氟喹诺酮类抗菌药能引起致惊厥作用。在本文中异育银鲫大脑组织中DIF的检出, 可以认为是研究其是否具有神经毒性的物质基础, 甚至是证明其具有神经毒性的有力佐证。有研究表明, 强力霉素作为一种半合成的四环素类抗生素, 因其脂溶性高而容易透过血脑屏障[20]。氟喹诺酮类药物分子结构中第6位碳原子上有疏水性的氟原子, 因此, 该类药物具有一定的脂溶性, 能较好地透过血脑屏障进大脑组织。目前, 对于DIF进入异育银鲫大脑组织的机制尚不清楚, 这可能与其脂溶性有关。
3.2 大脑及外周组织DIF消除规律比较
通常将残留量高、消除最慢的组织看成是残留分析的靶组织。李海迪等[21]在对双氟沙星及其代谢产物在中华绒螯蟹体内药动学的研究中发现, DIF组织残留高低顺序为: 肝胰腺>卵巢>肌肉≈血淋巴>精巢, 认为肝胰腺中药物残留最高, 消除最缓慢, 因此可作为残留分析的靶组织。在本文中, DIF按照20 mg/kg采取单次前肠投喂给药后, 大脑及外周组织DIF消除过程见图3。结果显示, 在4种组织中, 以大脑组织中的DIF消除过程最为平缓; 虽然达峰浓度(max)大脑组织最小, 但是到试验最后5个时间点时, 各组织中DIF含量接近(表2), 且在试验第960h, 大脑组织中DIF含量最高, 为(0.392±0.007) μg/g; 另外, 大脑组织中DIF消除半衰期(1/2β)最长1157.713h, 因此, 异育银鲫大脑组织可作为DIF药物残留分析的靶组织。

4 结论
本文运用大脑组织匀浆法, 首次从异育银鲫的大脑组织中检测到了DIF的存在, 说明DIF能透过异育银鲫血脑屏障进入大脑组织, 这一方面预示DIF可以应用于异育银鲫或其他水产动物脑部疾病的治疗上, 另一方面也提示我们在临床使用这两种药物的时候应考虑其中潜在的风险(例如神经毒性)。另外, 本文认为大脑组织可作为异育银鲫DIF药物残留分析的靶组织, 而鱼类大脑组织是否可以作为其他水产药物残留分析的靶组织还有待进一步的研究。尽管前期DIF急性毒性试验得到其96h LD50为2840 mg/kg, 可以认为DIF对异育银鲫为低毒物质。但是本文结果显示, 在96h LD50及临床推荐用药剂量(20 mg/kg)下, DIF均通过BBB进入异育银鲫大脑组织; 而有研究表明, 氟喹诺酮类药物与机体GABA及γ-氨基丁酸受体有关[2], 但其发生机制尚不清楚, 这有待进一步开展DIF与其相关受体相互作用关系等研究加以求证。
[1] Mu G R. Clinical analysis of adverse reaction of Fluorine quinolones (FQNS) [J]., 2009, 22: 45 [穆桂荣. 氟喹诺酮类药物不良反应临床分析. 首都医药, 2009, 22: 45]
[2] Deng Y P. Central nervous toxicity of Fluoroquinolone drugs and its mechanism in mice [D]. Thesis for Doctor of Science. Beijing medical university, Beijing. 1999 [邓艳萍. 氟喹诺酮类药物对小鼠中枢神经毒性及其机制研究. 北京医科大学, 北京. 1999]
[3] Huang Q Y, Fang J. Study of Teratogenicity of difloxacin hydrochloride [J]., 1999, 33(4): 9—11 [黄齐颐, 房晶. 盐酸双氟沙星对大鼠致畸胎试验. 中国兽药杂志, 1999, 33(4): 9—11]
[4] Carbone M, Pennisi M G, Masucci M,Activity and postantibiotic effect of marbofloxacin, enrofloxacin, difloxacin and ciprofloxacin against feline Bordetella bronchiseptica isolates [J]., 2001, 81(1): 79—84
[5] Zeng Z L, Ding H Z, Huang X H,Pharmacokinetics and bioavailability of diftloxacin in pigs [J]., 2003, 36(7): 846—850 [曾振灵, 丁焕中, 黄显会, 等. 二氟沙星在猪体内的药物动力学及生物利用度研究. 中国农业科学, 2003, 36(7): 846—850]
[6] Ding H Z, Zeng Z L, Yang G X,. Study on pharmacokinetics and bioavailability of Diftloxacin in chickens [J]., 2004, 34(6): 20—24 [丁焕中, 曾振灵, 杨桂香, 等. 二氟沙星在鸡体内的药物代谢动力学及生物利用度研究. 中国兽医科技, 2004, 34(6): 20—24]
[7] Li H D, Ynag X L, Hu K,. Pharmacokinetics and the elimination regularity of Difloxacin and its metabolite sarafloxacin in[J]., 2009, 44(2): 12—20 [李海迪, 杨先乐, 胡鲲, 等. 双氟沙星及其代谢产物在中华绒螯蟹体内药物代谢及残留消除规律. 动物学杂志, 2009, 44(2): 12—20]
[8] Gai C L. Studies on Pharmacokinetics of DifIoxacin inand Postantibiotic Effects of DifIoxacin[D]. Thesis for Master of Science. Shanghai Ocean University, Shanghai. 2007 [盖春蕾. 二氟沙星在牙鲆体内的药动学及体外抗菌后效应的研究. 上海海洋大学. 2007]
[9] Ruan J M, Hu K, Zhang H X,. Pharmacokinetics comparisons of difloxacin in crucian carp () at two different water temperatures [J]., 2011, (6): 858—865 [阮记明, 胡鲲, 章海鑫, 等. 两种水温条件下异育银鲫体内双氟沙星药代动力学比较. 上海海洋大学学报, 2011, (6): 858—865]
[10] Ding F, Cao J, Ma L,. Pharmacokinetics and tissue residues of difloxacin in crucian carp () after oral administration [J]., 2006, 256(1—4): 121—128
[11] Wu Y J, Leng X F. Recent advances in insecticide neurotoxicology [J]., 2003, 46(3): 382—389 [伍一军, 冷欣夫. 杀虫药剂的神经毒理学研究进展. 昆虫学报, 2003, 46(3): 382—398]
[12] Wu X, Ouyang L N, Xiang D W,. Research progress on evaluation methods of drug blood-brain barrier permeability [J], 2010, (10): 862—864 [吴雪, 欧阳丽娜, 向大位, 等. 药物血脑屏障通透性评价方法的研究进展. 中国医院药学杂志, 2010, (10): 862—864].
[13] Yang X L. New Fishery Drug Manual [M]. Beijing: China Agriculture Press. 2005, 211—212 [杨先乐. 新编渔药手册. 北京: 中国农业出版社. 2005, 211—212]
[14] Bilandžić N, Kolanović B S, Varenina I,. Veterinary drug residues determination in raw milk in Croatia [J]., 2011, 22(12): 1941—1948
[15] Escudero E, Marín P, Cárceles C M,. Pharmacokinetic and milk penetration of a difloxacin long-acting poloxamer gel formulation with carboxy-methylcellulose in lactating goats [J]., 2011, 188(1): 92—95
[16] Hoy T, Horsberg T E, Nafstad I. The Disposition of ivermectin in atlantic salmon () [J]., 1990, (67): 307—312
[17] Ding M Y, Luo S Z, Liu H,. Determination of tetramethylpyrazine in animal serum and cerebrospinal fluid by high Performance liquid chromatography [J]., 2000, (1): 48—50 [丁明玉, 罗施中, 刘海, 等. 反相高效液相色谱法测定实验动物血液和脑组织中川芎嗪. 色谱, 2000, (1): 48—50]
[18] De Lange E C M, Marchand S, van den Berg D,. In vitro and in vivo investigations on fluoroquinolones; effects of the P-glycoprotein efflux transporter on brain distribution of sparfloxacin [J]., 2000, 12(2): 85—93
[19] Jaehde U, Goto T, de Boer A G,. Blood-brain barrier transport rate of quinoline antibacterials evaluated in cerebrovascular endothelial cell cultures [J]., 1993, 1(1): 49—55
[20] Jiang G H, Li G, Qin Z J. Influence of doxycycline on the permeability of the brain-blood barrier after urokinase thrombolysis in rats [J]., 2009, 16(1): 30—33 [蒋国会, 李光, 勤朱洁. 强力霉素对溶栓脑缺血大鼠血脑屏障通透性的影响. 卒中与神经疾病, 2009, 16(1): 30—33]
[21] Li H D. Pharmacokinetics of Difloxacin and its metabolites inand its reasonable application [D]. Thesis for Doctor of Science. Shanghai Ocean University, Shanghai. 2009 [李海迪. 双氟沙星及其代谢产物在中华绒螯蟹体内药动学研究及其合理应用. 上海海洋大学. 2009]
[22] Shi X F, Lu G L. Harm of quinolones (for Veterinary use) residual and its countermeasures [J]., 2008, 25(9): 16—17 [施杏芬, 陆国林. 兽用喹诺酮类药物残留的危害及对策. 中国动物检疫, 2008, 25(9): 16—17]
[23] Ding J R, Ai X H, Wang K Y,. Studies on tissue distribution and the elimination regularity of doxycycline residues in[J]., 2012, 36(1): 126—132 [丁俊仁, 艾晓辉, 汪开毓, 等. 强力霉素在斑点叉尾体内药物动力学及残留消除规律研究. 水生生物学报, 2012, 36(1): 126—132]
Blood-brain barrier permeability of DIF and its elimination comparative study between brain and peripheral tissues in
Ruan Ji-Ming1, 2, HU Kun1, Yang Xian-Le1*, Zhang Hai-Xin3, Wang Yi1, Zhou Ai-Ling1and Zhao Yi-Ni1
(1. National Pathogen Collection Center for Aquatic Animals, Shanghai Ocean University, Shanghai 201306, China; 2. College of Animal Sciences and Technology, Jiangxi Agricultural University, Nanchang 330045, China; 3. Jiangxi Fisheries Research Institute, Nanchang 330039, China)
Nowadays, difloxacin (DIF) which belongs to Fluorine quinolones (FQNS), has become one of the widely used drugs. For aquatic animals,the permeability of DIF getting through blood-brain barrier has not been reported. Usingas the research object, the blood-brain barrier permeability of DIF and its elimination comparative study between brain and peripheral tissues were conducted with tissue homogenate and high performance liquid chromatography (HPLC) methods. The results showed that, at the 96thhour, the content of DIF in brain tissue homogenate was (10.49±0.35) μg/g following its 96 hour median lethal dose (96h LD50); and the existences of DIF in brain could be detected at the 15 time points (0→960h) after the administration with its clinical recommended dosage (20 mg/kg). The results indicated that the DIF could penetrate through the blood-brain barrier into brain of. In addition, the elimination process of DIF in brain after the administration of 20 mg/kg was the gentlest one among the tissues involved in this research. The highest content of DIF in brain was (0.392±0.007) μg/g. The highest value was reached at the 960thhour. The longest1/2βof DIF in brain was 1157.713h. The brain ofcould be used as a target tissue for DIF residual analysis. Furthermore, according to the regulation of European Union (2003) about the maximum residue limits (MRL) of DIF on food, the withdrawal time of DIF should be longer than 25d under the experiment conditions. The results would provide references for blood-brain barrier researching in fish, and for nerve toxicity explorations of DIF and its clinical application in aquaculture.
Difloxacin; Tissue homogenate method; HPLC; Permeability;
2013-01-04;
2013-12-19
“863”计划项目(2011AA10A216); 国家自然科学基金(31172430); 农业公益性行业专项(201203085)资助
阮记明(1974—), 男, 江西贵溪人; 在读博士; 主要从事水产病害及水质调控研究。E-mail: rjm903@163.com
杨先乐(1949—), 男, E-mail: xlyang@shfu.edu.cn
S948
A
1000-3207(2014)02-0272-07
10.7541/2014.40

