嗜热四膜虫两类不同金属硫蛋白的功能补偿分析
卢剑功 许 静 张鹏幸 王 伟
嗜热四膜虫两类不同金属硫蛋白的功能补偿分析
卢剑功 许 静 张鹏幸 王 伟
(山西大学生物技术研究所, 化学生物学与分子工程教育部重点实验室, 太原 030006)
为了分析嗜热四膜虫两类金属硫蛋白之间的关系, 研究分别构建了13和24的基因敲除载体, 通过同源重组获得敲除大核13和24的两种嗜热四膜虫突变体细胞株△13和△24。两种突变体细胞株暴露在Cd2+、Cu2+和H2O2的生长表现出显著不同, △13突变体细胞对Cd2+的耐受性显著下降, 而△24突变体细胞对Cu2+和H2O2的耐受性均显著下降。实时荧光定量PCR分析不同突变体中其他基因的表达变化, 在△24突变体细胞株中,5的表达水平下调, 在500 μmol/L Cu2+处理后, △24突变体细胞中1、3和5表达相对野生型分别上调6.1、9.5和8.5倍。在△13突变体细胞中,2、4和5的表达水平下调, 当5 μmol/L Cd2+处理后, △13突变体细胞株5表达水平相对野生型上调2.9倍, 而2和4表达水平相对野生型分别下降了4.9倍和2.5倍。结果表明嗜热四膜虫中的金属硫蛋白MTT1、MTT3和MTT5主要参与细胞的重金属解毒功能; 而MTT2和MTT4主要参与细胞内正常的新陈代谢功能, 不同的金属硫蛋白基因之间的表达存在相互调控和功能补偿。
嗜热四膜虫; 金属硫蛋白; 基因敲除; 实时荧光定量PCR
金属硫蛋白MT(Metallothionein)是一类低分子量(6—7 kD)、富含半胱氨酸并能够螯合金属离子的蛋白[1]。MT可以通过螯合重金属离子(Cd、Hg等)保护机体, 解除毒害[2], 同时参与调节体内必需金属元素(Cu、Zn等)的正常新陈代谢[3], 金属硫蛋白还具有清除体内自由基的功能[4]。当MT无金属离子结合时, 其高级结构呈无序状态, 而当有金属离子被其结合后就会折叠为有序的结构[5]。MT普遍存在于人、动植物和微生物等不同的生物体中, 同一种生物体中含有不同的异构体[6]。动物的s基因属多基因家族, 具有基本相似的结构[7]。哺乳动物中主要的金属硫蛋白亚型为MT-Ⅰ、MT-Ⅱ、MT-Ⅲ和MT-Ⅳ, 它们分布于体内不同器官, 能被多种金属所诱导, 行使不同功能[5]。
金属硫蛋白结构在高等真核生物中存在较高的保守性, 但在原生动物细胞中, 金属硫蛋白的结构却存在较大的差异, 目前对原生动物金属硫蛋白的研究主要集中在四膜虫和草履虫中。嗜热四膜虫()是一种单细胞真核模式生物, 细胞无细胞壁, 对于外源环境污染物胁迫敏感, 具有快速的细胞响应机制, 因此被认为是毒理学与生态毒理学研究良好的模式生物之一[8—10]。嗜热四膜虫中已被鉴定的金属硫蛋白有5种(MTT1、MTT2、MTT3、MTT4、MTT5), 其中MTT1、MTT3和MTT5属于7a亚家族(Cd-MT), MTT2和MTT4属于7b亚家族(Cu-MT)[11]。两类金属硫蛋白基因在正常的生长条件和对外源的应激条件下均表现出不同的表达模式。尽管对两类金属硫蛋白的诱导机制进行了系统的研究, 但对两类金属硫蛋白在体内的相互关系及功能补偿机制仍不清楚。
本研究通过基因敲除的方法分别获得敲除13和24的嗜热四膜虫突变体细胞株, 检测了两种突变体细胞株暴露在Cd2+、Cu2+和H2O2胁迫下的耐受性, 分析两类金属硫蛋白在嗜热四膜虫体内的相互补偿作用, 结果表明两类金属硫蛋白存在相互调节和功能补偿。
1 材料与方法
1.1 嗜热四膜虫的培养
嗜热四膜虫B2086株由美国康奈尔大学Peter J. Bruns教授惠赠, pNeo4由罗彻斯特大学Martin A. Gorovsky教授惠赠。嗜热四膜虫在SPP培养基(1% proteose peptone、0.2% glucose、0.1% yeast extract和0.003% EDTA ferric sodium salt)中30℃培养[12]。
1.2 敲除载体pN-MTT1-3和pN-MTT2-4的构建
从四膜虫基因组数据库(http://www.ciliate.org)中分析1、、和基因序列, 设计特异引物, 以嗜热四膜虫大核基因组为模板, 引物MTT3-3′-F和MTT3-3′-R扩增3基因的3侧翼序列, 长度713 bp。该片段与pMD18-T载体连接, 获得pMD18-T-3-3′重组质粒。pMD18-T-3-3′和载体pNeo4分别用Ⅰ和Ⅰ双酶切后获得的目的片段连接, 得到重组构建体pN-1-3。
以嗜热四膜虫大核基因组为模板, 引物MTT2- 5′-F和MTT2-5′-R扩增2基因的5′侧翼序列, 长度915 bp; 以MTT4-3′-F和MTT4-3′-R扩增4基因的3′侧翼序列, 长度708 bp。获得的目的片段分别与pMD18-T载体连接, 获得pMD18-T-2-5′和pMD18-T-4-3′ 重组质粒。pMD18-T-2-5′和载体pNeo4分别用Ⅰ和Ⅰ双酶切, 目的片段连接获得p2-5′-Neo4, 然后p2-5′-Neo4和pMD18-T-4-3′分别用Ⅰ和Ⅰ双酶切后获得的目的片段连接, 得到重组构建体pN-2-4。
1.3 嗜热四膜虫细胞的转化、筛选和鉴定
将敲除载体pN-1-3和pN-2-4分别用Ⅰ和Ⅰ双酶切使其线性化。基因枪轰击法[13]将敲除载体转化入嗜热四膜虫体中进行基因同源重组。对转化后的嗜热四膜虫逐步提高SPP中巴龙霉素(Paromomycin)的浓度, 通过细胞表型分配进行筛选[14]。根据嗜热四膜虫1基因启动子的上游序列和3侧翼序列的下游序列设计一对引物△13-F和△13-R, 通过PCR扩增筛选和鉴定13的敲除细胞株。根据嗜热四膜虫2基因5′侧翼上游序列和4序列设计一对引物△24-1-F和△24-1-R; 根据4序列和4基因3′侧翼下游序列设计另一对引物△24-2-F和△24-2-R, PCR扩增证实4的重组位点正确。
分别提取△13和△24突变体细胞中的总RNA, 分光光度计检测所提总RNA的260/280在1.8—2.0。以总RNA为模板, 使用PrimeScript®RT Master Mix Kit (TaKaRa)进行反转录PCR获得cDNA。qRT-PCR(ABI StepOnePlus)分析△13和△24中s的转录水平。内参17S rRNA以及1、2、3和4的引物见表1。采用相对CT法对qRT-PCR扩增数据进行处理[15, 16]。
1.4 △MTT1-MTT3和△MTT2-MTT4细胞株在Cd2+、Cu2+和H2O2胁迫下的生长比较
30℃无菌培养野生型B2086、△13和△24细胞至平台期, 将三株细胞分别转至新的SPP培养基中, 每一组含三个平行, 使其初始浓度同为1×104cell/mL, 用于Cd2+、Cu2+和H2O2的浓度梯度处理实验。Cd2+处理终浓度为0、2.5、5、10、20、30、45、60 μmol/L; Cu2+处理终浓度为0、50、200、350、500、650、1000、1500 μmol/L; H2O2处理终浓度为0、100、200、350、500、650、800、1000 μmol/L。24h后, 血细胞计数器计数。
1.5 四膜虫突变体细胞中MTT1、MTT2、MTT3、MTT4和MTT5的表达分析
分别提取不同细胞的总RNA, 反转录PCR合成cDNA。以野生型四膜虫细胞为对照, 对△13和△24细胞株中保留的其他基因的表达水平进行分析。内参17S rRNA以及1-5的引物见表1, 每个样本做3个平行, 结果通过仪器自带的StepOne Software读取及采用相对CT法处理分析。统计方法采用检验,0.05具有统计学意义。
2 结果
2.1 嗜热四膜虫MTT家族基因的序列分析
从嗜热四膜虫大核基因组数据库(http://www. ciliate.org)分析发现, 在嗜热四膜虫大核基因组上,1和3串联排列, 两者之间1708 bp,1和3基因编码序列全长均为489 bp, 其预测编码氨基酸序列一致性74.69%。2和4串联排列, 两者之间1255 bp,2和4基因编码序列全长均为327 bp, 其预测编码氨基酸序列一致性98.15%。5编码序列全长300 bp, 独立的位于不同的染色体上。嗜热四膜虫全基因microarray表达谱(http://tfgd.ihb.ac.cn)分析发现,1和3具有相似的表达模式2和4具有相似的表达模式[9], 因此1和32和4可能分别是进化中同一基因复制的产物, 并执行相似的功能。为了分析两类不同金属硫蛋白的功能, 在本研究中我们同时敲除串联的两个同源基因。

表1 引物序列
2.2 △MTT1-MTT3和△MTT2-MTT4突变体细胞株的构建与鉴定
由于敲除载体中的4含有1的启动子序列[17], 所以在构建敲除载体pN-1-3时, 只需设计敲除13的3′同源臂(图1A)。在逐步筛选△13单克隆细胞株过程中, 当巴龙霉素浓度为80 mg/mL时, 未正确重组细胞株生长迟缓至裂解, 同源重组成功的细胞株生长良好。以△13基因组为模板, △13-F和△13-R扩增获得3000 bp特异片段, 与预期相符, 对照以基因组为模板, 获得4600 bp片段(图1B)。qRT-PCR检测△13株中1和3的表达, 显示均无信号, 证实1和3均无转录本出现(图1C), 结果表明获得体细胞核中完全敲除1和3突变体细胞株△13。
在逐步筛选△24单克隆细胞株过程中, 当巴龙霉素浓度为50 mg/mL时, 同源重组成功的细胞株生长良好而未正确重组细胞株生长迟缓至裂解。在2和4敲除鉴定的过程中, 由于敲除构建体与被置换的区域具有相似的DNA片段大小, 因此无法一步鉴定。以2和4敲除细胞株的基因组为模板, △24-1-F和△24-1-R为鉴定引物PCR扩增获得2281 bp特异片段, △24-2-F和△24-2-R扩增获得1981 bp特异片段,基因组为模板PCR扩增均无特异条带(图1D、E), 表明4正确重组到2和4位点。qRT-PCR检测△24株中2和4均无信号, 证实2和4均无转录本出现(图1F), 表明获得体细胞核中完全敲除2和4的突变体细胞株△24。
2.3 △MTT1-MTT3和△MTT2-MTT4突变体细胞在Cd2+、Cu2+和H2O2下的增殖比较
野生型(WT)、△13和△24细胞初始浓度为1×104cell/mL, 加入不同浓度的Cd2+、Cu2+和H2O2, 检测细胞的耐受性。结果表明随着Cd2+浓度递增, △13突变体细胞增殖显著下降, 其半数效应浓度(50Cd)介于5—10 μmol/L, 小于WT细胞的50Cd(27 μmol/L[20])。在10 μmol/L Cd2+的浓度下, 细胞增殖停滞, 而WT与△24在30 μmol/L Cd2+的浓度下仍能生长(图2A)。在不同浓度梯度的Cu2+胁迫后, △24与WT相比细胞增殖抑制明显, 而△13与WT相比不存在显著差异。△24的50Cu介于500—650 μmol/L, 小于WT细胞的50Cu(1500 μmol/L)(图2B)。在不同浓度的H2O2处理后, WT与△13的生长趋势一致, 但△24的生长受到显著抑制(图2C)。
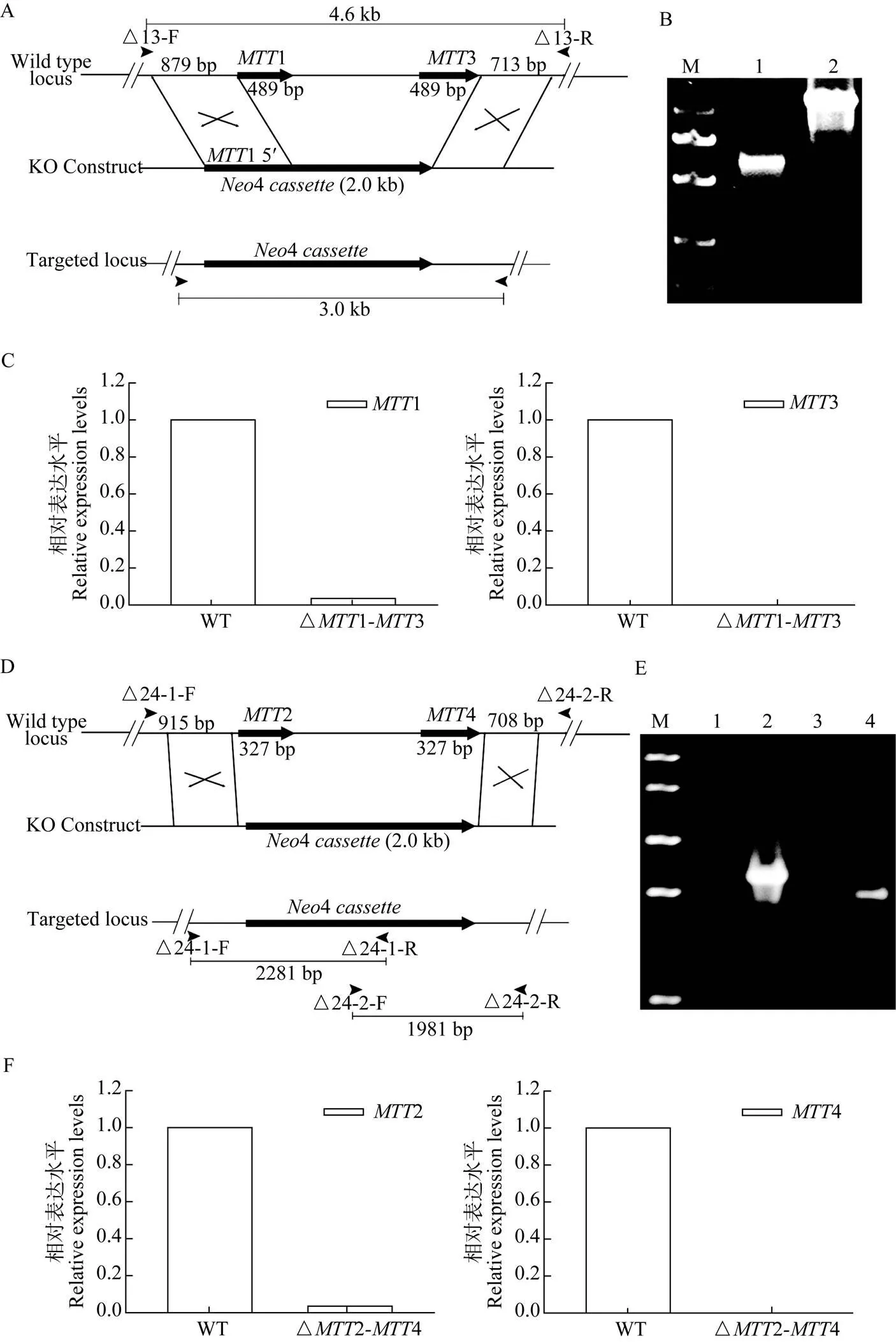
图1 嗜热四膜虫△MTT1-MTT3和△MTT2-MTT4突变体细胞的构建与鉴定
A.1和3基因敲除载体的构建和重组示意图; B.△13突变体重组位点的PCR扩增产物的琼脂糖凝胶电泳; M为λ-T14 digest DNA Marker; 泳道1为3000 bp 的重组基因片段; 泳道2为4600 bp的野生型DNA片段; C.1和3转录水平的qRT-PCR分析; D.2和4基因敲除载体的构建和重组示意图; E.△24突变体重组位点的PCR扩增产物的琼脂糖凝胶电泳; M为Trans2KTMPlusⅡ DNA Marker; 泳道1为野生型基因组扩增; 泳道2为2281 bp重组DNA片段; 泳道3为野生型基因组扩增; 泳道4为1981 bp重组DNA片段; F.2和4转录水平的qRT-PCR分析
A. Schematic representation for generating1 and3 knockout strain; B. PCR products were analyzed by 1% agarose gel electrophoresis; M: λ-EcoT14 digest DNA Marker; Lane 1: 3000 bp recombination DNA fragment, Lane 2: 4600 bp WT DNA fragment; C. Analysis of relative expression of1and3by qRT-PCR; D. Schematic representation for generating2and4 knockout strain; E. PCR products were analyzed by 1% agarose gel electrophoresis; M. Trans2KTMPlusⅡ DNA Marker; Lane 1. WT control, Lane 2. 2281 bp recombination DNA fragment, Lane 3. WT control, Lane 4. 1981 bp recombination DNA fragment; F. Analysis of relative expression of2and4by qRT-PCR
2.4 两类MTT家族基因在△MTT1-MTT3和△MTT2-MTT4突变体细胞中的表达变化
在嗜热四膜虫中5种金属硫蛋白基因都不含有内含子, 因此对外源环境变化能够快速响应。在24基因敲除突变体细胞中,5的表达水平相对野生型下调;1和3表达水平则无显著变化。当野生型细胞株和△24突变体分别在500 μmol/L Cu2+处理后,1、3和5的表达水平均上调, 但△24突变体比WT细胞株对于Cu2+的响应更显著, △24突变体细胞株中1、3和5表达相对野生型分别上调6.1、9.5和8.5倍(图3 A、B、C)。
当1-3基因敲除后,2、4和5的表达水平相对野生型下调。在5 μmol/L Cd2+处理后,2、4和5的表达水平相对未诱导显著上调;5的表达水平相对同等处理条件下的野生型上调2.9倍, 但是2和4的表达水平相对同等处理条件下的野生型下调4.9倍和2.5倍(图3 D、E、F)。
3 讨论
原生动物金属硫蛋白分为7a (CdMTs)和7b (CuMTs)两个亚家族[11]。两个亚家族的金属硫蛋白在金属诱导类型(Cd/Zn或Cd)和半胱氨酸残基(Cys)排列方式存在不同[11, 18]。嗜热四膜虫1和3、2和4的序列分析表明它们可能是基因在进化过程中基因复制的结果, 并存在功能冗余性[19]。MTT1和MTT2中半胱氨酸残基含量百分比一致(29.6%), 但半胱氨酸残基的排列方式却不同。MTT1的半胱氨酸残基排列方式主要为Cys- Cys-Cys和Cys-Cys, 与人金属硫蛋白的α-domain相似; MTT2的半胱氨酸残基排列方式主要为Cys-X-Cys, 与人金属硫蛋白的β-domain相似[20]。在哺乳动物中, 人金属硫蛋白的α-domain优先结合Cd2+, 而β-domain优先结合Cu2+。四膜虫两个亚家族的金属硫蛋白的启动子不仅对不同的诱导物具有不同的响应机制, 而且对相应诱导物的结合表现出较高的亲和力。本研究通过基因敲除, 分析两种嗜热四膜虫突变体细胞株△1-3和△24的应激耐受性的变化, 结果显示△13和△24对Cd2+、Cu2+和H2O2胁迫的耐受性显著不同,1和3的敲除显著降低了细胞对Cd2+的耐受性; 而2和4的敲除降低了细胞对Cu2+和H2O2的耐受性, 表明不同类型的金属硫蛋白在细胞中执行不同的功能。然而低浓度的离子即可诱导金属硫蛋白的高效表达, 暗示金属硫蛋白不仅参与细胞的解毒功能, 同时参与细胞内其他应激响应途径。
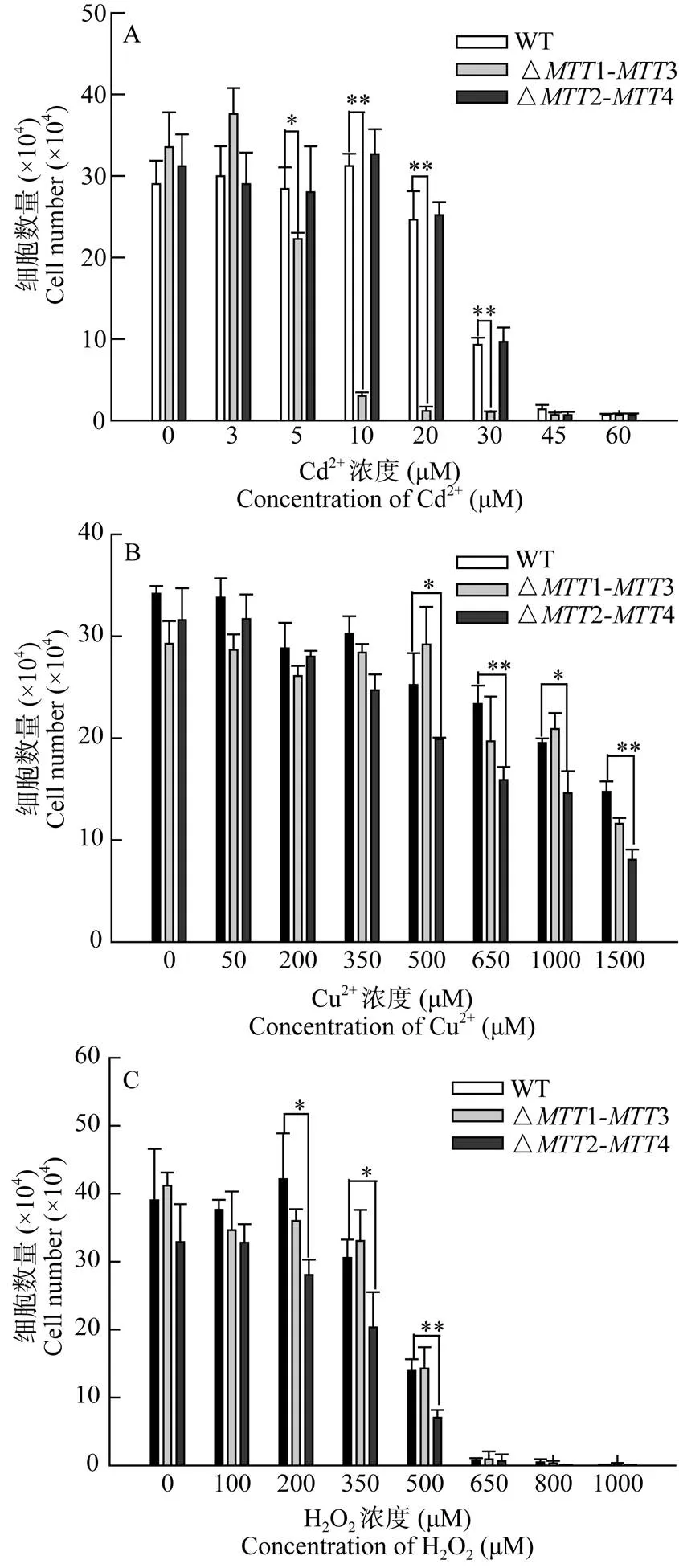
图2 △MTT1-MTT3和△MTT2-MTT4突变体细胞在Cd2+、Cu2+和H2O2胁迫下的增殖比较
细胞初始浓度均为1×104cell/mL, Cd2+, Cu2+and H2O2应激处理下培养24h后计数。星号表明不同处理组之间存在显著性差异, *<0.05, **<0.01, 每个样本的测定设有三个平行样; A.WT、△13和△24三种细胞株在Cd2+胁迫下的增殖; B. WT、△13和△24三种细胞株在Cu2+胁迫下的增殖; C. WT、△13和△24三种细胞株在H2O2胁迫下的增殖
Initiation concentration of the cells is 1×104cell/mL, cell number is counted under Cd2+, Cu2+and H2O2stress after 24h cultivation, star indicate significant difference between groups, Data are the mean ± standard deviation from three independent experiments,*<0.05, **<0.01; A. Proliferation of WT,△1-3 and △24 strains under Cd2+stress; B. Proliferation of WT,△1-3 and △24 strains under Cu2+stress; C. Proliferation of WT,△1-3 and △24 strains under H2O2stress
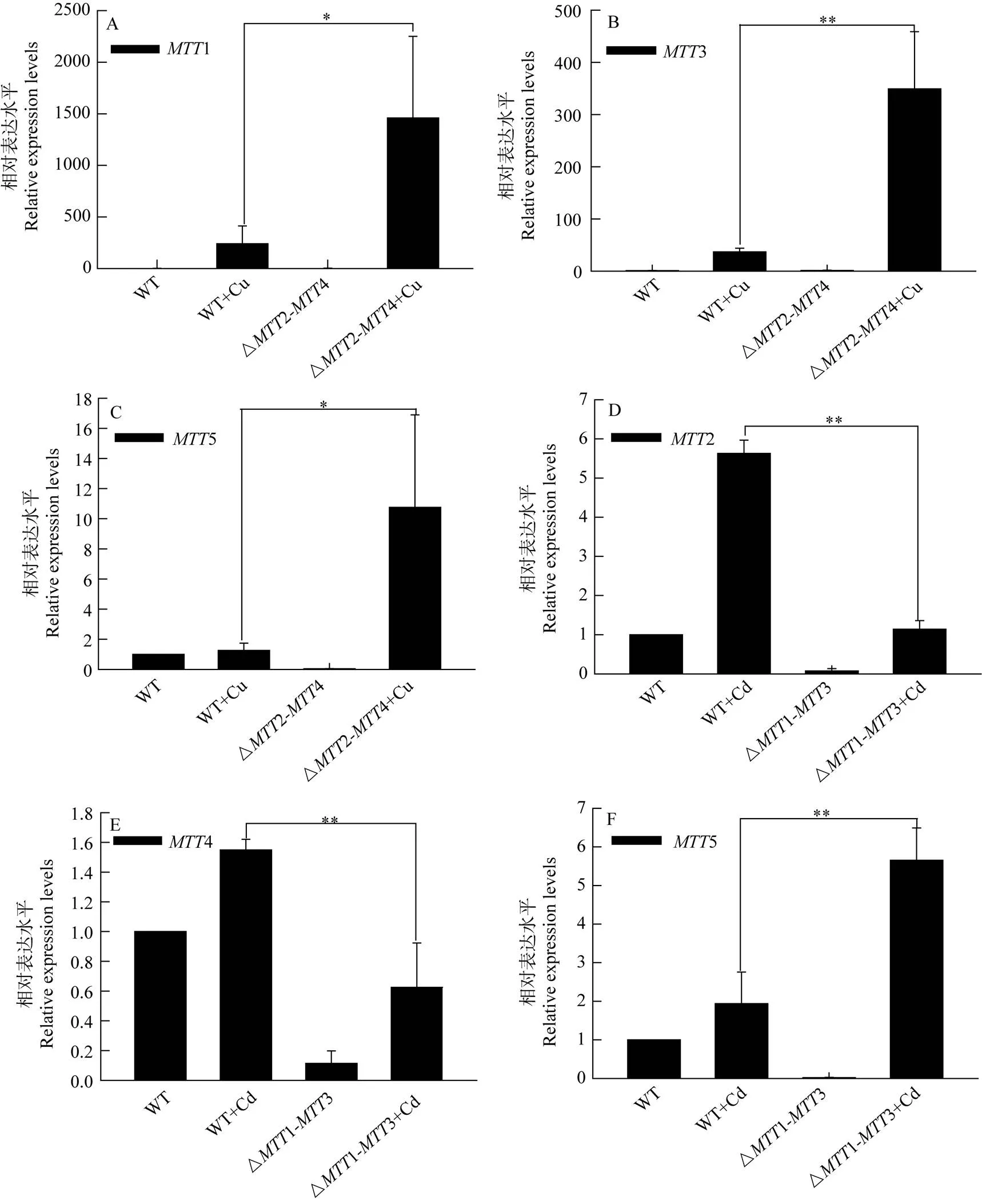
图3 在不同条件下WT、△MTT1-MTT3和△MTT2-MTT4细胞株中MTT基因的相对表达水平
星号表明不同处理组之间存在显著性差异, *<0.05, **<0.01, 每个样本的测定设有三个平行样; A.在正常生长条件和Cu2+胁迫下WT和△24细胞株中1的相对表达水平; B.在正常生长条件和Cu2+胁迫下WT和△24细胞株中3的相对表达水平; C.在正常生长条件和Cu2+胁迫下WT和△24细胞株中5的相对表达水平; D.在正常生长条件和Cd2+胁迫下WT和△13细胞株中2的相对表达水平; E.在正常生长条件和Cd2+胁迫下WT和△13细胞株中4的相对表达水平; F.在正常生长条件和Cd2+胁迫下WT和△13细胞株中5的相对表达水平
Star indicate significant difference between groups, Data are the mean ± standard deviation from three independent experiments *<0.05, **<0.01; A. Relative expression level of1 in WT and △24 strains under normal growth condition and Cu2+induction, respectively; B. Relative expression level of3 in WT and △24 strains under normal growth condition and Cu2+induction, respectively; C. Relative expression level of5 in WT and △24 strains under normal growth condition and Cu2+induction, respectively; D. Relative expression level of2 in WT and △13 strains under normal growth condition and Cd2+induction, respectively; E. Relative expression level of4 in WT and △13 strains under normal growth condition and Cd2+induction, respectively; F. Relative expression level of5 in WT and △13 strains under normal growth condition and Cd2+induction, respectively
Diaz,.利用实时荧光定量PCR技术对1、3和5进行不同诱导物处理条件下基因转录水平的研究表明多种诱导物诱导了1、3和5基因的转录, 其中Cd2+显著上调了1、3和5基因的转录水平[11]。对2和4进行不同诱导物诱导下基因转录水平的研究表明2和4的最强诱导物是Cu2+, Hg2+、Zn2+和Cd2+也能使其表达量上调, 但H2O2处理后其表达水平呈现下调趋势[21]。La3+同样能够诱导1和2转录水平上调[22]。在本研究中, 我们发现△24细胞株中,5表达水平下调, 这可能是由于MTT2和MTT4的缺失, 导致细胞内金属离子代谢失衡, 使得转录因子活性下降, 导致MTT5的本底表达受到影响。在Cu2+的应激条件下, △24细胞株中1、3和5的表达水平比野生型细胞更高, 表明在缺乏MTT2和MTT4的条件下, MTT1、MTT3和MTT5能够补偿前者的功能。MTT1可以结合16个Cd2+, MTT2可以结合11个Cd2+[23]。Cu2+不能替代已结合至MTT1上的Cd2+, 却可以置换MTT2中的Cd2+, 表明MTT1对Cd2+具有更强的亲和力, 而MTT2对Cu2+具有更强的亲和力[20]。在正常的生长条件下,2和4有较高的表达水平, 表明MTT2和MTT4参与细胞内正常的新陈代谢[20]。在重金属离子应激条件下,2和4表达上调, 表明MTT2和MTT4同时参与了细胞的解毒功能。本研究发现缺乏2和4的表达,1、3和5表达上调, 以此补偿2和4缺失所影响的细胞内代谢和解毒功能。在△13的细胞中,2、4和5的表达水平下调。这些结果表明, 尽管1和3在正常生长条件下仅有较低水平的表达, 但它们仍可能参与了2、4和5的表达调节。在Cd2+存在时, △13突变体细胞株中5表达相对野生型中诱导后的表达水平上调2.9倍, 但2和4表达水平相对野生型没有上调。该研究结果进一步表明, 类似MTT1和MTT3, MTT5主要参与细胞内的重金属解毒功能, 而MTT2和MTT4并不主要参与细胞内重金属解毒, 主要维持细胞内正常的代谢功能综上所述, 我们的研究结果进一步表明单细胞嗜热四膜虫中的MTT1、MTT3和MTT5主要参与细胞在重金属应激条件下的解毒功能; 而MTT2和MTT4则主要参与离子在细胞内正常的新陈代谢功能。但是不同金属硫蛋白之间也存在相互调节和功能上的补偿, 以此适应复杂的环境变化。
[1] Kagi J H, Valee B L. Metallothionein: a cadmium- and zinc-containing protein from equine renal cortex [J]., 1960, 235(12): 3460—3465
[2] Liu J, Klaassen C D. Absorption and distribution of cadmium in metallothionein-I transgenic mice [J]., 1996, 29(2): 294—300
[3] Cousins R J. Absorption, transport, and hepatic metabolism of copper and zinc: special reference to metallothionein and ceruloplasmin [J]., 1985, 65(2): 238—309
[4] Viarengo A, Burlando B, Ceratto N,Antioxidant role of metallothioneins: a comparative overview [J]., 2000, 46(2): 407—417
[5] Romero-Isart N, Vasak M. Advances in the structure and chemistry of metallothioneins [J]., 2002, 88(3—4): 388—396
[6] Kojima Y, Hunziker P E. Amino acid analysis of metallothionein [J]., 1991, 205: 419—421
[7] Miles A T, Hawksworth G M, Beattie J H,Induction, regulation, degradation, and biological significance of mammalian metallothioneins [J]., 2000, 35(1): 35—70
[8] Eisen J A, Coyne R S, Wu M,Macronuclear genome sequence of the ciliate, a model eukaryote [J]., 2006, 4(9): e286
[9] Miao W, Xiong J, Bowen J,Microarray analyses of gene expression during thelife cycle [J]., 2009, 4(2): e4429
[10] Gutiérrez J C, Martín-González A, Díaz S,Ciliates as a potential source of cellular and molecular biomarkers/ biosensors for heavy metal pollution [J]., 2003, 39(4): 461—467
[11] Diaz S, Amaro F, Rico D,metallothioneins fall into two discrete subfamilies [J]., 2007, 2(3): e291
[12] Gorovsky M A, Yao M C, Keevert J B,Isolation of micro- and macronuclei of[J]., 1975, 9(0): 311—327
[13] Cassidy-Hanley D, Bowen J, Lee J H,Germline and somatic transformation of matingby particle bombardment [J]., 1997, 146(1): 135—147
[14] Gaertig J, Thatcher T H, Gu L,Electroporation- mediated replacement of a positively and negatively selectable beta-tubulin gene in[J]., 1994, 91(10): 4549—4553
[15] Zheng L M, Zhou F L, Yang Q B,Molecular cloning and expression analysis of metallothionein from[J]., 2011, 35(6): 913—919 [郑丽明, 周发林, 杨其彬, 等斑节对虾金属硫蛋白基因 cDNA 克隆与表达分析. 水生生物学报, 2011, 35(6): 913—919]
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method [J]., 2001, 25(4): 402—408
[17] Mochizuki K. High efficiency transformation of Tetrahymena using a codon-optimized neomycin resistance gene [J]., 2008, 425: 79—83
[18] Amaro F, del Pilar de Lucas M, Martin-Gonzalez A,Two new members of themulti-stress-inducible metallothionein family: characterization and expression analysis ofCd/Cu metallothionein genes [J]., 2008, 423(1): 85—91
[19] Gutierrez J C, Amaro F, Martin-Gonzalez A. From heavy metal-binders to biosensors: ciliate metallothioneins discussed [J]., 2009, 31(7): 805—816
[20] Wang Q, Xu J, Chai B,Functional comparison of metallothioneins MTT1 and MTT2 from[J]., 2011, 509(2): 170—176
[21] Chang Y, Feng L F, Xiong J,Function comparison and evolution analysis of metallothionein gene MTT2 and MTT4 in[J]., 2011, 32(5): 476—484 [畅悦, 冯立芳, 熊杰, 等. 嗜热四膜虫金属硫蛋白基因 MTT2 和 MTT4 的表达规律比较与进化模式分析. 动物学研究, 2011, 32(5): 476—484]
[22] Wang Q, Xu J, Zhu Y,Lanthanum(III) impacts on metallothionein MTT1 and MTT2 from[J]., 2011, 143(3): 1808—1818
[23] Blindauer C A. Metallothioneins with unusual residues: histidines as modulators of zinc affinity and reactivity [J]., 2008, 102(3): 507—521
ANALYSIS OF FUNCTIONAL COMPENSATION OF TWO DIFFERENT METALLOTHIONEIN SUBFAMILIES FROM
LU Jian-Gong, XU Jing, ZHANG Peng-Xing and WANG Wei
(Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
Metallothioneins inwere divided into two subfamilies: 7a including MTT1, MTT3 and MTT5 and 7b including MTT2 and MTT4. To explore whether these two subfamilies have functional compensation, the13 and24 gene knockout vectors were constructed.13 and24 somatic knockout strains were obtained by homologous recombination. We discovered that △13 mutant strains were more sensitive to Cd2+compared with the wild-type strain, and △24 mutant strains were more sensitive to Cu2+and H2O2compared with the wild-type strain. The diminished expression of5was observed in △strains, and 500 μmol/L Cu2+treatment upregulated the expression of1,3 and5 in △24 strains. The expression level of2,4 anddecreased in △13 mutant strains, and the treatment of 5 μmol/L Cd2+further diminished the expression level ofand4 by 4.9 and 2.5 times, respectively, but the treatment of 5 μmol/L Cd2+induced the expression of5. These results demonstrated thatMTT1, MTT3 and MTT5 were mainly involved in detoxification, MTT2 and MTT4 were mainly participated in normalcellular metabolism. These two different MTT subfamily proteins are interactional and have functional compensation in
; Metallothioneins; Gene knockout; RT-PCR
2013-01-25;
2013-12-20
国家自然科学基金(30770295, 31072000); 教育部科学技术研究重点项目(No. 201026)资助
卢剑功(1986—), 男, 山西太原人; 硕士; 主要研究方向为原生动物分子生物学。E-mail: ludamson@gmail.com
王伟(1970—), 男, 博士, 教授; 主要研究方向为原生动物分子生物学。E-mail: gene@sxu.edu.cn
Q344+.1
A
1000-3207(2014)02-0249-08
10.7541/2014.37

