斑马鱼侧线神经丘毛细胞发育的研究△
李雯 何英姿,2 # 孙珊 于慧前 李华伟,2
斑马鱼侧线系统(lateral line system, LL)是由皮肤衍生的重要感觉器官,具有感觉周围环境中的水流、水压、水温以及听觉等功能[1]。侧线系统以神经丘为基本单位,排列分布在头部、躯干部和尾部的体侧皮下,其发育存在固定模式。根据分布位置侧线系统分为:前部侧线系统(anterior lateral line, ALL) 和后部侧线系统(posterior lateral line, PLL)[2,3],前部侧线系统主要包括位于头部﹑眼眶上下缘﹑下颌和腮盖等处的神经丘细胞团,在受精后5天基本形成;后部侧线系统包括躯干和尾部的神经丘细胞团,由后部侧线原基(posterior lateral line primodium)细胞自头部眼眶后靠近耳部的外胚层基板开始向尾部迁徙,途中规律沉积多组神经丘(neuromast)发育而来;后部侧线系统已成为研究细胞迁移的重要模型[4]。研究表明,斑马鱼后部侧线系统的发育过程十分保守,当斑马鱼发育至受精后48小时(hours post fertilization,hpf)时,初级后部侧线系统基本发育完全,包括躯干部的5~6组神经丘细胞和尾部的2~3组神经丘细胞[2,5,6]。但是,关于斑马鱼初级后部侧线原基细胞团迁徙过程中的原基增殖情况、侧线神经丘的沉积时间及位置的研究则鲜有报道。
成熟的神经丘由位于中心的机械感受性毛细胞和周围的支持细胞组成[3]。侧线神经丘毛细胞在结构和功能上与哺乳动物的内耳毛细胞非常类似,是研究毛细胞发育﹑再生及凋亡的重要模型[2.,7]。神经丘毛细胞在受精后3~4天开始具备机械传导能力,逐渐发育成具备功能的侧线系统,同时,由于斑马鱼神经丘结构位于体表及其对特殊荧光染料的敏感性,可直接活体观察且便于操作。故本实验以斑马鱼为模型,以初级后部侧线神经丘和毛细胞作为观察目标,应用免疫荧光染色和原位杂交等方法研究斑马鱼初级后部侧线系统的形成模式;通过FM1-43FX荧光染料对斑马鱼侧线神经丘功能性毛细胞进行特异性标记的特点[8],结合转基因斑马鱼(Brn3c:mGFP)的应用[9],追踪观察侧线神经丘毛细胞的早期发育,为深入研究毛细胞发育及再生提供研究模型和技术手段。
1 材料与方法
1.1实验动物 野生型斑马鱼来自复旦大学分子医学教育部重点实验室。转基因斑马鱼(Brn3c:mGFP)由美国哈佛大学眼耳医院 Eaton-Peabody 实验室陈正一教授惠赠。斑马鱼在28.5 ℃恒温环境中生长,光周期为每天14小时光照,10小时黑暗,养殖方案按照《Zebrafish Book》(http://www.zfin.org)常规进行。
1.2实验方法
1.2.1斑马鱼胚胎收集和观察方法 为了确定斑马鱼初级后部侧线神经丘的发育模式,以躯干部的前5个初级神经丘(L1~L5)的沉积时间为标准,数值化衡量原基的迁移过程。从20 hpf开始至48 hpf每隔4小时收集50个胚胎, 共收集400个胚胎,采用DAPI荧光染色方法检测神经丘的数目。Tg(Brn3c:mGFP)转基因斑马鱼在侧线神经丘分化的毛细胞中表达绿色荧光蛋白(GFP)[9],为了进一步观察斑马鱼神经丘毛细胞的发育过程,选取3、5、7 dpf的 Brn3c:mGFP转基因斑马鱼,每个时间点收集12个胚胎, 共收集36个胚胎以L1~L5神经丘为研究对象,对侧线神经丘细胞及其中GFP阳性细胞数目进行计数。
1.2.2FM1-43FX染色与计数 FM1-43FX作为一种活细胞染料,可以用来验证存在的毛细胞是否有功能[8]。将收集的3、5、7 dpf斑马鱼胚胎(每个时间点收集12个胚胎共36个胎胚)浸入3 μM FM1-43FX(Molecular Probes, Eugene, OR, Invitrogen, F-35355)中避光孵育45秒,斑马鱼饲养用水洗涤3遍后,置于0.02% MS-222 (3-aminobenzoic acid ethylester, methanesulfonate salt, Sigma)中麻醉,荧光显微镜下对侧线神经丘FM1-43FX阳性细胞进行观察和计数。
1.2.3整体原位杂交 RNA探针制备:采用全斑马鱼反义RNA探针原位杂交方法在mRNA水平观察不同发育阶段cxcr7b的表达情况,靶基因cxcr7b编码区片段由本实验室克隆。反义RNA探针的合成按照说明书进行(The DIG RNA Labeling Kit; Roche)。收集斑马鱼胚胎,固定于4%多聚甲醛中,杂交步骤按照参照文献进行[10]。
1.2.4细胞增殖及分析 原基细胞增殖分析:采用不同发育阶段(24~44 hpf)的斑马鱼,每隔4小时收集20个胚胎,共120个胚胎,分别浸于15 mM的BrdU溶液中(斑马鱼饲养用水溶液配置)1小时,斑马鱼饲养用水洗涤3遍后,置于麻醉剂MS-222中麻醉;4%多聚甲醛室温固定2小时;所有标本经PBS洗涤3×5 min;置入2N HCl中于37 ℃变性处理30 min;PBS冲洗3×5 min;0.5%Triton X-100处理40 min;5%山羊血清室温封闭2小时;加入BrdU抗体(1:200),4 ℃孵育过夜,PBS洗涤3×5 min;加入荧光二抗TRITC conjugated goat anti-mouse (1:200),37 ℃避光孵育1小时;PBS洗涤3×5 min,抗淬灭剂封片,荧光显微镜下观察并拍照计数,计算BrdU指数(BrdU阳性细胞数/细胞总数)。
神经丘细胞增殖分析:收集3 dpf和5 dpf的斑马鱼各14个胚胎,共收集28个胚胎,分别给予10 mM的BrdU持续处理2天至5 dpf和7 dpf,斑马鱼饲养用水洗涤3遍后,再将其置于麻醉剂MS-222中麻醉,4%多聚甲醛固定2小时;所有标本经PBS洗涤3×5 min;置入2N HCl中于37 ℃变性处理30 min;PBS冲洗3×5 min;0.5%Triton X-100处理40 min;5%山羊血清室温封闭2小时;加入BrdU抗体(1:200),4 ℃孵育过夜,PBS洗涤3×5 min;加入荧光二抗FITC conjugated goat anti - mouse (1:200),37 ℃避光孵育1小时;PBS洗涤3×5 min,抗淬灭剂封片,荧光显微镜下观察并拍照计数,计算BrdU指数。
1.3统计学方法 实验数据以平均数±标准差表示,采用Student’st检验进行统计学分析。
2 结果
2.1斑马鱼后部侧线发育 DAPI荧光染色显示斑马鱼初级后部侧线系统的发育模式有严格的时间依赖性(表1,图1)。24 hpf,斑马鱼后部侧线原基前端迁徙至2.3±1.9肌节,未见神经丘细胞团沉积;至28 hpf时,原基前端迁徙至8.8±0.5肌节,第一组侧线神经丘细胞团(L1)沉积于5.23±0.8肌节处;32 hpf,原基前端迁徙至13.2±2.8肌节处,70%斑马鱼出现了L2神经丘细胞团,位于12.11±1.6肌节处;36 hpf,原基前端迁移至21.4±1.2肌节, L3神经丘细胞团沉积于16.5±1.6肌节处;40 hpf,96%斑马鱼出现了4~5组神经丘细胞团,L4位于20.5±2.0肌节处。44 hpf,94%的斑马鱼出现了5组或以上的神经丘细胞团, L5位于25.84±1.7肌节处。48 hpf,体侧共出现了7~9组侧线神经丘细胞团,其中5~6组神经丘细胞团位于躯干部,2~3组神经丘细胞团位于尾部。正常斑马鱼初级后部侧线原基迁徙速度约为1.7肌节/小时。
2.2侧线原基细胞的增殖 对斑马鱼初级后部侧线原基细胞进行BrdU染色观察和计数,结果表明,细胞增殖在原基迁移的过程中贯彻始终(图2)。在未沉积神经丘细胞团时,原基的BrdU指数为0.43±0.08,随着原基迁移的进行,在L1 至 L5神经丘细胞团沉积后,原基细胞的BrdU指数分别为0.45±0.08、0.43±0.09、0.44±0.08、0.42±0.1、0.41±0.06。

表1 不同发育时期斑马鱼躯干部形成不同个数神经丘细胞团胚胎的构成比(%)
2.3侧线神经丘毛细胞发育 统计数据显示:3~7 dpf,斑马鱼侧线神经丘GFP阳性的毛细胞数目显著增多,各组间差异有统计学意义(P<0.05);进一步对躯干部L1~L5神经丘毛细胞进行FM1-43FX染色计数,结果显示FM1-43FX阳性细胞的数量随着天数的增加而逐渐增多,各组间差异有统计学意义(P<0.05)(表2,图3)。提示3~7 dpf是侧线神经丘毛细胞发育的活跃时期,其中受精后3~5天,毛细胞的发育活动最为剧烈,并开始具备功能。
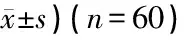
表2 3~5 dpf斑马鱼侧线神经丘毛细胞发育比较(个,
注:*与3 dpf组比较,P<0.05
2.4侧线神经丘细胞的增殖 神经丘细胞在3~5 dpf和5~7 dpf时的增殖情况见图4,可见,受精后3~5天,斑马鱼神经丘细胞增殖速度相对较快,3~5 dpf和5~7 dpf时神经丘细胞的BrdU指数分别为0.27±0.05和0.23±0.04。
3 讨论
内耳毛细胞不可逆性损伤是导致感音性聋的主要原因[11]。哺乳动物内耳毛细胞在分化成熟后不具备自我修复和再生的能力,因此毛细胞的损伤和再生是感音性聋治疗的热点之一[12,13]。研究表明,鸟类和某些鱼类(如斑马鱼)﹑两栖类动物的前庭和耳蜗毛细胞损伤后可以完全再生,且伴有前庭和听觉功能的恢复[12,14,15]。斑马鱼的基因与人类相似度高达87%,遗传背景清楚,且具有发育周期短﹑繁殖能力强、胚胎发育体外完成及发育早期胚胎身体透明等优点,备受生物学家关注。此外,斑马鱼侧线神经丘毛细胞在结构和功能上与哺乳类动物内耳毛细胞非常类似,故其作为研究毛细胞发育和再生的模式生物具有独特优势。
斑马鱼胚胎发育非常迅速,在受精后6~72 小时期间,胚胎经历了原肠胚期、器官发生期、成熟期、孵出期等发育的重要阶段,几乎全部器官都在此阶段内形成。既往研究显示[16],在斑马鱼侧线系统的发育过程中,头部眼眶后靠近耳部的外胚层基板产生体表神经丘和感觉神经节;耳后的表皮增厚形成后部侧线基板,基板靠近后部的大部分细胞构成初级后部侧线原基,包括大约100个表皮细胞,在受精后20小时开始沿水平肌膈向后进行迁移,待发育至48 hpf时,初级侧线系统基本形成。本研究结果显示,斑马鱼在发育至28 hpf时,几乎全部出现了第一组侧线神经丘细胞团,此后每隔4小时左右沉积1组神经丘细胞团,且神经丘细胞团的沉积位置较为固定。发育至48 hpf时,斑马鱼幼体出现9组侧线神经丘细胞,此时初级后部侧线神经丘的发育基本完成,与Ledent等[16]的研究结果吻合。

图1 斑马鱼初级后部侧线系统的发育过程
a, 24 hpf斑马鱼躯干部未见侧线神经丘细胞团形成; b, 28 hpf斑马鱼躯干部出现了1组侧线神经丘细胞团 (L1); c, 32 hpf斑马鱼躯干部出现了2组神经丘细胞团 (L1~L2); d, 36 hpf斑马鱼躯干部出现了3组侧线神经丘细胞团 (L1~L3); e, 44 hpf斑马鱼躯干部出现了5组神经丘细胞团 (L1~L5); f, 48 hpf Tg(Brn3c:mGFP)转基因斑马鱼出现了躯干部的6组神经丘细胞团和尾部的2组神经丘细胞团; g, 原位杂交结果显示,32 hpf斑马鱼躯干部出现2组神经丘细胞团; h, 原位杂交显示,40 hpf斑马鱼躯干部出现4组神经丘细胞团; i, 原位杂交显示,48 hpf斑马鱼出现了躯干部的5组神经丘细胞团和尾部的2组神经丘细胞团。PrimI (primary posterior lateral line primordium):初级后部侧线原基
a,未沉积神经丘时,b~f,分别为沉积神经丘L1、L2、L3、L4、L5后的增殖情况。BrdU染色(红色)标记原基中的增殖细胞

图3 斑马鱼侧线神经丘毛细胞发育情况
a,3 dpf; b,5 dpf;c,7 dpf;DAPI(蓝色)为神经丘细胞,GFP(绿色)为已分化的毛细胞,FM1-43FX染色(红色)显示神经丘中有功能的毛细胞

图4 斑马鱼侧线神经丘细胞的增殖情况
a,3~5 dpf; b,5~7 dpf;DAPI(蓝色)为神经丘细胞,BrdU染色(绿色)标记神经丘中的增殖细胞,FM1-43FX染色(红色)显示毛细胞
斑马鱼是较成熟的研究细胞迁移相关信号通路的重要模型。研究发现后部侧线原基细胞的迁移受2种趋化因子受体cxcr4b和cxcr7b的调控[17]。Dambly-Chaudiere等[17]详尽地阐述了cxcr4b和cxcr7b在后侧原基细胞内的表达分布及其在原基迁移和神经丘细胞沉积过程中的重要作用,cxcr4b主要表达在原基细胞团的前部,其突变体可导致侧线原基迁徙停滞[18,19];cxcr7b最初从狗的甲状腺cDNA库中克隆得到,过去被称为狗受体基因1(receptor dong cDNA1,RDC1)[20],斑马鱼的cxcr7b基因与人类cxcr7b基因的同源性高达54%,cxcr7b是高度保守的G-蛋白偶联七次跨膜蛋白受体,能够与基质细胞衍生因子(stromal cellerived factor-1,SDF-1) 结合,形成SDF1/CXCR7生物学轴,从而在胚胎发育、调控细胞迁移、参与肿瘤侵袭和转移、介导免疫炎症反应等方面发挥生物学功能。斑马鱼侧线系统中cxcr7b主要表达于后部侧线原基细胞团的尾部以及新沉积的神经丘细胞中, 推测其与神经丘的沉积有关。近年来针对原基的研究发现cxcr4b和cxcr7b这两个趋化因子受体的表达可与无翅型MMTV整合位点家族(wingless-type MMTV integration site family members,Wnt)信号转导通路和成纤维细胞生长因子(fibroblast growth factors,FGF)信号通路发生交互作用,从而调控原基细胞的迁移与神经丘的沉积过程[20]。Wnt信号和FGF配体通常分布于原基细胞团的头部,而FGF激活信号仅分布在原基的尾部,Wnt信号可诱导FGF配体表达而激活尾部的FGF信号通路,原基尾部的FGF信号则通过诱导Dkk1的表达,从而抑制尾部的Wnt/β-catenin信号通路。Wnt和FGF信号在原基的作用表现为互斥性。Wnt/β-catenin激活信号可维持趋化因子受体cxcr4b和cxcr7b的极性,Wnt/β-catenin信号抑制原基头部细胞cxcr7的表达而将其限制在原基尾部,并可通过未知受体抑制尾部细胞cxcr4的表达,从而在原基细胞的迁移过程中起重要作用。Wnt/β-catenin信号亦可通过影响FGF信号通路而改变神经丘细胞的周期性沉积。原基中FGF信号通路受抑,可影响神经丘的沉积使之数目减少。
后部侧线系统的发育模式包括细胞的增殖﹑迁移以及分化过程。研究表明,原基细胞在迁移过程中不断地进行增殖,这种细胞增殖在时间和空间上具有固定模式,Laguerre等[21]推测细胞增殖在侧线系统的形成过程中起着不可忽视的重要作用;Aman等[22]认为原基细胞的增殖与神经丘的周期性沉积有关,使用细胞周期抑制剂阻碍原基细胞增殖,可观察到迁徙过程中沉积下的神经丘数量减少,而原基的迁徙速度并未受到影响。研究还认为Wnt/β-catenin和FGF信号通路的交互作用对原基细胞的增殖有重要作用,阻断任何一个信号通路均会减少细胞的增殖[20]。本研究探索了斑马鱼早期发育阶段(24~40 hpf)原基的增殖情况,结果显示原基细胞在迁移过程中均保持着较高的增殖状态,且细胞增殖主要发生在原基的头部区域,这种持续的细胞增殖为原基的正常迁移提供了形态基础,使得原基在固定位置沉积下神经丘后仍可保持一定的基数,继续向后迁移直至迁徙过程完成。
FM1-43FX为一种双极性的活动依赖性荧光染料,其亲水与亲脂基团分别位于分子两端,在水溶液中几乎不发荧光。在大多数细胞中,FM1-43FX不能穿过脂质双分子层,而当其疏水性的尾部插入到脂膜后,才能够被激发从而产生荧光,该特性能够较好地用于细胞内吞和胞吐作用的研究。FM1-43FX标记毛细胞被认为是钙和钙调蛋白依赖性的结果,染料可通过毛细胞顶端的内吞作用快速进入细胞内,可直接在荧光显微镜下观察有功能毛细胞的形态、数目。本研究显示,随着斑马鱼侧线系统的发育成熟,斑马鱼出膜(48 hpf)后5天是侧线神经丘分化的活跃时期,特别是受精后3至5天,侧线神经丘毛细胞的发育活动最为剧烈。若在该时期调控侧线发育相关基因或给予干扰因素处理,可能会影响侧线神经丘毛细胞的发育和分化。
本研究利用免疫荧光染色和整体原位杂交等方法观察了斑马鱼后部侧线神经丘的沉积过程,对初级侧线神经丘(L1~L5)的沉积时间和位置进行了定量研究。同时利用Brn3c:mGFP转基因斑马鱼和荧光染料FM1-43FX,示踪神经丘毛细胞的发育过程。本研究所建模型易于观察和检测毛细胞的发育, 且方法简单,为深入研究侧线系统发育提供了理论依据,也为耳毒性药物筛选提供了动物模型和技术手段。
4 参考文献
1 Montgomery J, Carton G, Voigt R, et al. Sensory processing of water currents by fishes[J]. Philos Trans R Soc Lond B Biol Sci, 2000, 355:1 325.
2 Raible DW, Kruse GJ. Organization of the lateral line system in embryonic zebrafish[J]. J Comp Neurol, 2000, 421:189.
3 Metcalfe WK, Kimmel CB, Schabtach E. Anatomy of the posterior lateral line system in young larvae of the zebrafish[J]. J Comp Neurol, 1985, 233:377.
4 Dambly-Chaudiere C, Sapede D, Soubiran F, et al. The lateral line of zebrafish: a model system for the analysis of morphogenesis and neural development in vertebrates[J]. Biol Cell, 2003, 95:579.
5 Gompel N, Cubedo N, Thisse C, et al. Pattern formation in the lateral line of zebrafish[J]. Mech Dev, 2001, 105:69.
6 Ghysen A, Dambly-Chaudiere C. Development of the zebrafish lateral line[J]. Curr Opin Neurobiol, 2004, 14:67.
7 Nicolson T. The genetics of hearing and balance in zebrafish[J]. Annu Rev Genet, 2005, 39:9.
8 Gale JE, Marcotti W, Kennedy HJ, et al. FM1-43 dye behaves as a permeant blocker of the hair-cell mechanotransducer channel[J]. J Neurosci, 2001, 21:7 013.
9 Xiao T, Roeser T, Staub W, et al. A GFP-based genetic screen reveals mutations that disrupt the architecture of the zebrafish retinotectal projection[J]. Development, 2005, 132:2 955.
10 Thisse C, Thisse B. High-resolution in situ hybridization to whole-mount zebrafish embryos[J]. Nat Protoc, 2008, 3:59.
11 Amatuzzi M, Liberman MC, Northrop C. Selective inner hair cell loss in prematurity: a temporal bone study of infants from a neonatal intensive care unit[J]. J Assoc Res Otolaryngol, 2011, 12:595.
12 Corwin JT, Cotanche DA. Regeneration of sensory hair cells after acoustic trauma[J]. Science, 1988, 240:1 772.
13 Chardin S, Romand R. Regeneration and mammalian auditory hair cells[J]. Science, 1995, 267:707.
14 Corwin JT, Oberholtzer JC. Fish n' chicks: model recipes for hair-cell regeneration[J]? Neuron, 1997, 19:951.
15 Jones JE, Corwin JT. Regeneration of sensory cells after laser ablation in the lateral line system: hair cell lineage and macrophage behavior revealed by time-lapse video microscopy[J]. J Neurosci, 1996, 16:649.
16 Ledent V. Postembryonic development of the posterior lateral line in zebrafish[J]. Development, 2002, 129:597.
17 Dambly-Chaudiere C, Cubedo N, Ghysen A. Control of cell migration in the development of the posterior lateral line: antagonistic interactions between the chemokine receptors CXCR4 and CXCR7/RDC1[J]. BMC Dev Biol, 2007, 7:23.
18 David NB, Sapede D, Saint-Etienne L, et al. Molecular basis of cell migration in the fish lateral line: role of the chemokine receptor CXCR4 and of its ligand, SDF1[J]. Proc Natl Acad Sci USA, 2002, 99:16 297.
19 Li Q, Shirabe K, Kuwada JY. Chemokine signaling regulates sensory cell migration in zebrafish[J]. Dev Biol, 2004, 269:123.
20 Libert F, Parmentier M, Lefort A, et al. Complete nucleotide sequence of a putative G protein coupled receptor:RDC1[J]. Nucleic Acids Res, 1990,18:1 917.
21 Laguerre L, Soubiran F, Ghysen A, et al. Cell proliferation in the developing lateral line system of zebrafish embryos[J]. Dev Dyn, 2005, 233:466.
22 Aman A, Piotrowski T. Wnt/beta-catenin and Fgf signaling control collective cell migration by restricting chemokine receptor expression[J]. Dev Cell, 2008, 15:749.
23 Aman A, Nguyen M, Piotrowski T. Wnt/beta-catenin dependent cell proliferation underlies segmented lateral line morphogenesis[J]. Dev Biol, 2011, 349:470.

