新型噻吩-2-甲醛不对称双缩二氨基硫脲衍生物的合成及其抗菌活性*
仇丽颖,赵志刚,李琳,张丽娜
(西南民族大学化学与环境保护工程学院,四川成都 610041)
新型噻吩-2-甲醛不对称双缩二氨基硫脲衍生物的合成及其抗菌活性*
仇丽颖,赵志刚,李琳,张丽娜
(西南民族大学化学与环境保护工程学院,四川成都 610041)
1,3-二氨基硫脲与芳香醛在冰醋酸催化下经缩合反应制得一系列单缩二氨基硫脲(3a~3k);3a~3k分别与噻吩-2-甲醛进一步缩合合成了11个新型的噻吩-2-甲醛不对称双缩二氨基硫脲类衍生物(5a~5k),其结构经1H NMR,IR,ESI-MS和元素分析表征。初步抗菌活性测定结果表明:部分目标化合物对枯草芽孢杆菌具有抑菌活性;5d对金黄色葡萄球菌的IC50为4.29,优于对照药阿莫西林(IC506.4)。
噻吩-2-甲醛;双缩二氨基硫脲;合成;抗菌活性
噻吩是一类大量天然存在于石油中,具有多种生理活性和重要药用价值的杂环化合物。由于近年来已证实许多含有噻吩结构的化合物及其衍生物具有广谱的生物活性,表现出良好的抗菌、抗真菌、抗炎、抗肿瘤、抗病毒、抗氧化、除草、杀虫、调节植物生长、抗HIV和抗结核等生物活性,而引起药物化学界和农学界广泛的研究兴趣[1-5]。
Schiff碱作为生物活性剂、分析试剂、稳定剂、螯合剂、催化剂,广泛地用于科学研究和化工生产领域。其中含杂环Schiff碱类化合物表现出的生物活性尤为突出[6],同时该类Schiff碱金属螯合物也具有较为明显的药理活性。近几十来,缩氨基硫脲类Schiff碱化合物由于抗菌、抗癌、抗炎、抗肿瘤、抗病毒、抗真菌、抗疟疾、抗氧化、细胞毒性等鲜明的生物活性[7],继而作为新药研发的重要前导物活跃于医药学和生理学等研究领域。此外,在对缩氨基硫脲类Schiff碱修饰物的进一步研究中发现,缩氨基硫脲及其衍生物作为组织蛋白酶抑制剂、蘑菇络氨酸酶抑制剂、酚氧化酶抑制剂、质子转移促进剂、离子载体、荧光传感器及催化剂受到越来越广泛的关注与运用。
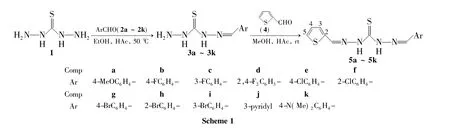
为了寻找具有广谱的杀菌性和高活性的新化合物,并研究其结构与生物活性间的关系,本文根据活性亚结构拼接原理,将噻吩环引入单缩二氨基硫脲结构中,合成既含有噻吩杂环结构,又含有缩氨基硫脲亚胺结构的新型化合物,可能实现活性叠加,以期筛选出新的Schiff碱类活性化合物。以1,3-二氨基硫脲(1)为起始原料,与芳香醛(2a~2k)在冰醋酸催化下经缩合反应制得一系列单缩二氨基硫脲(3a~3k);3a~3k分别与噻吩-2-甲醛(4)进一步缩合合成了11个新型的噻吩-2-甲醛不对称双缩二氨基硫脲类衍生物(5a~5k,Scheme 1),其结构经1H NMR,IR,ESI-MS和元素分析表征。并研究了5a~5k对大肠杆菌、枯草芽孢杆菌、绿脓杆菌及金黄色葡萄球菌的体外抗菌活性。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪(温度未校正);Agilent-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);PERKIN-ELMER 1700型红外光谱仪(KBr压片);FINNIGAN-LCQ型质谱仪;VarioMICRO型自动元素分析仪;三申-YX280A型手提式高压蒸汽灭菌锅:东联-DL-CJ-1N型垂直层流洁净工作台;友联-HY-2A型数显调速多用振荡器;锐品-ECA-9272型电热恒温培养箱。
3 a~3k按文献[8-13]方法合成;供试菌种大肠杆菌(ATCC 35218)、枯草芽孢杆菌(ATCC 6633)、绿脓杆菌(ATCC 27853)及金黄色葡萄球菌(ATCC 6538),中国普通微生物菌种保藏管理中心;其余所用试剂均为分析纯。
1.2 合成
(1)5a~5k的合成通法
在反应瓶中依次加入4 62 mg(0.55 mmol),3a~3k 0.5 mmol,甲醇15 mL和冰醋酸48 mg,搅拌下于室温反应10 h~12 h(TLC检测)。过滤,滤饼用乙醇重结晶得5a~5k,收率74%~84%。
5 a:淡黄色晶体,收率81%,m.p.180℃~181℃;1H NMR δ:11.78(s,1H,NH),11.48 (s,1H,NH),8.79(s,1H,N=CH),8.09(s,1H,N=CH),7.81(s,2H,ArH),7.69(d,J= 3.2 Hz,1H,5-H),7.45(s,1H,3-H),7.15 (dd,J=4.4 Hz,4.0 Hz,1H,4-H),7.02(d,J=8.4 Hz,2H,ArH),3.82(s,3H,OCH3);IR ν:3 269,3 109,3 060,2 965,1 603,1 536,1 507,1 420,1 292,1 246,1 023,832 cm-1; ESI-MS m/z(%):659{[2M+Na]+,100};A-nal.calcd for C14H14N4OS2:C 52.81,H 4.43,N 17.60;found C 52.92,H 4.41,N 17.62。
5 b:淡黄色晶体,收率74%,m.p.187℃~189℃;1H NMR δ:11.90(s,1H,NH),11.56 (s,1H,NH),8.80(s,1H,N=CH),8.14(s,1H,N=CH),7.94(s,1H,ArH),7.81(s,1H,ArH),7.70(d,J=4.8 Hz,1H,5-H),7.47(s,1H,3-H),7.29~7.34(m,2H,ArH),7.14~7.17(m,1H,4-H);IR ν:3 278,3 133,1 656,1 600,1 544,1 505,1 229,1 121,835,795 cm-1;ESI-MS m/z(%):635{[2M+Na]+,100};Anal.calcd for C13H11N4S2F:C 50.96,H 3.62,N 18.29;found C 50.86,H 3.60,N 18.31。
5 c:白色晶体,收率76%,m.p.177℃~179℃;1H NMR δ:11.97(s,1H,NH),11.59(s,1H,NH),8.82(s,1H,N=CH),8.14(s,1H,N=CH),7.92(s,1H,ArH),7.70(d,J=4.4 Hz,1H,5-H),7.59(d,J=7.6 Hz,1H,3-H),7.51(dd,J=7.6,6.4 Hz,2H,ArH),7.26~7.30(m,1H,ArH),7.16(dd,J=4.0,4.4 Hz,1H,4-H);IR ν:3 252,3 136,3 066,1 585,1 537,1 256,1 132,783,711 cm-1;ESI-MS m/z (%):307{[M+H]+,100};Anal.calcd for C13H11N4S2F:C 50.96,H 3.62,N 18.29;found C 50.84,H 3.63,N 18.27。
5 d:白色晶体,收率82%,m.p.221℃~222 ℃;1H NMR δ:11.99(s,1H,NH),11.60(s,1H,NH),8.79(s,1H,N=CH),8.38(s,1H,N=CH),8.32(s,1H,ArH),7.71(d,J=3.6 Hz,1H,5-H),7.48(s,1H,3-H),7.37(dd,J=9.6 Hz,10.0 Hz,1H,ArH),7.24(dd,J= 8.0 Hz,8.4 Hz,1H,ArH),7.16(t,J=4.0 Hz,1H,4-H);IR ν:3 263,3 181,1 609,1 534,1 502,1 268,1 222,1 187,1 133,890,820 cm-1;ESI-MS m/z(%):671{[2M+Na]+,100}; Anal.calcd for C13H10N4S2F2:C 48.14,H 3.11,N 17.27;found C 48.19,H 3.10,N 17.31。
5 e:淡黄色晶体,收率84%,m.p.183℃~184℃;1H NMR δ:11.94(s,1H,NH),11.58 (s,1H,NH),8.79(s,1H,N=CH),8.12(s,1H,N=CH),7.90(s,2H,ArH),7.70(d,J= 4.4 Hz,1H,5-H),7.53(d,J=8.4 Hz,2H,ArH),7.47(s,1H,3-H),7.16(dd,J=4.0 Hz,4.8 Hz,1H,4-H);IR ν:3 290,3 264,3 109,1 593,1 533,1 487,1 248,1 086,827 cm-1; ESI-MS m/z(%):667{[2M+Na]+,100};A-nal.calcd for C13H11N4S2Cl:C 48.36,H 3.43,N 17.35;found C 48.47,H 3.42,N 17.31。
5 f:黄色晶体,收率78%,m.p.190℃~192 ℃;1H NMR δ:12.07(s,1H,NH),11.63(s,1H,NH),8.81(s,1H,N=CH),8.57(s,1H,N=CH),8.38(s,1H,ArH),7.71(d,J=4.4 Hz,1H,5-H),7.53(dd,J=2.0 Hz,6.8 Hz,1H,ArH),7.48(s,1H,3-H),7.42~7.46(m,2H,ArH),7.16(t,J=4.4 Hz,1H,4-H);IR ν: 3 262,3 186,1 592,1 526,1 513,1 465,1 255,1 081,751 cm-1;ESI-MS m/z(%):667{[2M+ Na]+,100};Anal.calcd for C13H11N4S2Cl:C 48.36,H 3.43,N 17.35;found C 48.28,H 3.44,N 17.38。
5 g:黄色晶体,收率82%,m.p.189℃~190 ℃;1H NMR δ:11.93(s,1H,NH),11.58(s,1H,NH),8.79(s,1H,N=CH),8.10(s,1H,N=CH),7.82(s,2H,ArH),7.70(d,J=4.4 Hz,1H,5-H),7.66(d,J=8.0 Hz,2H,ArH),7.47(s,1H,3-H),7.15~7.17(m,1H,4-H); IR ν:3 272,3 144,3 069,1 593,1 533,1 261,1 064,826 cm-1;ESI-MS m/z(%):757{[2M+ Na]+,100};Anal.calcd for C13H11N4S2Br:C 42.51,H 3.02,N 15.25;found C 42.60,H 3.03,N 15.20。
5 h:黄色晶体,收率78%,m.p.126℃~127 ℃;1H NMR δ:12.09(s,1H,NH),11.63(s,1H,NH),8.81(s,1H,N=CH),8.54(s,1H,N=CH),8.36(s,1H,ArH),7.71(brs,2H,5-H,ArH),7.48(brs,2H,3-H,ArH),7.38(s,1H,ArH),7.17(s,1H,4-H);IR ν:3 276,3 139,1 597,1 539,1 466,1 257,1 075,1 033,753 cm-1;ESI-MS m/z(%):757{[2M+Na]+,100};Anal.calcd for C13H11N4S2Br:C 42.51,H 3.02,N 15.25;found C 42.63,H 3.03,N 15.28。
5 i:黄色晶体,收率83%,m.p.140℃~141 ℃;1H NMR δ:11.98(s,1H,NH),11.65(s,1H,NH),8.82(s,1H,N=CH),8.23(s,1H,N=CH),8.11(s,1H,ArH),7.76(s,1H,ArH),7.71(s,1H,5-H),7.63(s,1H,ArH),7.50(s,1H,ArH),7.42(s,1H,3-H),7.16 (s,1H,4-H);IR ν:3 279,3 131,1 596,1 539,1 257,1 071,784,708,685 cm-1;ESIMS m/z(%):757{[2M+Na]+,100};Anal. calcd for C13H11N4S2Br:C 42.51,H 3.02,N 15.25;found C 42.64,H 3.03,N 15.20。
5 j:白色晶体,收率79%,m.p.189℃~190 ℃;1H NMR δ:12.05(s,1H,NH),11.60(s,1H,NH),9.03(s,1H,PyH),8.81(s,1H,N= CH),8.61(s,1H,PyH),8.30(s,1H,PyH),8.16(s,1H,N=CH),7.71(s,1H,5-H),7.48 (brs,2H,3-H,PyH),7.16(s,1H,4-H);IR ν: 3 258,3 122,3 059,1 599,1 537,1 255,831,707 cm-1;ESI-MS m/z(%):601{[2M+Na]+,100};Anal.calcd for C12H11N5S2:C 49.81,H 3.83,N 24.20;found C 49.92,H 3.81,N 24.24。
5 k:淡黄色晶体,收率80%,m.p.180℃~181℃;1H NMR δ:11.65(s,1H,NH),11.39 (s,1H,NH),8.79(s,1H,N=CH),8.01(s,1H,N=CH),7.68(brs,3H,5-H,ArH),7.43 (s,1H,3-H),7.15(s,1H,4-H),6.75(d,J= 5.2 Hz,2H,ArH),2.98(s,6H,CH3);IR ν: 3 232,3 130,2 980,2 844,1 601,1 515,1 432,1 367,1 262,821 cm-1;ESI-MS m/z(%):685{[2M+Na]+,100};Anal.calcd for C15H17N5S2: C 54.35,H 5.17,N 21.13;found C 54.24,H 5.15,N 21.16。
1.3 抗菌活性测试
采用试管两倍稀释法[14]和纸片扩散法[15]对5a~5k进行抗菌活性筛选,同时分别计算其MIC 和IC50值。每个测试重复三次,以现有药物阿莫西林作为阳性对照,DMSO为阴性对照。
(1)MIC值
将活化后的细菌接种在牛肉汤培养基中,菌液浓度配成0.5麦氏比浊标准,稀释100倍备用,用2 mL容量瓶,对目标物和阿莫西林分别选取无菌DMSO溶解定容,得到的母液浓度为:1 280 μg·mL-1。采用试管二倍稀释法将母液依次稀释为:(256,128,64,32,16,8,4,2,1,0.5,0.25,0)μg·mL-1。将1 mL配制好菌液加入各梯度浓度药物原液,37℃恒温培养20 h,观察结果并记录MIC值。
(2)IC50值
用2 mL容量瓶,对目标物和阿莫西林分别选取无菌DMSO溶解定容,得到的母液浓度为:640 μg·mL-1。取无菌试管将母液依次稀释为: (640,320,160,80,40,20,10,5,0)μg· mL-1。将活化后的细菌接种在牛肉汤培养基中,菌液浓度配成0.5麦氏比浊标准,稀释100倍后,用无菌棉沾取试验菌液在营养琼脂培养基平板表面均匀涂抹3次,室温干燥5 min.将含有400 μL各梯度浓度药液的无菌干燥滤纸片,贴放于培养基平板表面。37℃恒温培养18 h后观察结果,测量抑菌圈直径大小并计算IC50值。
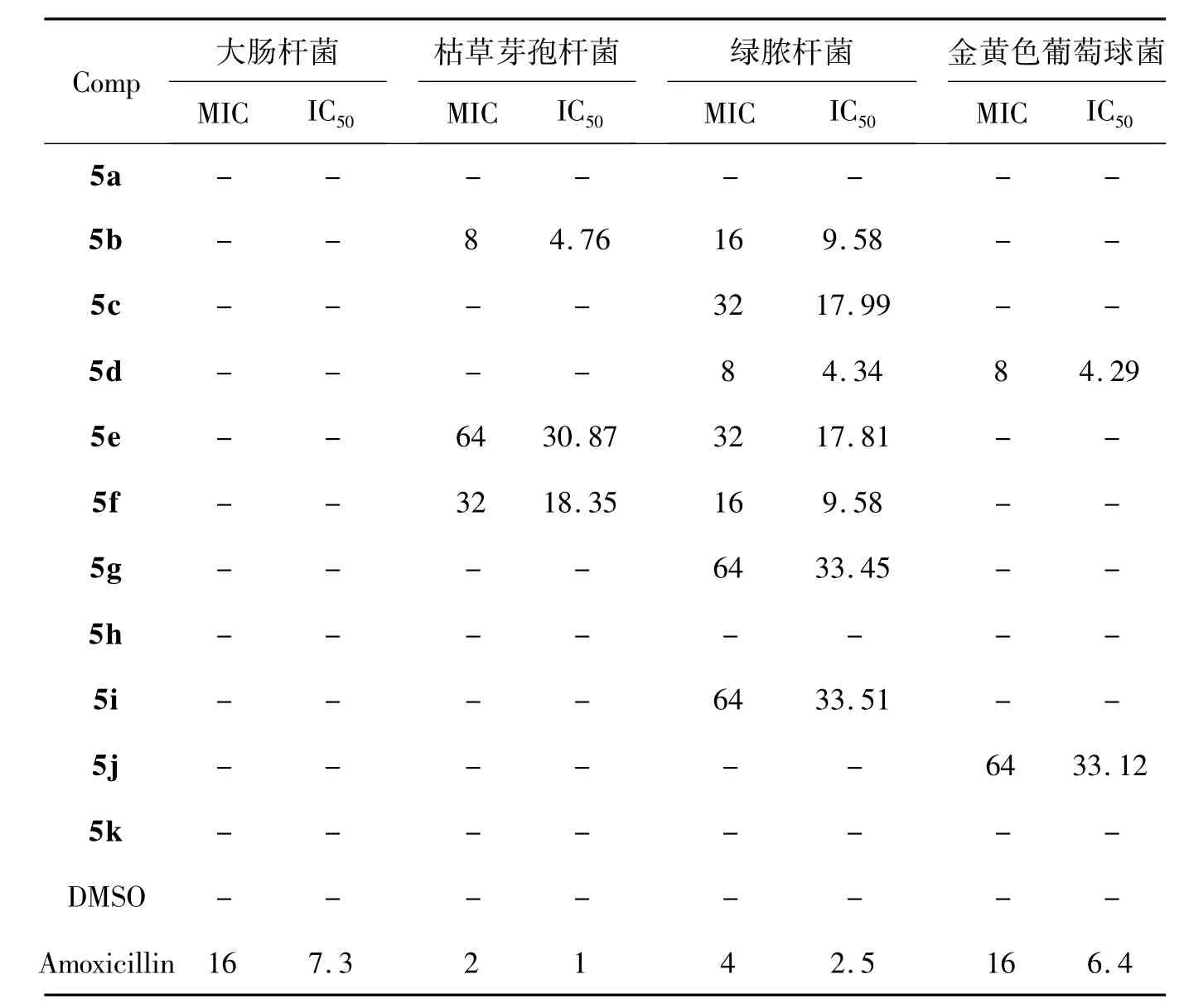
表1 5a~5k的抗菌活性*Table 1Antibacterial activities of 5a~5k
2 结果与讨论
2.1 表征
5 a~5k的1H NMR分析表明,11.39~12.09处的2个单峰为NH质子吸收峰;8.01~8.82处的单峰为N=CH质子吸收峰;7.68~7.71,7.42~7.59和7.14~7.17分别为噻吩环上5-位、3-位及4-位质子吸收峰。
IR分析表明,5a~5k 在3 109 cm-1~3 290 cm-1处的中等强度吸收峰归属N-H;1 515 cm-1~1 544 cm-1附近为C=N吸收峰; 1 229 cm-1~1 268 cm-1左右出现C=S的中等强度吸收峰。
5 a~5k的ESI-MS分析结果与预期结构一致。元素分析结果显示所有化合物的组成与理论分析值相符。
以上分析结果表明,5a~5k为Scheme 1预期产物。
2.2 抗菌活性
表1为5a~5k的抗菌活性数据。由表1可见,部分测试化合物对枯草芽孢杆菌、绿脓杆菌和金黄色葡萄球菌具有不同程度的抑制活性;5a~5k对大肠杆菌均未表现出抑制作用;5b,5e和5f对枯草芽孢杆菌具有抑制效果,说明引入卤素原子有利于提高化合物的抗菌活性;而对抑制绿脓杆菌而言,过半化合物显示出抗菌效果,其中5d抗菌活性优于其他化合物,并且在该系列化合物中,抗菌活性呈现出4-F>4-Cl>4-Br规律。此外,对金黄色葡萄球菌,5d的抗菌效果优于5j和对照药阿莫西林。
3 结论
以较高收率合成了一系列新型噻吩-2-甲醛不对称双缩二氨基硫脲类化合物(5a~5k)。抗菌活性测试结果表明:部分目标化合物抗菌活性良好,其中5b和5d的抗菌效果尤为突出。该研究结果为5b和5d作为新药研发先导化合物进行进一步结构优化与构效关系研究提供了依据。
5 a~5k的其他活性效果及其构效关系研究正在进一步进行中,将另文发表。
[1]Saghir A,Mukhtiar H,Saqib A,et al.Structural,en
zyme inhibition,antibacterial and DNA protection studies of organotin(Ⅳ)derivatives of thiophene-2-carboxylic acid[J].J Organomet Chem,2013,724:255-261.
[2]Mahender B D,Amit S W,Celine V,et al.Thieno [2,3-d]pyrimidinedione derivatives as antibacterial agents[J].Eur J Med Chem,2012,51:145-153.
[3]Kusai A,Vincent G,Magali A,et al.Synthesis,crystal structure,characterisation,and antifungal activity of 3-thiophene aldehyde semicarbazone(3STCH),2,3-thiophene dicarboxaldehyde bis(semicarbazone)(2,3BSTCH2)and their nickel(Ⅱ)complexes[J].J Inorg Biochem,2012,115:36-43.
[4]Muhammad H,Zahid H C.Design,spectral characterization and biological studies of transition metal(Ⅱ) complexes with triazole Schiff bases[J].Spectrochim Acta,Part A,2013,104:468-476.
[5]Hayam M A,Omaima G S,Ola H R,et al.Synthesis and biological evaluation of thieno[2',3':4,5]pyrimido[1,2-b][1,2,4]triazines and thieno[2,3-d][1,2,4]triazolo[1,5-a]pyrimidines as anti-inflammatory and analgesic agents[J].Eur J Med Chem,2013,62: 341-351.
[6]Krzysztof S,Agata M,Anna O,et al.An insight into synthetic Schiff bases revealing antiproliferative activities in vitro[J].Bioorg Med Chem,2013,21: 3648-3666.
[7]Zahino E V,Giles F L,Garcia P T,et al.Co(Ⅲ),Ni(Ⅱ),Zn(Ⅱ)and Cd(Ⅱ)complexes with 2-acetyl-2-thiazolinethiosemicarbazone:Synthesis,characterization,X-ray structures and antibacterial activity[J]. Eur J Med Chem,2011,46:150-159.
[8]Shi Z C,Zhao Z G,Liu M,et al.Solvent-free synthesis of novel unsymmetric chenodeoxycholic acid bis thiocarbazone derivatives promoted by microwave irradiation and evaluation of their antibacterial activity [J].C R Chimie,2013,16:977-984.
[9]Shi Z C,Zhao Z G,Liu X L,et al.Synthesis of new deoxycholic acid bis thiocarbazones under solvent-free conditions using microwave irradiation[J].J Chem Res,2011,35:198-201.
[10]Dabholkar V V,Ravi T D.Efficient synthesis of some novel spiro heterocycles containing triazine nucleus and their microbiological activity[J].Indian J Chem,2010,49B:593-597.
[11]Zheng L,Xu F,Zhao Y L.Microwave induced efficient synthesis of(un)substituted benzaldehyde(5-aryl-1,3,4-thiadiazol-2-yl)hydrazones using silica-supported dichlorophosphate as a recoverable dehydrant [J].J Heterocyclic Chem,2008,45:1489-1492.
[12]Han F,Bao Y H,Yang Z G,et al.Simple bisthiocarbonohydrazones as sensitive,selective,colorimetric,and switch-on fluorescent chemosensors for fluoride anions[J].Chem Eur J,2007,13:2880-2892.
[13]Barbu S,Macarovici C G.Physiko-chemische studien einiger thiocarbohydrazone aromatischer und heteroaromatischer aldehyde[J].Rev Roum Chim,1978,23:1243-1249.
[14]杨航,张小艺,王鲁.金英黄归液的抑菌作用分析[J].畜牧兽医学报,2013,44:1494-1498.
[15]Nweze E I,Mukherjee P K,Ghannoum M A.Agarbased disk diffusion assay for susceptibility testing of dermatophytes[J].J Clin Microbiol,2010,48: 3750-3752.
Synthesis and Antibacterial Activities of Novel Thiophene-2-formaldehyde Unsymmetrical Bisthiosemicarbazone Derivatives
QIU Li-ying,ZHAO Zhi-gang,LI Lin,ZHANG Li-na
(College of Chemistry and Environmental Protection Engineering,Southwest University for Nationalities,Chengdu 610041,China)
Eleven novel unsymmetrical bis thiosemicarbazones(5a~5k)were synthesized by condensation of thiophene-2-formaldehyde with a series of thiosemicarbazones,which were obtained by the reaction of thiocarbohydrazide with substituted aromatic aldehydes using glacial acetic acid as the catalyst.The structures were characterized by1H NMR,IR,ESI-MS and elemental analysis.Preliminary antibacterial activities test indicated that some target compounds exhibit certain inhibitory activities against Bacillus subtilis.5d exhibit better inhibitory activities than Amoxicillin against Staphylococcus aureus.
thiophene-2-formaldehyde;thiosemicarbazone;synthesis;antibacterial activity
O625.7
A
1005-1511(2014)03-0293-05
2014-03-19
中央高校基本科研业务费科学基金资助项目(11NZYQN05);四川省应用基础研究项目(2011JY0035)
仇丽颖(1980-),女,汉族,辽宁沈阳人,博士研究生,主要从事药物合成的研究。
赵志刚,教授,硕士生导师,Tel.028-85522322,E-mail:zzg63129@163.com

