大鼠孤束核内代谢型谷氨酸受体亚型7和8对心脏伤害性感受的调控作用
刘晓华,韩 曼,杜剑青
(1.陕西中医学院生理学教研室,陕西咸阳 712046; 2.西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
大鼠孤束核内代谢型谷氨酸受体亚型7和8对心脏伤害性感受的调控作用
刘晓华1,韩 曼1,杜剑青2
(1.陕西中医学院生理学教研室,陕西咸阳 712046; 2.西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
目的:探讨孤束核(NTS)内第3组代谢型谷氨酸受体(mGlu Rs)及其亚型7和8对心脏-躯体运动反射(CMR)的影响,阐明NTS内第3组m Glu Rs及其亚型在心脏伤害性信息调控中的作用。方法:40只SD大鼠随机分为4组,L-(+)-2-amino-4-phosphonobutyric acid(L-AP4)组,NTS内分别微量注射第3组mGlu Rs激动剂L-AP4 0.1、1.0、10.0和20.0 nmol;N,N’-diphenylmethyl-1,2-ethanediamine(AMN082)组,分别注射mGlu Rs7激动剂AMN082 1、2和4 nmol;(S)-3,4-dicarboxyphenylglycine(DCPG)组,分别注射m Glu Rs8激动剂DCPG 4、6和8 nmol;(RS)-α-methylserine-O-phosphate(MSOP)组,分别注射第3组m GluRs拮抗剂MSOP 20和100 nmol,并于不同时间分别注射MSOP(20 nmol)+L-AP4(10 nmol)、MSOP(20 nmol)+AMN082(2 nmol)和MSOP(20 nmol)+DCPG(6 nmol)。观察各组大鼠CMR的改变。结果:与对照比较,LAP4组和AMN082组CMR减少(P<0.05);DCPG组CMR增加(P<0.05);MSOP组注射20 nmol MSOP后CMR无改变(P>0.05),注射100 nmol MSOP后CMR增加(P<0.05);注射20 nmol MSOP后再注射L-AP4 或AMN082,CMR无改变(P>0.05)。结论:大鼠NTS内第3组mGlu Rs对心脏伤害性信息有紧张性抑制作用,mGluR7有抑制作用,而mGluR8有易化作用。
孤束核;心脏-躯体运动反射;代谢型谷氨酸受体
本课题组以往的研究[1]证明:孤束核(nucleus tractus solitaries,NTS)联合部对辣椒素诱发的心脏伤害性感受有易化调控作用,代谢型谷氨酸受体(metabotropic glutamate receptors,m Glu Rs)介导NTS的下行易化作用。不同的mGluRs亚型在伤害性感受中的作用不尽相同。迄今为止,NTS内m Glu Rs亚型在心脏伤害性感受中的作用尚不清楚。m Glu Rs属于G蛋白偶联受体,8种m Glu Rs共分为3组,mGluR7和8属于第3组mGluRs,通过抑制腺苷酸环化酶的活性使环磷酸腺苷减少;或增强G蛋白偶联受体对腺苷酸环化酶的激活,增加环磷酸腺苷的生成以改变钙通道和钾通道电流引起慢超极化[2]。研究[3-6]表明:8种m Glu Rs在NTS内突触前和突触后均有表达,其中第3组m Glu Rs主要表达在内脏传入神经元。第3组m Glu Rs主要作用于位于突触前的自身受体,通过减少谷氨酸的释放抑制突触传递。最近有研究[7-8]报道:m Glu R7和m Glu R8在大鼠脑部的不同核团对氨基酸递质[(谷氨酸和γ-氨基丁酸(GABA)]有不同的作用。谷氨酸是NTS内重要的兴奋性递质, 而GABA是重要的抑制性递质[9-10]。因此m Glu R7 和m Glu R8可能因其各自对谷氨酸和GABA释放的作用不同而对心脏伤害性感受产生不同调节作用。第3组m Glu Rs的总效应取决于其兴奋性和抑制性受体亚型作用的平衡。本实验在观测第3组mGluRs对心脏伤害性感受总的调控作用后,进一步观察m Glu R7和m Glu R8对心包腔内注射辣椒素诱发的心脏-躯体运动反射(cardiac-somatic motor reflex,CMR)的影响。
1 材料与方法
1.1 主要试剂和仪器辣椒素(美国Sigma公司)溶于吐温80和无水乙醇(按1∶1比例混合)溶液中,配制成1 g·L-1的贮存液,实验时用生理盐水稀释至所需浓度1 mg·L-1;第3组m Glu Rs激动剂L-(+)-2-amino-4-phosphonobutyric acid(LAP4)、m Glu Rs拮抗剂(RS)-α-methylserine-O-phosphate(MSOP)、m Glu R7激动剂(N,N’-diphenylmethyl-1,2-ethanediamine(AMN082)和m Glu R8激动剂(S)-3,4-dicarboxyphenylglycine (DCPG)均购自英国Tocris Cookson公司,用人工脑脊液(artificial cerebrospinal fluid,ACSF)溶解。BL-420生物信号采集与分析系统(成都泰盟生物科技有限公司),压力换能器(成都泰盟生物科技有限公司),蠕动泵(BT100-2J)(保定兰格恒流泵有限责任公司),小动物呼吸机(DW3000-B型)(淮北正华生物仪器设备有限公司),大鼠脑立体定位仪(日本Narishige公司),生物显微镜(BX51)(日本Olympus公司)。
1.2 动物分组及处理方法选用40只健康雄性SD大鼠,体质量260~330 g,由西安交通大学实验动物中心提供。随机分为以下各组:L-AP4组, NTS内分别微量注射L-AP4 0.1、1.0、10.0和20.0 nmol;AMN082组,NTS内分别微量注射AMN082 1、2和4 nmol;DCPG组,NTS内分别微量注射DCPG 4、6和8 nmol;MSOP组,NTS内分别微量注射MSOP 20或100 nmol,并于不同时间点分别注射20 nmol MSOP+10 nmol L-AP4、20 nmol MSOP+2 nmol AMN082、20 nmol MSOP+6 nmol DCPG。各激动剂给药间隔时间为1 h,拮抗剂在给激动剂前5 min给药。每种药物核团注射剂量均为0.1μL。
1.3 手术方法实验动物称质量后以初始剂量的戊巴比妥钠(45~55 mg·kg-1)腹腔注射麻醉。取俯卧位,暴露左侧背斜方肌,记录背斜方肌肌电(myoelectricity,EMG)。再取仰卧位,行气管插管术,右侧颈动脉插管监测动脉血压,左侧颈静脉插管以便在整个实验过程中以戊巴比妥钠维持麻醉(10~15 mg·kg-1·h-1)。以动脉血压和瞳孔直径监测实验动物麻醉深度。①心包插管术:左侧上胸部第1~3肋软骨处行开胸术,暴露胸腺。中线处分离胸腺,暴露心包膜。玻璃分针尖端(直径0.5 mm)在心包膜上扎开一个小孔,将一支长12~14 cm远端有数个小洞的硅胶管(内径0.020 mm、外径0.037 mm)经此孔插入心包约2 cm,缝合胸腺和各层胸壁组织以固定心包插管。②NTS内微量注射:将大鼠固定于脑立体定位仪上,剪开枕骨处头皮,钝性分离附着于枕骨处的肌肉,暴露枕骨。微型电钻钻透枕骨后,用咬骨钳剥离部分颅骨,在闩部水平去除硬脑膜和软脑膜。实验中药物注射位点以写翮(第4脑室尾侧最后点)为零坐标(相当于前囟后14.3 mm水平),左侧旁开0.5~0.8 mm,吻侧0~0.5 mm,脑表面下0.5~0.8 mm。微量注射使用尖端与玻璃微电极相连的0.5μL微量注射器(Hamilton,Reno,Nevada, USA),微电极尖端直径约50~100μm。微量注射速度为0.1μL·30 s-1。根据以往研究以及预实验选择药物的剂量。
1.4 EMG反应的记录同芯电极以30°的角度插入大鼠左侧背斜方肌,记录其EMG信号,根据肌肉大小调节电极插入深度,一般约为1.5~1.7 mm。以EMG作为反映CMR的观察指标。
1.5 实验方案手术完毕2~3 h,待动物状态稳定后记录EMG基线活动60 s,NTS内微量注射ACSF 0.1μL,15 min后心包腔内注射辣椒素(0.655 nmol·0.2 m L-1),1 min后回抽并冲洗心包4~6次,同时记录EMG 60~65 s。50 min后NTS内注射m Glu Rs不同的拮抗剂,15 min后心包腔内注射辣椒素,1 min后回抽并冲洗心包,同时记录EMG 60~65 s,观察药物对EMG活动的影响。间隔1 h后心包腔内注射辣椒素0.2 m L,观察EMG恢复情况。观察拮抗剂对激动剂作用的影响时,拮抗剂在给激动剂注射前5 min注射,其余同上所述。
EMG以反应中的放电单位总数计算,以每只大鼠自身NTS内注射ACSF后的EMG反应为对照,将其定义为100%,计算注射药物后的EMG变化的百分比并进行统计。每次实验中EMG变化率小于20%则视为药物对EMG无影响。
实验结束后,NTS微量注射位点原位微注射2%膀胺天蓝100 n L,以标记药物注射位点以及扩散范围。10 min后静脉内注入过量戊巴比妥钠(100 mg·kg-1)深麻大鼠,经左心室插管至升主动脉,先用50 m L生理盐水快速灌注冲洗血液,再用10%甲醛溶液约200 m L灌流固定。灌流结束后取脑组织,放置于10%的甲醛固定液中室温固定4 h,再转移到20%的蔗糖溶液中4℃沉糖48 h。待组织沉糖完全后进行冰冻切片,片厚30μm,行尼氏染色,显微镜下根据Paxinos and Watson大鼠脑图谱进一步确定注射位点。见图1(插页一)。
1.6 统计学分析采用SPSS 10.0统计软件对数据进行统计学分析。EMG变化百分率以x ±s表示,给药前后比较采用单因素重复测量方差分析。药物的量效关系采用线性回归分析并计算半数有效剂量(50%effective dose,ED50)。
2 结果
2.1 NTS内微量注射L-AP4和MSOP后CMR的变化NTS联合部微量注射第3组mGluRs激动剂L-AP4 0.1 nmol后,EMG与对照比较无差异(P>0.05),注射1.0、10.0和20.0 nmol后,随着L-AP4剂量的增加EMG反应均明显下降(P<0.05),且呈剂量依赖关系(r=0.918,P=0.032,ED50=10.2 nmol)。见表1。
NTS内单独微量注射20 nmol MSOP,心包腔内辣椒素诱发的EMG反应分别为对照的(99.6 ±3.0)%,CMR无明显改变(P>0.05);注射100 nmol MSOP后,EMG反应为对照的(157.2± 9.5)%,CMR明显增加(P<0.05)。
NTS内微量注射第3组m Glu Rs拮抗剂MSOP 20 nmol后,再注射L-AP4 10 nmol,EMG反应从(40.6±7.8)%上升到(105.0±10.0)%,即MSOP拮抗了L-AP4对CMR的抑制作用(P<0.05)。见图2A。
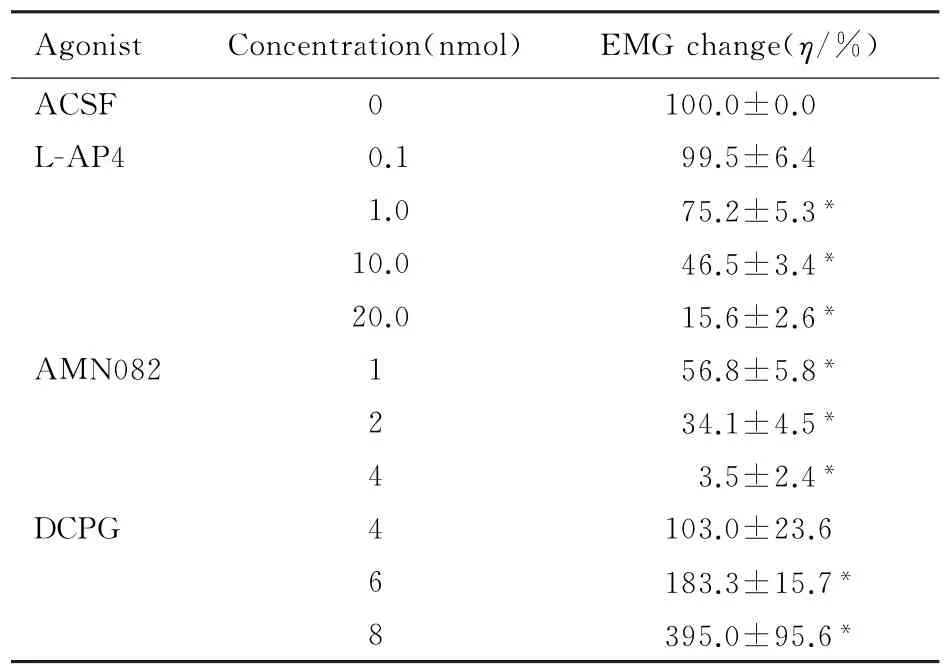
表1 NTS内注射激动剂后EMG活动变化的百分比Tab.1 Percentages of EMG changes after intra-NTS injection of agonists
2.2 NTS内微量注射AMN082后CMR的变化NTS内微量注射m Glu R7激动剂AMN082 1、2和4 nmol后,与对照比较,CMR均下降(P<0.05),且呈剂量依赖性的抑制(r=0.966,P=0.034,ED50=1.69 nmol)。见表1。NTS内先注射MSOP 20 nmol后再注射AMN082 2 nmol, EMG活动从(37.1±7.5)%上升到(99.0± 3.0)%(P<0.05),MSOP拮抗了AMN082的抑制作用。见图2B。
2.3 NTS内微量注射DCPG后CMR的变化NTS内注射4 nmol mGlu R8选择性激动剂DCPG, CMR无明显的改变(P<0.05)。注射6或8 nmol DCPG后,EMG反应均增加(P<0.05)。见表1。NTS内先微量注射20 nmol MOSP再注射6 nmol DCPG,EMG反应从(157.2±9.5)%下降到(92.0±4.6)%,DCPG的易化作用消失(P<0.05)。见图2C。
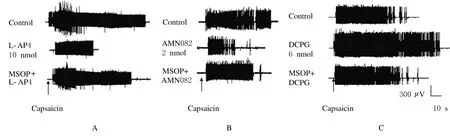
图2 NTS内微量注射第3组mGluRs激动剂和拮抗剂后EMG实例图Fig.2 Examples of EMG after intra-NTS microinjection of groupⅢm Glu Rs antagonists and agonistsA:EMG activities after NTS microinjection of ACSF,L-AP4 and MSOP+L-AP4;B:EMG activities after NTS microinjection of ACSF, AMN082 and MSOP+AMN082;C:EMG activities after NTS microinjection of ACSF,DCPG and MSOP+DCPG.
3 讨 论
本文作者以往的研究[1]表明:NTS内m Glu Rs参与介导NTS对心脏诱发的肌肉痛觉过敏的调控。同时有证据[3]表明:NTS内第3组m Glu Rs主要表达在内脏传入神经元。因此,本研究对NTS内第3组m Glu Rs及其亚型m Glu R7和m Glu R8对心脏诱发的肌肉痛觉过敏的下行调控作用的进一步研究表明:NTS内第3组mGluRs参与CMR的下行调控;NTS内mGluR7、mGluR8对CMR有相反的调控作用,m Glu R7有抑制作用,而m Glu R8有易化作用。
NTS内谷氨酸通过作用于离子型和代谢型受体介导兴奋的传递[11-12]。m Glu Rs属于G蛋白偶联受体,根据序列相似性、激动剂的作用强度次序和胞内信号转导机理,8种m Glu Rs分为3组。研究[13-14]表明:mGluRs对炎症诱发的脊髓超兴奋的产生是必需的,并且mGlu Rs的激活参与行为学反应痛觉过敏的形成。但m Glu Rs在心脏伤害性感受中的作用尚不清楚。第3组mGluRs主要表达在NTS内的内脏传入神经元。第3组mGlu Rs的4种受体亚型作用于突触前,调节谷氨酸和GABA的释放,其总的效应取决于其兴奋性和抑制性受体亚型作用的平衡。本实验中大剂量MSOP (100 nmol)单独注射到NTS内对CMR有明显的易化作用,说明NTS内的第3组m Glu Rs有紧张性活动,这种紧张性活动通过抑制谷氨酸的释放减弱NTS对CMR的下行易化作用。小剂量MSOP (20 nmol)单独注射对CMR无明显影响,但可以有效地拮抗m Glu Rs和m Glu R7的作用。上述结果提示MSOP的拮抗效应不是心脏伤害性信息易化作用的结果。
本研究中NTS内微量注射第3组mGluRs激动剂L-AP4抑制了CMR,且这种作用被第3组mGluRs拮抗剂MSOP阻断,提示第3组mGlu Rs对心脏伤害性感受的总体效应为抑制。本结果与以前的研究[15]结果一致。Naugebauer等[15]发现:第3组mGluRs激动剂L-AP4抑制机械伤害性刺激诱发的脊髓-丘脑通路的信息传递,减少辣椒素诱发的中枢敏化。
对第3组mGluRs亚型在痛觉调控方面的研究是在各受体亚型选择性激动剂出现以后开始的。研究[7]显示:mGluR7的激活抑制谷氨酸的释放。所以,本文作者推测m Glu R7对CMR的抑制作用主要是由于其抑制NTS内谷氨酸紧张性释放,进而减弱NTS的下行易化作用使脊髓水平的伤害性感受信息受到抑制。本实验中第3组mGluRs拮抗剂MSOP拮抗了L-AP4和AMN082的抑制作用,表明这种抑制效应是第3组mGluRs特异性的。
研究[7,16]表明:全身或者中脑导水管周围灰质(PAG)给予mGluR8激动剂DCPG对机械伤害性刺激、热刺激和神经病理痛有抗伤害感受作用,且这种作用可以被中脑导水管周围灰质内注射m Glu Rs拮抗剂阻断。本实验中NTS内注射mGluR8激动剂DCPG对心脏伤害性感受有易化作用,这种差异可能是由于DCPG的作用依赖于其作用部位的功能。在PAG内DCPG激活延脑头端腹内侧区下行抑制系统进而抑制伤害性信息在脊髓的传递;在NTS内,DCPG通过激活NTS下行易化通路进而加强伤害性信息在脊髓的传递。在PAG内mGluR8表达于GABA能神经元和谷氨酸能神经元的突触前,其激活抑制GABA的释放,而易化谷氨酸的释放。因此,本文作者推测NTS 内m Glu R8激动剂DCPG的易化作用可能是通过抑制了GABA能中间神经元对下行到脊髓的投射神经元的抑制作用(即去抑制)而实现的,如此激活NTS内下行易化通路使伤害性信息在脊髓的传递加强,但该假设仍需要进一步的实验来验证。
[1]刘晓华,韩 曼,杜剑青.大鼠孤束核内谷氨酸受体亚型对心脏伤害性感受信息的调控作用[J].吉林大学学报:医学版,2014,40(3):508-512.
[2]Cartmell J,Schoepp DD.Regulation of neurotransmitter release by metabotropic glutamate receptors[J].J Neurochem,2000,75(3):889-907.
[3]Hoang CJ,Hay M.Expression of metabotropic glutamate receptors in nodose ganglia and the nucleus of the solitary tract[J].Am J Physiol Heart Circ Physiol,2001, 281(1):H457-H462.
[4]Pamidimukkala J,Hoang CJ,Hay M.Expression of metabotropic glutamate receptor 8 in autonomic cell groups of the medulla oblongata of the rat[J].Brain Res,2002, 957(1):162-173.
[5]Young RL,Cooper NJ,Blackshaw AL.Anatomy and function of group III metabotropic glutamate receptors in gastric vagal pathways[J].Neuropharmacology,2008, 54(6):965-975.
[6]Scanziani M,Salin PA,Vogt KE,et al.Use-dependent increases in glutamate concentration activate presynaptic metabotropic glutamate receptors[J].Nature,1997, 385(6617):630-634.
[7]Marabese I,Rossi F,Palazzo E,et al.Periaqueductal gray metabotropic glutamate receptor subtype 7 and 8 mediate opposite effects on amino acid release,rostral ventromedial medulla cell activities,and thermal nociception[J].J Neurophysiol,2007,98(1):43-53.
[8]Li X,Xi ZX,Markou A.Metabotropic glutamate 7(mGlu7) receptor:a target for medication development for the treatment of cocaine dependence[J].Neuropharmacology, 2013,66(3):12-23.
[9]Travagli RA.Of apples and oranges:GABA and glutamate transmission in neurones of the nucleus tractus solitarii could not be more different[J].J Physiol,2012,590(Pt22): 55-59.
[10]Bailey TW,Appleyard SM,Jin YH,et al.Organization and properties of GABAergic neurons in solitary tract nucleus (NTS)[J].J Neurophysiol,2008,99(4):1712-1722.
[11]Foley CM,Moffitt JA,Hay M,et al.Glutamate in the nucleus of the solitary tract activates both ionotropic and metabotropic glutamate receptors[J].Am J Physiol Regul Integr Comp Physiol,1998,275(6Pt2):R1858-R1866.
[12]Glaum SR,Miller RJ.Metabotropic glutamate receptors mediate excitatory transmission in the nucleus of the solitary tract[J].J Neurosci,1992,12(6):2251-2258.
[13]Ambriz-Tututi M,Palomero-Rivero M,Ramirez-López F, et al.Role of glutamate receptors in the dorsal reticular nucleus in formalin-induced secondary allodynia[J].Eur J Neurosci,2013,21(7):3008-3017.
[14]Karim F,Wang CC,Gereau RW.Metabotropic glutamate receptor subtypes 1 and 5 are activators of extracellular signalregulated kinase signaling required for inflammatory pain in mice[J].J Neurosci,2001,21(11):3771-3779.
[15]Neugebauer V,Chen PS,Willis WD.GroupsⅡandⅢmetabotropic glutamate receptors differentially modulate brief and prolonged nociception in primate STT cells[J].J Neurophysiol,2000,84(6):2998-3009.
[16]Marabese I,de Novellis V,Palazzo E,et al.Effects of (S)-3,4-DCPG,an m Glu8 receptor agonist,on inflammatory and neuropathic pain in mice[J].Neuropharmacology,2007,52(2):253-262.
Regulation of metabotropic glutamate subtype 7 and 8 receptors in nucleus tractus solitarius in cardiac nociception in rats
LIU Xiao-hua1,HAN Man1,DU Jian-qing2
(1.Department of Physiology,Shaanxi University of Chinese Medicine,Xianyang 712046,China; 2.Department of Physiology and Pathophysiology,School of Medical Sciences,Xi’an Jiaotong University Xi’an 710061,China)
Objective To explore the role of metabotropic glutamate receptors(mGluRs)groupⅢand its subtypes mGlu R7 and mGlu R8 in nucleus tractus solitarius(NTS)in cardiac-somatic motor reflex(CMR),and to clarify the modulation role of mGluRⅢand its subtypes in NTSin cardiac nociceptoion.Methods40 SD rats were randomly divided into L-AP4 group,microinjection of m GluRsⅢagonist L-AP4 0.1,1.0,10.0 or 20.0 nmol in NTS; AMN082 group,microinjection of m GluR7 agonist AMN082 1,2 or 4 nmol;DCPG group,microinjection of mGluR8 agonist DCPG 4,6 or 8 nmol;MSOP group,microinjection of mGluRⅢantagonist MSOP 20 or 100 nmol,20 nmol MSOP+410 nmol L-AP,20 nmol MSOP+2 nmol AMN082,20 nmol MSOP+6 nmol DCPG.The changes of CMR of the rats in various groups were observed.ResultsCompared with control,theCMR in L-AP4 and AMN082 groups was decreased(P<0.05);the CMR in DCPG group was increased(P<0.05);the CMR in MSOP group after injection of 20 nmol MSOP had no change(P>0.05);the CMR in MSOP group after injection of 100 nmol MSOP was increased(P<0.05);the CMR in MSOP group after injection of 20 nmol MSOP followed L-AP4 or AMNO82 had no change(P>0.05).ConclusionThe groupⅢmGluRs in the NTS play an inhibitory role in cardiac nociception,and m Glu R7 has anti-nociceptive effects while m Glu R8 has pronociceptive effects.
nucleus tractus solitarius;cardiosomatic motor reflex;metabotropic glutamate receptors
R338
A
2014-01-28
国家自然科学基金资助课题(31171068)
刘晓华(1980-),女,陕西省旬邑县人,讲师,理学博士,主要从事心血管生理基础方面的研究。
杜剑青(Tel:029-82657490-802,E-mail:dujianq@mail.xjtu.edu.cn)
1671-587Ⅹ(2014)05-0920-05
10.13481/j.1671-587x.20140502

