NO和H2O2在沙打旺抗黄矮根腐病反应中的互作
黄贝梅,南志标
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
NO和H2O2在沙打旺抗黄矮根腐病反应中的互作
黄贝梅,南志标
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
本研究以沙打旺(Astrgalusadsurgens)感病品种宁夏彭阳为试验材料,接种沙打旺埃里砖格孢(Embellisiaastragali)后分别施加外源NO及H2O2清除剂抗坏血酸,测定H2O2含量和H2O2代谢酶SOD、POD和CAT活性,以此来探讨H2O2在由NO诱导的防御反应中发挥的作用。与对照相比,外源NO显著降低(P<0.05)沙打旺发病率和病情指数,在开始阶段,外源NO可以诱导内源H2O2产生,在后期,当H2O2浓度相对较高,外源NO会延迟H2O2积累,但用NO和H2O2清除剂同时处理H2O2含量与对照并无显著差异(P>0.05)。NO处理能够诱导SOD、POD和CAT活性增加,H2O2清除剂抑制了NO对3种酶的调控作用。施加外源NO能增强沙打旺抗病性,NO通过调控内源H2O2含量发挥作用。
NO;H2O2;沙打旺;埃里砖格孢;抗氧化酶
NO和H2O2是植物体内两种重要的信号转导分子,广泛参与植物生长发育以及抗病等各种抗逆信号转导过程[1]。外源NO能激活大豆(Glycinemax)和烟草(Nicotianatabacum)一系列抗病相关基因表达[2-3],提高防御酶活性[2]。NO在植物抗病反应中可作为信号物质与活性氧协同作用[4],H2O2作为活性氧,在植物抵抗病原体感染过程中有重要作用[5]。
沙打旺(Astrgalusadsurgens)是多年生豆科牧草,但其草地利用年限较短,经济利用期仅2~3年,5年后开始衰退[6]。病害是造成沙打旺衰退的主要原因之一,沙打旺黄矮根腐病是2007年[7]报道的一种沙打旺新病害,其病原真菌为沙打旺埃里砖格孢(Embellisiaastragalisp.nov.Li&Nan),该病菌可以引起植物矮化、茎秆变黄、根部腐烂,极大地降低沙打旺的产量、缩短其利用年限。不同沙打旺品种(品系)对该病的抗病性水平存在差异,其中陕西榆林和中沙一号为抗病品种,内蒙早熟和宁夏彭阳为感病品种[8]。
目前,关于NO和H2O2在植物病害防御中的互作,相关学者已经开展了一系列研究[9-10],但对其调控机理仍存在争议[11]。NO和H2O2的动态平衡是建立病害防御的必要条件[11]。Neill等[1]认为,NO和H2O2可能是胁迫信号转导的中心环节,介导了多种信号途径。过氧化氢代谢酶已被证明受NO供体的影响[12-13]。然而,关于NO和H2O2在牧草抗病反应中互作的研究很少。为深入了解沙打旺抗黄矮根腐病的作用机制,采取合理的防治方法,对该病害进行有效控制,本研究以宁夏彭阳沙打旺为试验材料,通过测定H2O2含量和H2O2代谢酶活性分析H2O2在NO引导的防御反应中的作用。
1 材料与方法
1.1 供试材料
供试的沙打旺品种为宁夏彭阳,由中国科学院水利部水土保持研究所提供,种子保存在兰州大学草地农业科技学院种子库(4 ℃)。
供试沙打旺埃里砖格孢分离自采于甘肃省环县草地畜牧业综合试验场(37°7′ N,106°49′ E,海拔1 650 m)的沙打旺发病茎秆。盆栽试验在兰州大学榆中智能温室中进行,供试土壤为营养土与黄绵土1∶1混合,经169 ℃灭菌6 h[14]后装入经0.2%高锰酸钾消毒的塑料盆内,每盆2 kg,塑料盆规格为15 cm × 15 cm(直径×高)。
其他试验条件保持一致,温度白天25 ℃,夜间20 ℃,12 h光照12 h黑暗交替、光照8 000~10 000 lx,相对湿度65%。每隔一周重新排列各试验盆的位置,以消除不同位置光照条件、通风条件可能存在的差异。
1.2 试验处理
2012年4月20日播种,随机区组摆放,出苗后选择长势一致的沙打旺幼苗,每盆定苗4株。90 d后,用喷雾法接种埃里砖格孢悬浮液(1×105个·mL-1),接种后第2天按以下设计进行处理,1)0.5 mmol·L-1NO供体硝普钠(Sodium Nitroprusside,SNP);2)0.5 mmol·L-1SNP和0.2 mmol·L-1H2O2清除剂抗坏血酸(Ascorbic Acid,AsA);3)空白(无菌水)为对照,每处理4个重复,对各处理的重复进行随机区组摆放。试验所用试剂为经测定对孢子萌发没有影响的浓度。分别于处理0、0.5、1、2、3、4、5 d取植株中间部位叶片带回实验室测定H2O2含量以及酶活性,1个月后统计发病率,计算病情指数。
1.3 试验方法
1.3.1 发病率和病情指数 沙打旺黄矮根腐病的发病率和病情指数统计方法同文献[7]。
1.3.2 H2O2含量测定 取沙打旺叶片组织0.3 g,加入丙酮研磨成浆;3 000 r·min-1离心10 min,取上清液,依次加入硫酸钛和浓氨水;5 000 r·min-1离心10 min后弃上清,洗涤5次,用硫酸溶解沉淀在450 nm波长下测定吸光度值,计算叶片组织中H2O2含量[15]。
1.3.3 酶活性测定 超氧化物歧化酶(Superoxide Dismutase,SOD)活性的测定采用氮蓝四唑(NBT)光还原法[16],过氧化物酶(Peroxidase,POD)活性的测定采用李合生[16]的愈创木酚法,过氧化氢酶(Catalase,CAT)活性的测定采用紫外吸收法[17]。
1.3.4 数据统计分析 试验数据用Excel 2003进行作图,用SPSS 17.0对结果进行单因素方差分析,采用Duncan法进行多重比较。
2 结果与分析
2.1 发病率和病情指数
SNP处理显著(P<0.05)降低了黄矮根腐病发病率和病情指数,与对照相比分别降低了30.7%和28.4%(图1)。SNP和AsA共同处理减弱了SNP的处理效果,发病率和病情指数分别较SNP处理高34.9%和32.6%,与对照差异不显著(P>0.05)。
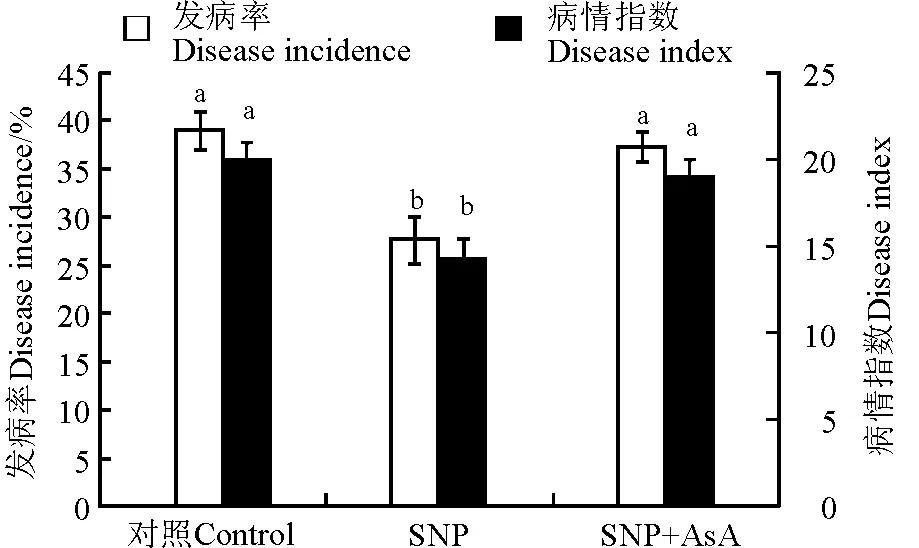
图1 硝普钠(SNP)与抗坏血酸(AsA)处理对发病率和病情指数的影响
注:不同小写字母表示处理间在0.05水平上差异显著。
Note: Different lower case letters mean significant differences among treatments at 0.05 level.
2.2 过氧化氢含量
比较SNP处理与对照H2O2含量,对照中检测到2个H2O2峰值,分别在1 d和3 d(图2)。SNP处理第1个峰值与对照相比提前,出现在处理后0.5 d,第2个峰值较第1个高,施加SNP的处理峰值延迟出现,说明H2O2含量受NO调控。SNP和AsA共处理条件下,处理后1、2 d H2O2含量较对照显著减少(P<0.05),之后变化趋势与对照相似,但始终低于对照。说明H2O2清除剂减弱了NO对H2O2含量的调控。
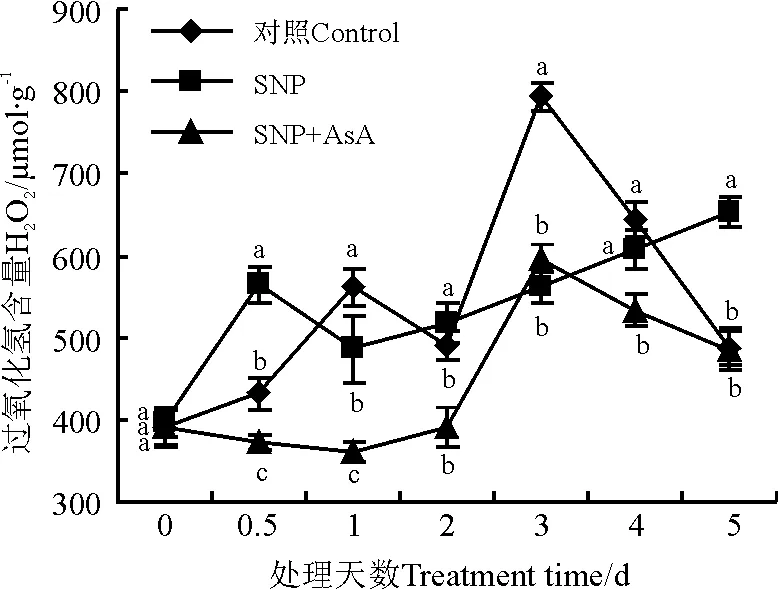
图2 硝普钠(SNP)与抗坏血酸(AsA)处理对H2O2含量的影响
注:同一时间不同小写字母表示处理间在0.05水平上差异显著。以下同。
Note: Different lower case letters mean significant differences among treatments at 0.05 level. The same below.
2.3 SOD、POD、CAT活性
SNP处理SOD活性迅速升高,随后缓慢下降,处理后0.5 d时较对照高62.7%,而对照SOD峰值出现在处理后3 d,然后下降,SNP处理SOD活性呈持续上升趋势。SNP和AsA共同处理影响了NO的作用,SOD活性始终低于SNP处理,在处理后3 d达到峰值后开始下降。说明NO诱导的SOD活性增加被H2O2清除剂抑制。
SNP处理的POD活性在处理后1 d时较对照低,随后明显增加(图4)。对照峰值出现在处理后2 d,SNP处理峰值出现在处理后3 d,比对照峰值高30.9%。SNP和AsA共处理POD峰值出现在处理后2 d,处理2 d后POD活性显著低于SNP处理(P<0.05),说明H2O2清除剂抑制了NO对POD的作用。
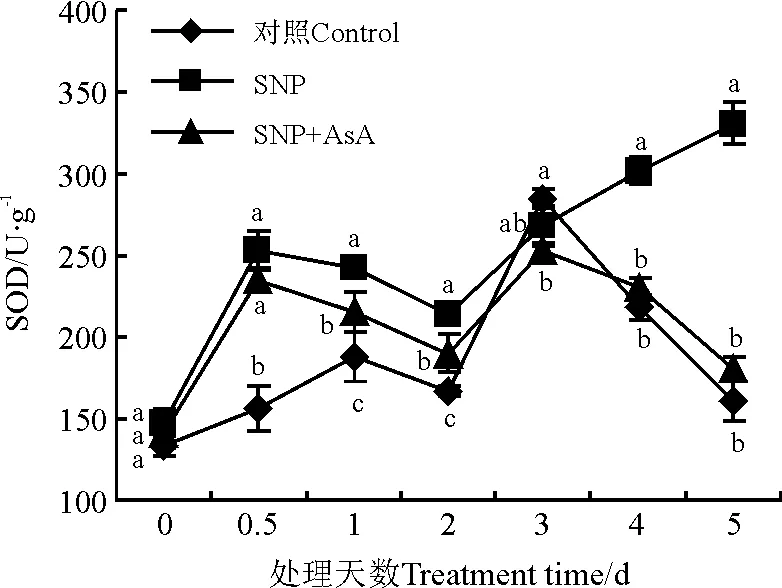
图3 硝普钠(SNP)与抗坏血酸(AsA)处理对SOD活性的影响
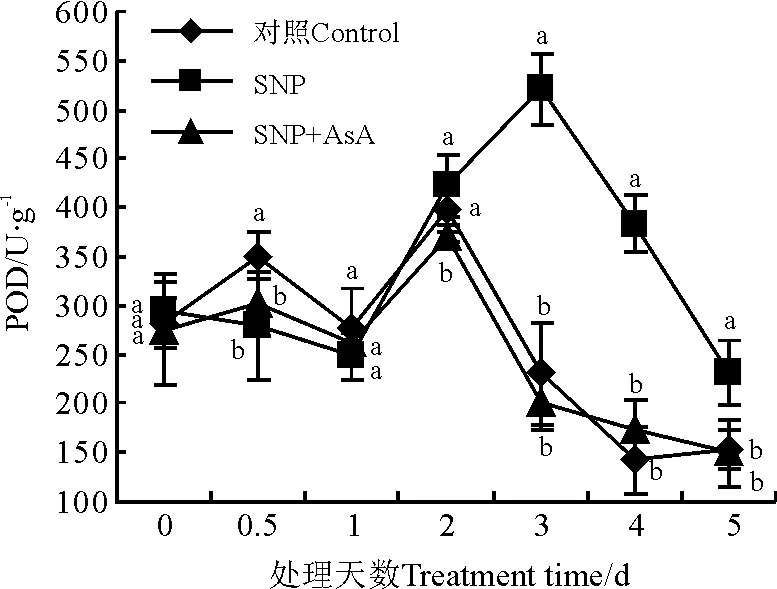
图4 硝普钠(SNP)与抗坏血酸(AsA)处理对POD活性的影响
整个检测期间,SNP处理分别在处理后0.5 d和3 d时检测到CAT活性峰值,对照峰值出现在处理后2 d,SNP处理3 d的峰值较对照峰值高17.4%。SNP和AsA共处理CAT变化趋势与对照相似,说明H2O2清除剂抑制了NO对CAT的作用(图5)。
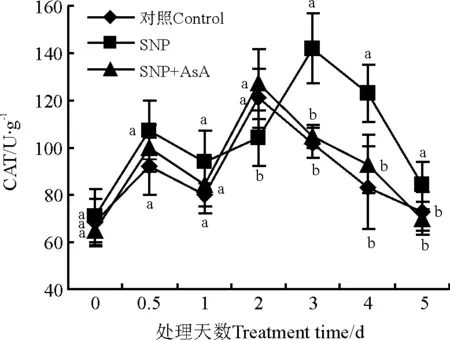
图5 硝普钠(SNP)与抗坏血酸(AsA)处理对CAT活性的影响
3 讨论与结论
尽管NO是植物响应生物胁迫的信号分子已被普遍接受,其作为信号分子的功能模式需要深入的研究,特别是与其他信号分子的交互作用[18]。H2O2被认为是多种防御反应中的信号分子,植物中NO与H2O2协同防御病害,它们之间的互作可能补充防御机制中的功能[1]。本研究以沙打旺为材料,研究了NO和H2O2在沙打旺抗病反应中的互作。
Fan等[9]发现,NO处理降低了番茄(Lycopersiconesculentum)的发病率,而NO和H2O2清除剂共同处理的番茄发病率与对照无显著差异,即H2O2清除剂削弱了NO的作用,可见,H2O2参与NO调控的番茄抗病反应。本研究中,SNP处理降低了沙打旺发病率和病情指数,SNP和AsA共处理减弱了SNP处理效果,表明NO诱导了植物对病原体入侵和生长的防御反应,缺少H2O2,NO的防御能力降低,故H2O2参与了NO诱导的沙打旺防御反应过程。
NO可能通过调节内源H2O2含量参与各种胁迫下信号转导过程,并在下游诱导相关防御基因的表达[19]。在植物内NO对H2O2含量既有促进也有抑制作用。吕东等[20]研究表明,H2O2能诱导胞内NO的产生,而NO不能诱导胞内H2O2的产生,H2O2可能作为NO的上游分子来介导由ABA诱导的NO产生过程。屠洁等[21]认为NO可通过对抗氧化酶的不同抑制作用来调节小麦(Triticumaestivum)叶片内源H2O2含量。Clark等[22]提出NO可能是通过调节内源H2O2代谢来参与信号转导过程。本研究中,当H2O2含量较低时,NO处理提前了H2O2峰值,当H2O2含量高到可能对植物细胞造成伤害时,NO处理延迟了H2O2峰值。以上结果表明,NO能够调控内源H2O2含量,且其调控能力与H2O2浓度相关。在植物中,H2O2可能扮演两个相反角色:H2O2在各种胁迫下产生来增加保护酶基因的表达;然而,高浓度的H2O2会对植物造成氧化破坏[12]。由本研究结果可以看出,H2O2低浓度时,NO诱导其产生增强防御反应,高浓度时抑制H2O2积累以避免损伤细胞。处理早期AsA有效清除了H2O2,从而维持正常的H2O2含量。由于AsA作用,NO对H2O2调控通道被打破,这可能是NO诱导抗病被AsA削弱的原因。
SOD是活性氧清除反应过程中第1个发挥作用的抗氧化酶,它催化·O2-发生歧化反应,将其快速歧化为H2O2和分子氧,从而清除·O2-。在随后的反应中,H2O2在CAT、POD和抗坏血酸谷胱甘肽循环系统的作用下转变为水和分子氧[23]。关于NO在不同条件下不同植物中影响SOD、POD和CAT活性已有报道。Uchida等[12]研究表明,NO对NaCl胁迫下水稻(Oryzasativa)幼苗的生长具有促进作用,并提高了SOD、POD和CAT的活性。廖伟彪等[13]研究表明,适宜浓度的NO和H2O2处理可提高地被菊(Dendranthemamorifolium)插穗的SOD活性,降低POD的活性。在本研究中,NO处理早期,SOD活性显著增强,促使H2O2产生。同时,作为清除H2O2的主要酶,POD活性降低了;后期,清除H2O2的酶POD和CAT与对照相比显著增加,从而导致NO处理后期H2O2含量降低。H2O2降低破坏了原来的平衡,从而影响NO的作用,故H2O2清除剂处理抑制了NO对这些酶的作用,表明SOD、POD和CAT参与NO调控H2O2含量。施加外源性NO可以提高沙打旺抗病性,而NO诱导的防御反应需要H2O2存在。外源NO最初诱导内源性H2O2产生,但H2O2在高浓度时延迟H2O2积累,表明植物病害防御反应中,NO和H2O2相互作用,可能通过调控H2O2含量发挥其效果。
本研究初步揭示了NO和H2O2在病害防御过程中可能通过互作反应提高各自的信号水平。然而,关于该过程中NO和H2O2信号转导网络仍需进一步研究。
[1] Neill S J,Desikan R,Clarke A,Hurst R D,Hancock J T.Hydrogen peroxide and nitric oxide as signalling molecules in plants[J].Journal of Experimental Botany,2002,53:1237-1247.
[2] Durner J,Wendehenne D,Klessig D F.Defense gene induction in tobacco by nitric oxide,cyclic GMP,and cyclic ADP-ribose[J].Proceedings of the National Academy of Sciences,1998,95:10328-10333.
[3] Delledonne M,Xia Y,Dixon R A,Lamb C.Nitric oxide functions as a signal in plant disease resistance [J].Nature,1998,394:585-588.
[4] 刘新,张蜀秋,娄成后.气孔运动调控中过氧化氢和一氧化氮信号途径的交叉作用[J].自然科学进展,2003,13:355-358.
[5] Romero-Puertas M C,Perazzolli M,Zago E D,Delledonne M.Nitric oxide signalling functions in plant-pathogen interactions[J].Cellular Microbiology,2004,6:795-803.
[6] 孙启忠.赤峰地区不同生长年限沙打旺生产力的研究[J].中国草地,1999(5):29-34.
[7] 李彦忠.沙打旺(Astragalusadsurgens)黄矮根腐病(Embellisiaastragali)的研究[D].兰州:兰州大学,2007.
[8] 俞斌华.沙打旺(Astragalusadsurgens)品种对黄矮根腐病(Embellisiaastragali)的抗性评价[D].兰州:兰州大学,2011.
[9] Fan B,Shen L,Liu K,Zhao D,Yu M M,Sheng J P.Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response toRhizopusnigricans[J].Journal of the Science of Food and Agriculture,2008,88:1238-1244.
[10] 林志强,郭秀萍,车永梅,卢江,刘新.NO和H2O2提高葡萄抗霜霉病的生理作用机制[J].植物病理学报,2011,41(6):576-586.
[12] Uchida A,Jagendorf A T,Hibino T,Takabe T,Takabe T.Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].Plant Science,2002,163:515-523.
[13] 廖伟彪,张美玲,吴永华,肖洪浪.一氧化氮和过氧化氢对地被菊扦插生根的影响[J].园艺学报,2009,36:1643-1650.
[14] 方中达.植病研究方法[M].北京:中国农业出版社,1979:197-230.
[15] Karkonen A,Warinowski T,Teeri T H,Siloma L K,Fry S C.On the mechanism of apoplastic H2O2production during lignin formation and elicitation in cultured spruce cells-peroxidases after elicitation[J].Planta,2009,230(3):553-567.
[16] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-169.
[17] Larrigaudiere C,Vilaplana R,Soria Y,Kan J.Oxidative behavior of Blanquilla pears treated with 1-methylcyclopropene during cold storage[J].Journal of the Science of Food and Agriculture,2004,84:1871-1877.
[18] Arasimowicz M,Floryszak-Wieczorek J.Nitric oxide as a bioactive signalling molecule in plant stress responses[J].Plant Science,2007,172:876-887.
[19] Kolbert Z,Bartha B,Erdei L.Exogenous auxin-induced NO synthesis is nitrate reductase-associated inArabidopsisthalianaroot primordia[J].Journal of Plant Physiology,2008,165:967-975.
[20] 吕东,张骁,江静,安国勇,张玲瑞,宋纯鹏.NO可能作为H2O2的下游信号介导ABA诱导的蚕豆气孔关闭[J].植物生理与分子生物学学报,2005,31(1):62-70.
[21] 屠洁,沈文飚,叶茂炳,徐朗莱.外源NO供体对小麦离体叶片过氧化氢代谢的影响[J].植物学通报,2002,19(3):336-341.
[22] Clark D,Durner J,Navarre D A,Klessig D F.Nitric oxide inhibition of tobacco catalase and ascorbate peroxidase[J].Molecular Plant-Microbe Interactions,2000,13:1380-1384.
[23] 高必达,陈捷.生理植物病理学[M].北京:科学出版社,2006:115-138.
(责任编辑 武艳培)
The impacts of interaction between NO and H2O2onAstrgalusadsurgensresponse toEmbellisiaastragali
HUANG Bei-mei, NAN Zhi-biao
(State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China)
A disease susceptible cultivar ofAstrgalusadsurgenswas applied with exogenous NO and AsA after inoculatingEmbellisiaastragali. Disease incidence (DI), disease severity index (DSI), H2O2concentration, superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) activity were analyzed to investigate the interaction between NO and H2O2during disease development. Compared with control plants, DI and DSI of NO treatment plants significantly decreased (P<0.05). AsA treatment weakened the effects of NO. NO could induce more H2O2during the earlier period. However, NO delayed H2O2accumulation during the later period that concentration of H2O2was relatively higher. The increasement of SOD, POD and CAT activity induced by NO was inhibited by AsA. The results showed that exogenous NO implication could improve the disease resistance ofA.adsurgens. NO may interact with H2O2and exert its effect by modulating the endogenous H2O2level.
NO;H2O2;Astrgalusadsurgens;Embellisiaastragali; antioxidant enzyme
NAN Zhi-biao E-mail:zhibiao@lzu.edu.cn
10.11829j.issn.1001-0629.2013-0320
2013-06-21 接受日期:2013-08-27
牧草产业技术体系(CARS35-08)
黄贝梅(1988-),女,河南虞城人,硕士,研究方向为沙打旺病害防治。E-mail:huangbm07@lzu.edu.cn
南志标(1951-),男,河北曲阳人,教授,博士,研究方向为草业科学。E-mail:zhibiao@lzu.edu.cn
S435.4
A
1001-0629(2014)06-1028-05*1

