Ag修饰TiO2催化剂紫外光催化还原CO2的研究
, ,
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
将CO2进行有效的还原是解决当前全球温室效应和能源短缺的途径之一,其还原产物包括CO,HCOOH,HCHO,CH3COOH,CH3OH,CH4等[1-2],但是CO2的能级低且化学性质稳定,直接采用化学方法将其转化为低价态碳化合物需要消耗大约220~330 kJ/mol能量[3].太阳能是一种清洁的可再生的能源,采用光催化法还原CO2成为潜在的有效技术.在所有可行的光催化剂中,TiO2因具有高化学稳定性、低成本和无毒等优点被广泛采用[4-5].然而,TiO2也存在禁带宽度大(3.2 eV),光利用率低,光生电子和空穴的复合率高等缺点[6].为有效提高TiO2光催化还原CO2的效率,对TiO2进行了Fe,Pt,Ru,Rh,Au,Cu,Ni等金属修饰[7-13],但现有成果侧重于CO2光催化还原对单一产物的催化活性,尚缺少对CO2光还原产物的系统研究.笔者采用水解法制备了Ag修饰TiO2(Ag-TiO2)催化剂,利用X射线衍射(XRD)、X射线光电子光谱(XPS)、透射电子显微镜(TEM)、比表面积测试(BET)和紫外-可见漫反射光谱(UV-vis)等手段对样品微观结构进行了表征,同时将其用于光催化还原CO2反应.
1 实验部分
1.1 试 剂
CO2(纯度99.999%)由杭州今工特种气体有限公司提供.用于制备催化剂的钛酸四丁酯(Ti(OC4H9)4)、AgNO3和乙酸(CH3COOH)均为分析纯,购自华东医药有限公司.其他试剂包括NaOH、乙酸铵(CH3COONH4)和乙酰丙酮(CH3COCH2COCH3)均购自上海晶纯实业有限公司.
1.2 催化剂的制备及表征
室温下称取一定量的AgNO3溶于100 mL的去离子水中,并用CH3COOH将AgNO3溶液pH调至2.5左右,其后转移到三口烧瓶中,并在剧烈搅拌下以大约3 s/滴的速度滴入21 mL的Ti(OC4H9)4,并继续搅拌3 h.将反应好的溶液置于80 °C恒温水浴锅中烘干,所得前驱物在马弗炉中以5 °C/min的速率升温至450 °C煅烧并保温2 h,冷却至室温后即为所得的Ag-TiO2催化剂.
XRD表征在Thermo ARL SCINTAG X’TRA型X射线衍射仪上进行,采用Cu Kα射线;XPS测试采用PHI公司生产的PHI-5000C ESCA型X射线光电子能谱仪,Mg Kα靶(1 253.6 eV),电子结合能以C 1s(284.6 eV)为基准进行校正;TEM测试采用Tecnai G2 F30 S-Twin型透射电子显微镜;催化剂BET比表面积(SBET)用Micromeritics ASAP 2010型物理吸附仪测定;样品的UV-vis利用Spectro UV-2550型紫外可见分光光度仪进行分析,以BaSO4为参照.
1.3 光催化反应及产物分析
CO2光催化还原反应在自制的石英瓶(内径4.5 cm,高22 cm)反应器中进行,以波长为254 nm的18 W的低压汞灯为光源.将0.3 g的Ag-TiO2催化剂分散悬浮于300 mL 0.2 M NaOH水溶液中,并在强磁力搅拌下向其中以一定流量鼓入CO2至少30 min,确保NaOH水溶液充分吸收CO2达到饱和的同时排净反应液中的空气.密闭后开启光源,在稳定的光照条件下反应24 h,反应温度约为35 ℃.在预设的时间点从反应器内定量抽取水样及气样进行分析,其中水样须预先通过0.45 μm微孔滤膜除去催化剂颗粒.
1.4 产物分析
气相产物中的H2和CO利用美国安捷伦公司Agilent 6890N气相色谱仪分析检测,配置HP-PLOT MOLESIEVE毛细管柱(30 m × 320 μm × 12 μm),TCD检测器;CH4利用日本岛津公司GC-2140气相色谱仪分析检测,配置RTX-1701毛细管柱(30 m × 250 μm × 25 μm),FID检测器.
液相中的CO2的光还原产物一般为HCHO、HCOOH和CH3OH.在本实验中,HCHO利用乙酰丙酮分光光度法检测;HCOOH利用美国戴安公司ICS2000离子色谱仪测定,其检测限为0.2 μmol/L;CH3OH利用美国安捷伦公司Agilent 6890N气相色谱仪分析检测,配置HP-INNOWAX毛细管柱(30 m × 320 μm × 25 μm),FID检测器.该反应及检测条件下未检测出HCOOH.
2 实验结果与讨论
2.1 催化剂的表征
2.1.1 XRD
图1显示了不同Ag修饰量的Ag-TiO2催化剂的XRD谱图.从图中可以看出,所有样品的TiO2晶型都是单一的锐钛矿相,对应的2θ衍射角分别为25.2o,37.9o,48.3o,53.9o,55.0o和62.7o.另外,在2θ为32.3o和46.2o处均出现了Ag2O的特征峰[14],且其强度随着Ag修饰量的增大而增强.

图1 不同修饰量的Ag-TiO2催化剂的XRD谱图
利用锐钛矿相在2θ= 25.2°处衍射峰的XRD数据,根据Scherrer公式估算TiO2颗粒的粒径,其公式为
d=Kλ/(βcosθ)
式中:d为TiO2颗粒的粒径;K为常数,一般取0.89;λ取0.154 05,nm;β为半高宽,nm.分析结果见表1.由表1可知:随Ag修饰量的增加,TiO2的晶粒尺寸逐渐减小.
2.1.2 XPS
修饰量为1.0%的Ag-TiO2催化剂反应前后的XPS全谱图和窄谱图如图2所示.从图2中可以看到:图2(a)中催化剂表面有Ag,Ti,O和C四种元素的存在;图2(b)中出现的结合能为529.8 eV的特征峰归属为O 1s[15];图2(c)中,在458.5 eV和464.4 eV位置出现的两个峰分别对应于Ti 2p3/2和Ti 2p1/2的结合能,表明样品中的Ti以+4价存在[16].

图2 1.0% Ag-TiO2催化剂的XPS谱图
如图2(d)所示,反应前Ag 3d的结合能分别为366.3 eV(3d5/2)和372.4 eV(3d3/2).由于Ag+和Ag0的结合能非常接近,仅根据Ag 3d5/2图谱很难确定Ag的化合态.一般而言,当Ag 3d5/2的结合能为366~368 eV时归属为Ag+,而结合能大于或等于368 eV时则对应为Ag0[17-20],因此,我们初步判定Ag是以+1价态存在于TiO2颗粒表面.而且根据Ag-TiO2的合成方法也能推导出的Ag的物态.鉴于Ti(OBu)4在水解过程中没有添加任何还原剂,Ag的前驱体在煅烧前仍以AgNO3的形式存在.此外,AgNO3的热分解温度为444 ℃.所以推断煅烧后元素Ag主要以Ag+的形式存在于催化剂中[21].
需指出的是反应24 h后,Ag 3d峰向高结合能方向发生了微小的移动,结合能变为367.2 eV(3d5/2)和373.6 eV(3d3/2),其原因可能是在反应过程中元素之间复杂的电子迁移作用.一方面由于TiO2和Ag的相互作用[19],电子可以从TiO2向Ag迁移,造成Ag 3d的负移;另一方面,由于O具有较强的电负性[22],电子可以从Ag向O迁移,致使Ag 3d结合能增大.
2.1.3 TEM形貌分析
修饰量为1.0%的Ag-TiO2催化剂的透射电镜图如图3所示.从图3中可以看出:TiO2颗粒分布均匀,形状规则,其粒径大小约为10 nm,此结果与Scherrer公式计算的结果一致.然而,不能观察到明显的Ag纳米粒子,这可能是由于Ag以Ag+存在于催化剂中.
2.1.4 BET比表面积测试
不同Ag修饰量的Ag-TiO2颗粒的比表面积见表1.从表1中可看出:其SBET随Ag载量的增高先增大后减小,当Ag修饰量为1.0%时,SBET达到最大值64.92 m2/g.这是因为Ag修饰一方面可以减少颗粒的粒径(如XRD结果),但另一方面修饰的Ag会存在于孔道的表面,反而减少了TiO2的比表面积.一般而言,催化剂的表面积越大,它活性位越多,反应活性越高,所以1.0%的Ag-TiO2较之其他修饰量的催化剂具有更高的光还原CO2反应活性.

表1 Ag-TiO2样品的物理化学性质
2.1.5 UV-vis光谱分析
图4为不同金属修饰量的Ag-TiO2催化剂在200~900 nm波长范围内的UV-vis吸收光谱.由图4可见:Ag-TiO2粉末在200~305 nm范围内具有强的吸收,而在可见光区425~900 nm范围内出现了明显的尾峰,且其强度随着Ag修饰量的增大而增强,表明Ag的修饰可显著扩展催化剂的光吸收域[23].
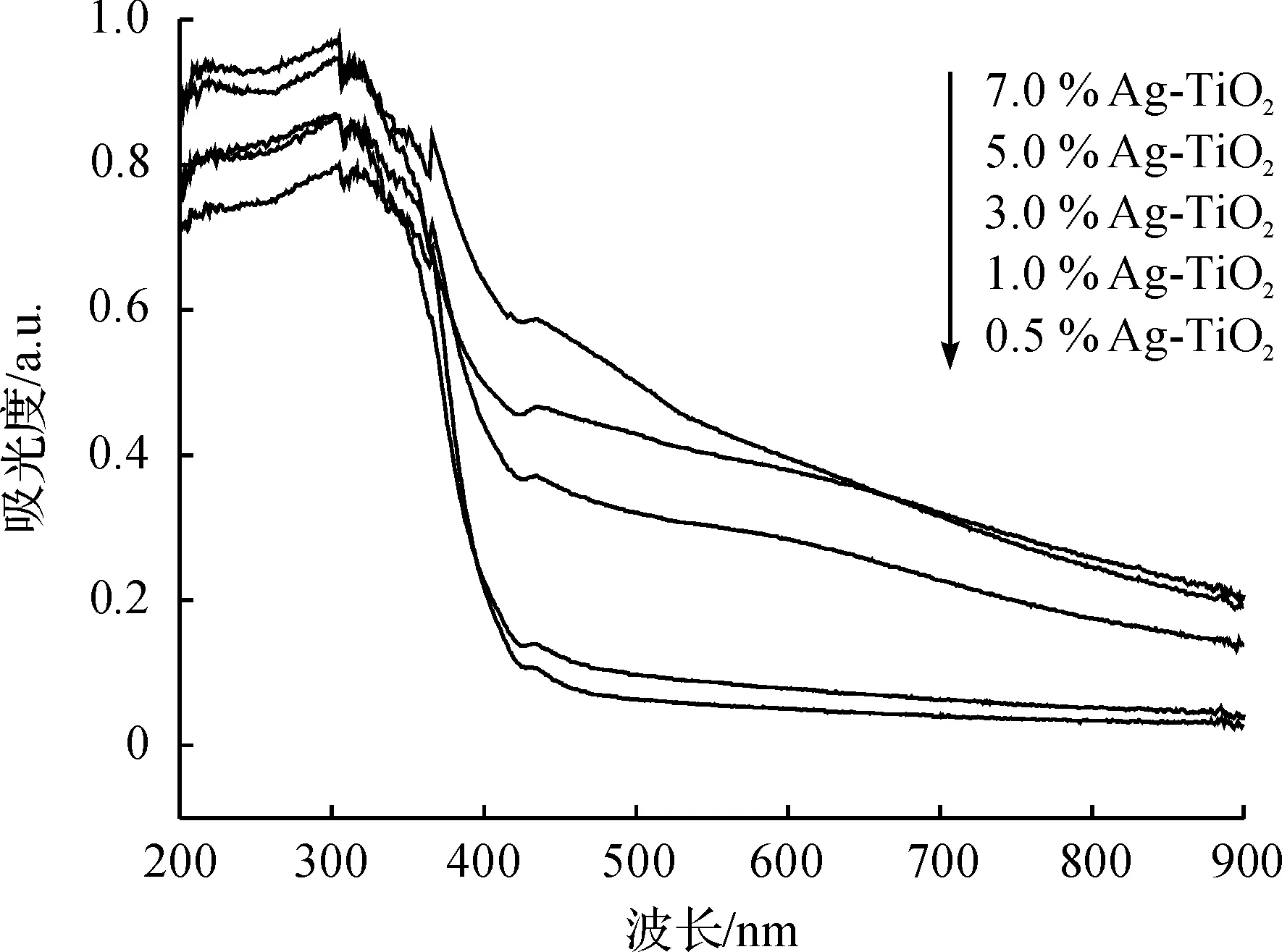
图4 不同修饰量Ag-TiO2催化剂的UV-vis谱图
2.2 光催化还原CO2活性
2.2.1 活性分析

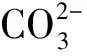
基于以上分析,分别以含碳产物总量以及含碳产物总量与H2产量之和来表示催化剂的碳转化能力和光利用能力.图5描述了不同Ag修饰量的TiO2催化剂随时间推移的碳转化能力以及光利用能力.由图5可知:在同一反应条件下,催化剂Ag-TiO2比纯TiO2具有更强的碳转化能力和光利用能力.

图5 不同催化剂的CO2转化能力和光利用能力
这可能是因为Ag的修饰可提高TiO2对CO2的吸附能力[26-27],增强了CO2从气相到液相的传质过程,从而增强了CO2的光还原效率.此外,反应中Ag+可以通过获得电子生成Ag0的方式有效地分离光生电子-空穴,进一步提高光催化效率.而且,由于TiO2的费米能级要高于Ag的,当Ag修饰到TiO2表面时两者之间形成Schottky结[28],从而可以有效的抑制光生电子和空穴的复合,增强催化剂的光催化活性.
此外,随Ag修饰量的增加碳转化能力和光利用能力均先增大后减小.当Ag的修饰量等于1.0%时,碳转化能力和光利用能力分别达到最大值16.17 μmol/g和142.04 μmol/g;但继续增大Ag修饰量反而不利于碳转化能力和光利用能力.这是由于当Ag修饰过多时,积聚在Ag表面的负电荷会与空穴再次结合,从而降低光催化效率.此外,过量的金属颗粒还会覆盖于TiO2表面阻碍光的吸收,减少电子-空穴的生成量,从而降低催化剂的光利用率[29].
2.2.2 产物选择性分析
在紫外光的照射下,CO2在NaOH水溶液中可催化形成H2,CO,CH4,HCOOH,HCHO,CH3OH
等物质[30-32],其反应机理方程式可以概括为
(1)
(2)
(3)
(4)
(5)
(6)
HCOO-+ 2H++ e-→ HCHO
(7)
HCHO + 2H++ 2e-→ CH3OH
(8)
CH3OH + 2H++ 2e-→ CH4+ H2O
(9)
光催化还原CO2在不同Ag修饰量的TiO2下产物随时间的变化如图6所示.从图6可以看出:Ag-TiO2光催化还原CO2生成了H2,CO,CH4,HCHO,CH3OH等产物,且产物量的大小顺序依次为H2> CH4> CH3OH > CO > HCHO.根据文献,CO2还原为不同产物的相关氧化还原电位分别为CO2/CO-0.53 V,CO2/HCHO-0.48 V,CO2/CH3OH-0.38 V和CO2/CH4-0.24 V[33-34].由此可见,含碳产物的变化规律与氧化还原电位的大小顺序存在着差异,这可能是因为Ag-TiO2光催化还原CO2反应结束后并未达到热力学平衡.

图6 Ag-TiO2光催化还原CO2的各产物量
3 结 论
采用水解煅烧法制备了Ag-TiO2催化剂.由于Ag修饰TiO2的Schottky结作用以及对CO2的吸附作用,该催化剂在紫外光照射的NaOH水溶液中还原CO2的能力明显高于未修饰的TiO2.Ag修饰量为1.0%时催化剂的光催化效果达到最佳.反应产物的量由大到小的顺序为H2> CH4> CH3OH > CO > HCHO.尽管Ag修饰有效提高了TiO2光催化还原CO2的能力,其反应机理和动力学过程有待进一步研究.
参考文献:
[1]TAKEDA H, ISHITANI O. Development of efficient photocatalytic systems for CO2reduction using mononuclear and multinuclear metal complexes based on mechanistic studies[J]. Coordination Chemistry Reviews,2010,254:346-354.
[2]SUN Qian-yun, JIANG Yan-jun, JIANG Zhong-yi, et al. Green and efficient conversion of CO2to methanol by biomimetic coimmobilization of three dehydrogenases in protamine-templated titania[J]. Industrial & Engineering Chemistry Research,2009,48:4210-4215.
[3]ZHANG Qin-hui, HAN Wen-dong, HONG Yi-juan, et al. Photocatalytic reduction of CO2with H2O on Pt-loaded TiO2catalyst[J]. Catalysis Today,2009,148:335-340.
[4]顾巧浓,卓明,陈娇领,等.TiO2光催化降解含氯有机废气实验研究[J].浙江工业大学学报,2004,32(5):589-593.
[5]范能全,俞卫华,范永仙,等.二氧化钛基光催化剂的开发与应用[J].浙江工业大学学报,2007,35(6):602-608.
[6]赵德明,金宁人.过渡金属Fe3+离子修饰改性TiO2的光催化性能研究进展[J].浙江工业大学学报,2005,33(2):165-169.
[7]GUAN Guo-qing, KIDA T, YOSHIDA A. Reduction of carbon dioxide with water under concentrated sunlight using photocatalyst combined with Fe-based catalyst[J]. Applied Catalysis B: Environmental,2003,41:387-396.
[8]UNER D, OYMAK M M. On the mechanism of photocatalytic CO2reduction with water in the gas phase[J]. Catalysis Today,2012,181:82-88.
[9]SASIREKHA N, BASHA S J S, SHANTHI K. Photocatalytic performance of Ru doped anatase mounted on silica for reduction of carbon dioxide[J]. Applied Catalysis B: Environmental,2006,62:169-180.
[10]KOHNO Y, YAMAMOTO T, TANAKA T, et al. Photoenhanced reduction of CO2by H2over Rh/TiO2characterization of supported Rh species by means of infrared and X-ray absorption spectroscopy[J]. Journal of Molecular Catalysis A: Chemical,2001,175:173-178.
[11]SONAWANE R S, DONGARE M K. Sol-gel synthesis of Au/TiO2thin films for photocatalytic degradation of phenol in sunlight[J]. Journal of Molecular Catalysis A: Chemical,2006,243:68-76.
[12]SLAMET, NASUTION H W, PURNAMA E, et al. Photocatalytic reduction of CO2on copper-doped Titania catalysts prepared by improved-impregnation method[J]. Catalysis Communications,2005,6:313-319.
[13]FAN Jun, LIU En-zhou, TIAN Lei, et al. Synergistic effect of N and Ni2+on nanotitania in photocatalytic reduction of CO2[J]. Journal of Environmental Engineering,2011,137:171-176.
[14]SHARMA S, PALLAB S, CHATTOPADHYAY A, et al. Fabrication of antibacterial silver nanoparticle-sodium alginate-chitosan composite films [J]. The Royal Society of Chemistry,2012,2:5837-5843.
[15]REDDY B M, CHOWDHURY B, GANESH I. Characterization of V2O5/TiO2-ZrO2catalysts by XPS and other techniques[J]. Journal of Physical Chemistry B,1998,102:10176-10182.
[16]REDDY B M, CHOWDHURY B, REDDY E P, et al. Characterization of MoO3/TiO2-ZrO2catalysts by XPS and other techniques[J]. Journal of Molecular Catalysis A: Chemical,2000,162:431-441.
[17]XIN Bai-fu, JING Li-qiang, REN Zhi-yu, et al. Effects of simultaneously doped and deposited Ag on the photocatalytic activity and surface states of TiO2[J]. Journal of Physical Chemistry B,2005,109:2805-2809.
[18]PARK M S, KANG M. The preparation of the anatase and rutile forms of Ag-TiO2and hydrogen production from methanol/water decomposition[J]. Materials Letters,2008,62:183-187.
[19]RENGARAJ S, LI X Z. Enhanced photocatalytic activity of TiO2by doping with Ag for degradation of 2,4,6-trichlorophenol in aqueous suspension[J]. Journal of Molecular Catalysis A: Chemical,2006,243:60-67.
[20]LI Jing-xia, XU Jian-hua, DAI Wei-Lin, et al. Dependence of Ag deposition methods on the photocatalytic activity and surface state of TiO2with twistlike helix structure[J]. Journal of Physical Chemistry C,2009,113:8343-8349.
[21]FUKASAWA T, FUNABASHI K, KONDO Y. Separation technology for radioactive lodine from off-gas streams of nuclear facilittes[J]. Journal of Nuclear Science and Technulogy,1994,31:1073-1083.
[22]HE Hai-ping, WANG Yu-xia, CHEN Hong-wei. Synthesis and room temperature photoluminescence of AgI nanoparticles embedded in silica sol-gel coating[J]. Solid State Ionics,2004,175:651-654.
[23]TSENG I H, WU J C S. Chemical states of metal-loaded titania in the photoreduction of CO2[J]. Catalysis Today,2004,97:113-119.
[24]DIMITRIJEVIC N M., VIJAYAN B K., POLUEKTOV O G., et al. Role of water and carbonates in photocatalytic transformation of CO2to CH4on titania[J]. Journal of the American Chemical Society,2001,133:3964-3971.
[25]LIN Chia-chang, LIU Wen-tong, TAN Chung-sung. Removal of carbon dioxide by absorption in a rotating packed bed[J]. Industrial & Engineering Chemistry Research,2003,42:2381-2386.
[26]刘育,侯瑞玲,薛锦珍,等.CO2在Ag-Ba-Ca-K/α-Al2O3上的吸附及其在乙烯环氧化反应中的抑制作用[J].催化学报,1996,17(2):111-116.
[27]梅长松,钟顺和.负载金属对WO3-TiO2光催化剂结构与催化性能的影响[J].化学学报,2005,63(19):1789-1794.
[28]WEN Yan-yuan, DING Han-ming, SHAN Yong-kui. Preparation and visible light photocatalytic activity of Ag/TiO2/grapheme nanocomposite[J]. Nanoscale,2011,3:4411-4417.
[29]CHEN Shi-fu, ZHZO Wei, LIU Wei, et al. Preparation, characterization and activity evaluation of p-n junction photocatalyst p-NiO/n-ZnO[J]. Journal of Sol-Gel Science and Technology,2009,50:387-396.
[30]ZHAO Zhi-huan, FAN Ji-min, LIU Shao-hua, et al. Optimal design and preparation of titania-supported CoPc using solgel for the photo-reduction of CO2[J]. Chemical Engineering Journal,2009,151:134-140.
[31]TAKEDA H, ISHITANI O. Development of efficient photocatalytic systems for CO2reduction using mononuclear and multinuclear metal complexes based on mechanistic studies[J]. Coordination Chemistry Reviews,2010,254:346-354.
[32]ASI M A, HEA C, SU Min-hua, et al. Photocatalytic reduction of CO2to hydrocarbons using AgBr/TiO2nanocomposites under visible light[J]. Catalysis Today,2011,175:256-263.
[33]ROY S C, VARGHESE O K, PAULOSE M, et al. Toward solar fuels: photocatalytic conversion of carbon dioxide to hydrocarbons[J]. ACS Nano,2010,4:1259-1278.
[34]SHIN W, LEE S H, SHIN J W, et al. Highly selective electrocatalytic conversion of CO2to CO at 0.57 V (NHE) by carbon monoxide dehydrogenase from moorella thermoacetica[J]. Journal of the American Chemical Society,2003,125:14688-14689.

