SPE-HPLC-MS/MS法测定人参及土壤中氟硅唑的残留及风险评估
王春伟, 王 燕, 许允成, 崔丽丽, 高 洁
(1 吉林农业大学 农学院,吉林 长春 130118; 2 中国农业科学院 特产研究所,吉林 长春 130112)
SPE-HPLC-MS/MS法测定人参及土壤中氟硅唑的残留及风险评估
王春伟1,2, 王 燕1, 许允成1, 崔丽丽2, 高 洁1
(1 吉林农业大学 农学院,吉林 长春 130118; 2 中国农业科学院 特产研究所,吉林 长春 130112)
【目的】明确人参和土壤中氟硅唑的残留量,并对可能产生的膳食风险进行评估,以确保人参产品的质量安全.【方法】 在集安市和抚松县进行2年试验,采用固相萃取-高效液相色谱-串联质谱法测定了400 g·L-1氟硅唑乳油在人参根及土壤中的残留消解及最终残留量,并采用风险商值法对人参中氟硅唑可能产生的膳食风险进行了评估.【结果和结论】施药剂量为90 g·hm-2(以有效成分计)时,氟硅唑在人参根和土壤中的降解半衰期分别为7.85~9.94和5.59~7.13 d.施药剂量为60~90 g·hm-2时,施药后35 d氟硅唑在人参根和土壤中的残留量分别小于0.043 3和0.037 5 mg·kg-1.风险商值为4.59×10-5,风险较低,处于安全水平.建议我国在人参中氟硅唑的最大残留限量值可暂定为0.05 mg·kg-1,安全间隔期为35 d.
人参; 氟硅唑; 残留; 风险评估; 固相萃取-高效液相色谱-串联质谱法
氟硅唑(Flusilazole)化学名称为双(4-氟苯基)-甲基-(1H-1,2,4-三唑-1-甲基)硅烷,是美国杜邦公司开发的含硅内吸性三唑类杀菌剂,为甾醇脱甲基化抑制剂,能破坏和阻止病菌麦角甾醇的合成,导致细胞膜不能形成,使病菌死亡[1].目前氟硅唑已应用于多种作物上,可用于防治甜瓜炭疽病[2]、梨黑星病[3]、黄瓜黑星病[4]、葡萄白粉病[5].近年来研究发现氟硅唑对人参黑斑病有较好防效,生产中已广泛应用[6].然而三唑类农药会干扰内分泌,大量使用会对人类健康和环境产生危害[7],近年来,欧盟和韩国已制定了氟硅唑在人参中的最大残留限量标准[8-9],而我国尚未制订人参中氟硅唑的最大残留限量标准.氟硅唑的检测方法主要有气相色谱法[10],高效液相色谱法[11],气相色谱法-质谱法[12]和液相色谱-质谱法[13].其中,高效液相色谱-串联质谱法是以质谱仪为检测手段,具有灵敏度高、广谱性强、抗干扰好等优点,可利用色谱保留时间和质谱特征离子对其相对丰度比等多重因素进行准确定性,比传统色谱分析方法更加准确、可靠.液相色谱-质谱法已应用于葡萄、苹果、柠檬、番茄等多种蔬菜和水果中氟硅唑残留量的检测[13-16],然而上述方法均为农药的多残留检测,存在操作繁琐,有机溶剂用量大等缺点,并且人参中基质成分复杂,含有多种皂甙、有机酸、多糖等,样品净化困难,易产生假阳性.本试验根据人参样品基质的特性,建立了人参及土壤中氟硅唑的高效液相色谱-串联质谱检测方法,研究了氟硅唑在人参根及土壤中的残留消解动态及最终残留,建立了氟硅唑在人参中的最大残留限量标准,并对其可能产生的膳食安全风险进行评估,为氟硅唑在人参上的安全合理使用提供依据.
1 材料与方法
1.1 材料
供试品种为4年生大马牙人参.
API 4000串联三重四极杆质谱仪(美国Applied Biosystems SCIEX公司);Agilent1200高效液相色谱仪(美国Agilent公司);Kromasil Eternity-5-C18色谱柱(2.1 mm×150 mm,粒径5 μm,瑞典AKZO NOBEL公司);R-210旋转蒸发仪(瑞士Büchi公司);X-22R离心机(10 000 r·min-1,美国Beckman coulter公司);Vortex.Genie 2涡漩混匀器(德国IKA公司);Milli-QA10去离子水发生器(美国Millipore公司);LC51-GM 200刀式混合碾磨仪(10 000 r·min-1,德国RETSCH公司).
甲苯、丙酮、乙腈均为优级纯(美国TEDIA公司);甲酸为分析纯(天津科密欧化学试剂有限公司);400 g·L-1氟硅唑乳油(美国杜邦公司);氟硅唑标准品纯度(w)99.5%(国家标准物质信息中心);ProElut GPR固相萃取柱(粒径1.5 g·12 mL-1,DIKMA公司).
1.2 试验方法
分别于2011年7月2日和2012年7月7日在吉林省抚松县兴参镇榆树村和集安市大地参业人参种植基地进行2年残留试验,采用背负式喷雾器对人参植株进行叶片喷雾处理,按照用药量由低到高的顺序排列,避免交叉污染.小区面积为15 m2,每小区设3次重复.
1.2.1 消解动态试验 采用在同一小区1次施药、多次采样的方法进行试验,设高剂量和不施药空白对照2个处理.施药剂量为90 g·hm-2.施药后0 (施药后2 h之内)、1、3、7、14、21、28和35 d分别采集人参根及土壤样品,每小区按对角线取5点,土壤样品取土深度为0~10 cm,四分法留样.同期采集空白样品,标记后于-20 ℃条件下保存待测.
1.2.2 最终残留试验 试验设2个浓度处理,分别为60和90 g·hm-2,施药1次和2次,设不施药空白小区作为对照.在施药后28、35和60 d采集人参根和土壤样品,土壤样品采样深度为0~15 cm,采样方法同1.2.1.
1.2.3 样品测定前处理 人参根样品的制备:取不少于200 g的样品,置于混合碾磨仪中粉碎,装入聚乙烯塑料袋中,密封,-20 ℃保存.土壤:取风干的土壤不少于200 g,过0.25 mm筛,混匀,装入聚乙烯塑料袋中,密封,于-20 ℃保存.
提取:取5 g人参根及土壤样品于50 mL离心管中,加入丙酮20 mL,涡漩混合1 min后以8 000 r·min-1离心5 min,取上清液,再向离心管中加入20 mL丙酮,重复提取1 次,合并上清液于35 ℃下旋转蒸发至近干,加入乙腈-甲苯(体积比3∶1)5 mL溶解,待净化.
净化:10 mL乙腈-甲苯(体积比3∶1)预淋洗GPR固相萃取柱,流出液弃去.将5 mL溶解液倾入固相萃取柱中,用20 mL乙腈-甲苯(体积比3∶1)进行洗脱.收集全部洗脱液于鸡心瓶中,于35 ℃水浴中旋转浓缩至近干.用乙腈溶解,并定容至1 mL,经0.22 μm 滤膜过滤后供 HPLC-MS/MS测定.
1.2.4 色谱和质谱条件 色谱柱:Kromasil Eternity-5-C18,2.1 mm×150 mm;柱温度:40 ℃;进样量10 μL;流动相:乙腈-甲酸溶液[体积比1∶1,ρ(甲酸)=0.190];流速:250 μL·min-1;保留时间:6.98 min.电离方式为电喷雾电离源(ESI);正离子扫描;多反应监测;电喷雾电压5 500 V;雾化气压力为0.483 MPa;气帘气压力为0.138 MPa;辅助加热气压力为0.379 MPa;离子源温度为350 ℃;定量离子(m/z)为316.2/247.1;定性离子(m/z)为316.2/247.1和316.2/165.0;去簇电压为85 V;碰撞气能量为26和37 eV.
1.2.5 残留量计算 按下式计算试样中每种农药的残留量:
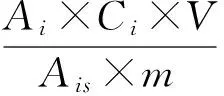
式中,X为试样中被测农药残留量(mg·kg-1);Ai为样液中被测农药的峰面积(或峰高);Ais为标准工作液中农药的峰面积(或峰高);Ci为标准工作液中农药的浓度(μg·mL-1);V为样液最终定容体积(mL);m为最终样液代表的试样质量(g).
1.2.6 标准曲线制作 准确称取氟硅唑标准品,置于100.0 mL容量瓶中,用丙酮定容至刻度配制成浓度100 μg·mL-1的标准储备液,用人参空白基质液稀释、定容,配制成质量浓度为0.001、0.005、0.01、0.05、0.10 μg·mL-1的标准溶液,以质量浓度为横坐标(x),峰面积为纵坐标(y),建立标准曲线,得线性回归方程和相关系数.
1.2.7 添加回收率试验 取空白对照区人参根和土壤样品进行添加回收率试验,分别添加质量浓度为0.01、0.02和0.20 mg·kg-1的标准溶液,每个添加试验设10次重复和1个对照,计算添加回收率和相对标准偏差.
1.2.8 风险评估 按以下公式进行农药的估计暴露量和风险评估[17]:
w1=w0×m1÷m0; RQ=w1÷ADI.
式中w1为估计暴露量(mg·kg-1);w0为理论残留量(mg·kg-1),m1为食物摄入量(kg),m0为体质量.杨大进等[18]调查得出我国60 kg成人的中药材保健食品每日摄入量约为0.000 57 kg,理论残留量以2年2地试验高剂量施药2次时人参根中最终残留量的平均值计,体质量以人均60 kg计.RQ为风险商值;ADI为每日单位体质量允许摄入量(mg·kg-1),氟硅唑的ADI值为0.007 mg·kg-1[19].
当RQ>1时,表示存在不可接受的较大风险,数值越大,风险越大;当RQ<1时,表示风险是可以接受的,数值越小,风险越小.
2 结果与分析
2.1 线性范围和检出限
氟硅唑在0.001~0.10 μg·mL-1范围内,线性方程为y=2.44×104x+4.68×104,相关系数r=0.999 9,其浓度与响应值线性关系良好.以3倍信噪比(S/N=3)计算检出限(LOD),氟硅唑的检出限为0.001 mg·kg-1.
2.2 添加回收率试验
由表1可知:氟硅唑在人参根及土壤的回收率分别为87.90%~92.00%和87.10%~91.50%,相对标准偏差分别为5.83%~8.50%和5.68%~6.98%,符合残留试验要求.
表1氟硅唑在人参根及土壤中的回收率1)
Tab.1Therecoveryrateofflusilazoleinginsengrootandsoil
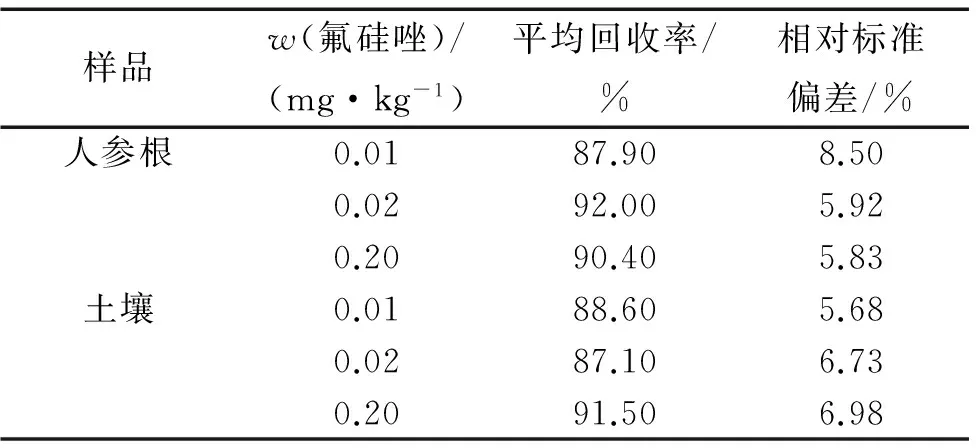
样品w(氟硅唑)/(mg·kg-1)平均回收率/%相对标准偏差/%人参根0.0187.908.500.0292.005.920.2090.405.83土壤0.0188.605.680.0287.106.730.2091.506.98
1)n=10
2.3 残留动态试验
由表2可知:施药后35 d氟硅唑在人参根和土壤中的消解率均在90%以上,其消解动态符合一级反应动力学方程C=C0e-kt,降解半衰期分别为7.85~9.94和5.59~7.13 d,半衰期较短,属于易降解农药(t1/2<30 d).
2.4 最终残留试验
施药后28 d氟硅唑在人参根和土壤中的残留量分别为0.020 0~0.146 7和0.014 8~0.070 0 mg·kg-1;施药后35 d氟硅唑在人参根和土壤中的残留量分别为0.006 7~0.043 3和0~0.037 5 mg·kg-1;施药后60 d氟硅唑在人参根和土壤中的残留量分别为0~0.010 8和0~0.002 4 mg·kg-1(表3).
2.5 氟硅唑在人参中的风险评估
400 g·L-1氟硅唑乳油在人参中的估计暴露量和风险商值由1.2.8中公式计算得出,经计算估计暴露量为3.21×10-7mg·kg-1,风险商值为4.59×10-5(远小于1).因此,400 g·L-1氟硅唑乳油在1个生长季节施药剂量为60~90 g·hm-2,施用1~2次,风险较低,对消费者安全.
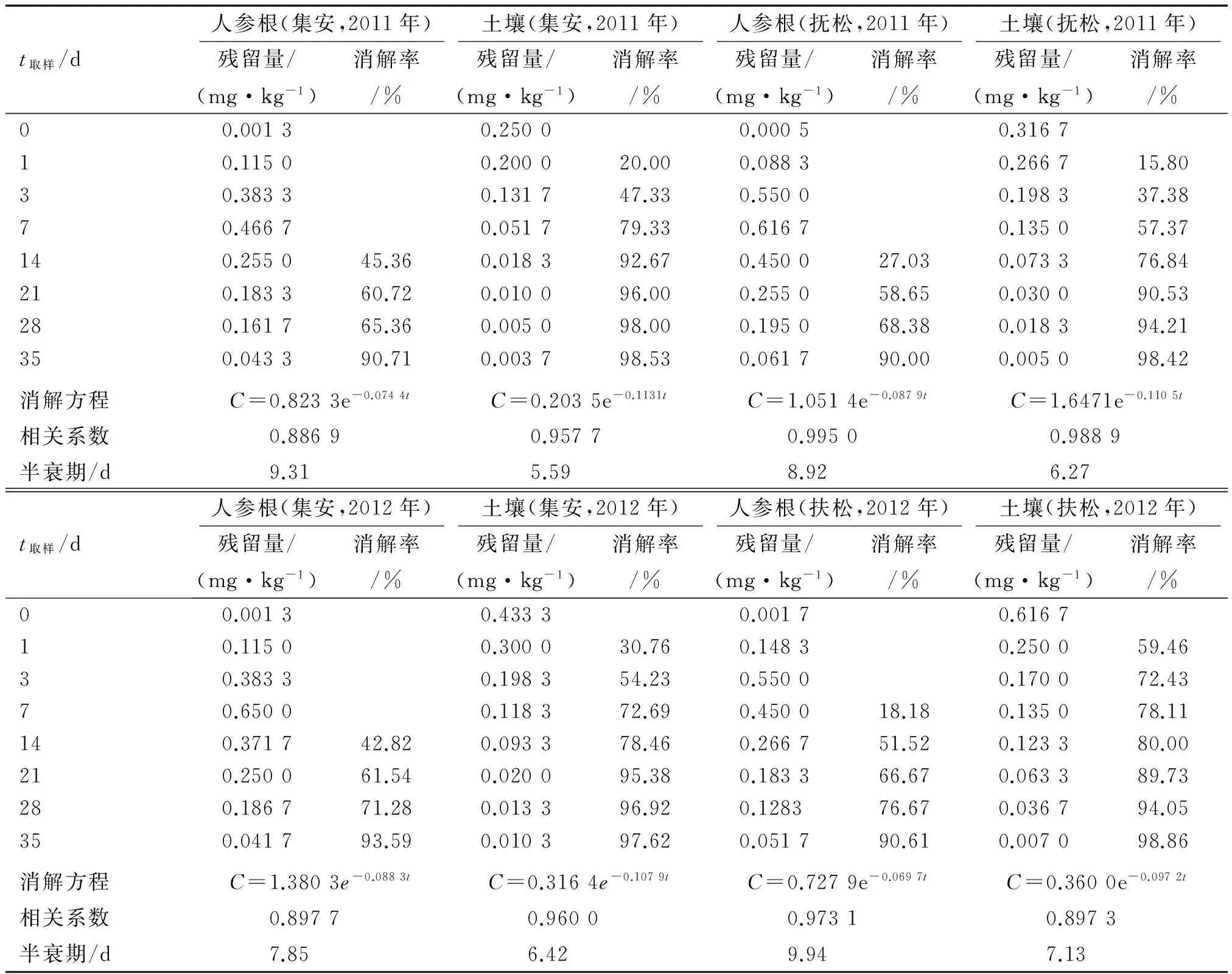
表2 氟硅唑在人参根和土壤中的残留动态Tab.2 Residual dissipation of flusilazole in ginseng root and soil
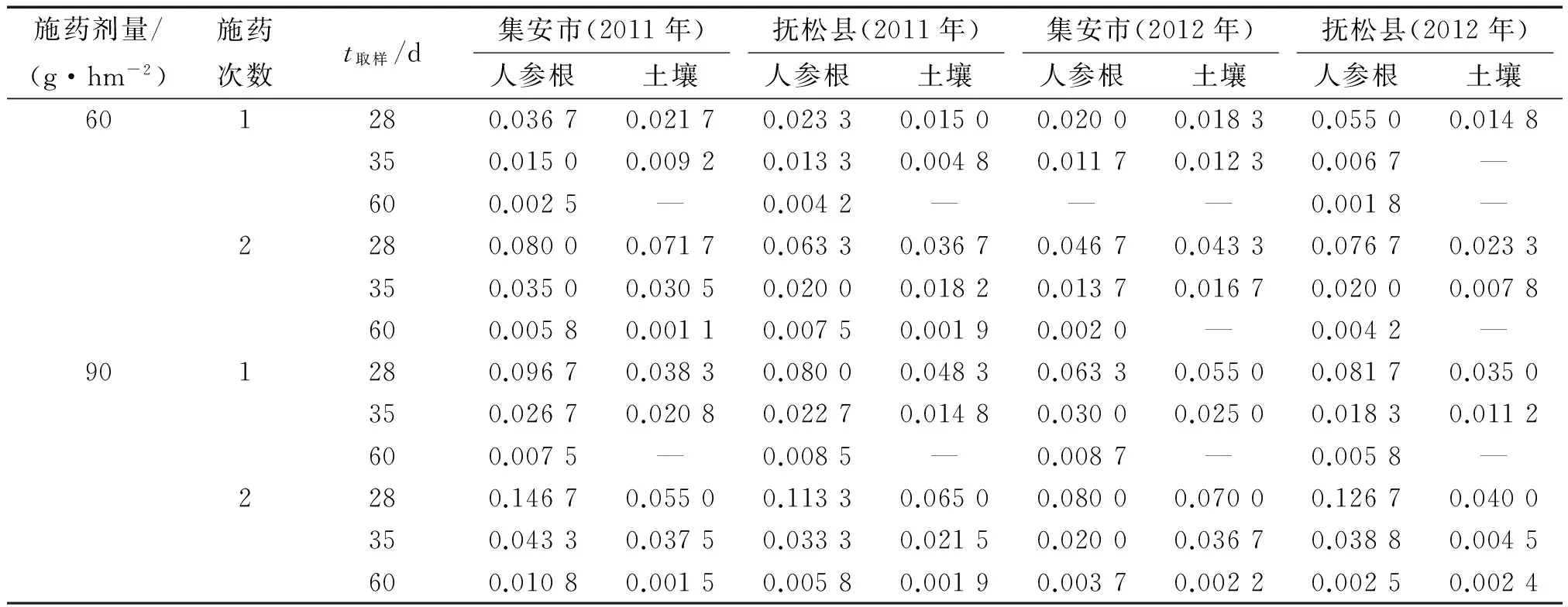
表3 氟硅唑在人参根及土壤中的最终残留量1)Tab.3 Final residues of flusilazole in ginseng root and soil mg·kg-1
1)“—”表示未检出.
3 讨论与结论
本试验采用电喷雾电离源(ESI),使样品先带电再喷雾,带电液滴在去溶剂化过程中形成样品离子,从而被检测,适合分析极性强的大分子有机化合物,其最大特点是易形成多电荷离子,然而样品基质对离子化可能存在抑制作用,从而影响检测结果的灵敏度与准确性.分别以人参根及土壤空白样品提取液配制不同浓度的标准溶液,用来定量测定人参根及土壤中氟硅唑残留量,以保证标准溶液和样品溶液具有同样的离子化条件,从而消除样品基质效应.根据人参样品基质的特点及氟硅唑的理化特性,采用丙酮涡旋提取,GPR固相萃取柱净化,建立了人参中氟硅唑的高效液相色谱-串联质谱测定方法.该方法操作简便、快捷,仅需约1.5 h即可完成样品的提取、净化及测定,且精密度、灵敏度、回收率等方面均符合农药残留检测要求,能满足生产上对氟硅唑残留检测的要求.
残留动态试验结果表明:氟硅唑在人参根和土壤中的降解半衰期分别为7.85~9.94和5.59~7.13 d,半衰期较短,属于易降解农药(t1/2<30 d).作为一种内吸性较强的杀菌剂,在人参生长期施用后,氟硅唑会很快被人参植株吸收,并逐步运输到根中.人参植株本身的生长发育状况及生理生化特性都会影响氟硅唑的降解速率,另外不同的光照、温湿度等外界因素也会对消解速率产生影响.
我国尚未制定氟硅唑在人参中的最大残留限量标准,欧盟规定氟硅唑在人参中的最大残留限量值为0.05 mg·kg-1[8],韩国为0.07 mg·kg-1[9].而我国规定氟硅唑在水果和蔬菜上的最大残留限量值分别为0.20~1.00 mg·kg-1[19],参照以上残留限量规定及本试验数据,建议400 g·L-1氟硅唑乳油在人参中的最大残留限量值可暂定为0.05 mg·kg-1,安全间隔期为35 d.在1个生长季节施药量不高于90 g·hm-2,施用1~2次,风险商值为4.59×10-5(远小于1),风险较低,在该剂量下施用后,人参在收获后入药及食用是安全的.
[1]陈福良, 王仪, 郑斐能, 等.40%氟硅唑微乳剂的研制[J].农药, 2004, 43(12): 544-546.
[2]陈秀娟, 李爱华, 王宏, 等.40%氟硅唑乳油防治甜瓜炭疽病[J].北方园艺, 2005(2): 74-74.
[3]太一梅, 杨存荣, 刘彩英, 等.氟硅唑防治梨黑星病田间药效试验[J].农药, 2004, 43(3): 129-131.
[4]伍祥兴, 胡正祥, 彭淑媛.40%氟硅唑EC对黄瓜黑星病的防治效果[J].湖南农业科学, 2006(3): 89-90.
[5]宋烨华, 高生, 阚晓君.40%氟硅唑乳油对葡萄白粉病的防治效果[J].农药科学与管理, 2004, 26(7): 14-15.
[6]关一鸣, 吴连举, 王英平, 等.3种新型杀菌剂对人参黑斑病菌的抑制作用及田间防病效果[J].特产研究, 2008: 47-49.
[7]KJAERSTAD M B, TAXVIG C, NELLEMANN C, et al.Do azole fungicides possess an endocrine disrupting hazard?[J].Toxicol Lett, 2008, 180(1): 108.
[8]European Commission.Pesticide EU-MRLs regulation (EC) No.396/2005[EB/OL].2005[2013-12-19].http:∥ec.europa.eu/food/plant/pesticides/max_residue_levels/eu_rules_en.htm.
[9]Ministry of food and drug safety.MRLs for pesticides in foods: history of establishment of pesticide MRLs in Korea[EB/OL].Seoul: 2012[2013-12-19].http:∥www.kfda.go.kr/cgi-bin/t4.cgi/eng/english_12.taf.
[11]牛艳, 赵子丹, 吴燕, 等.苹果及土壤中氟硅唑残留量的高效液相色谱分析[J].农药, 2012, 51(6): 439-440.
[12]WALORCZYK S, DROZDZYNSKI D, KOWALSKA J, et al.Pesticide residues determination in Polish organic crops in 2007—2010 applying gas chromatography-tandem quadrupole mass spectrometry[J].Food Chem, 2013, 139(1/2/3/4): 482-487.
[13]CARPINTEIRO I, RAMILL M, RODRIGUEZ I, et al.Determination of fungicides in wine by mixed-mode solid phase extraction and liquid chromatography coupled to tandem mass spectrometry[J].J Chromatogr A, 2010, 1217(48): 7484-7492.
[14]SANNINO A, BOLZONI L, BANDINI M.Application of liquid chromatography with electrospray tandem mass spectrometry to the determination of a new generation of pesticides in processed fruits and vegetables[J].J Chromatogr A, 2004, 1036(2): 161-169.
[15]BLASCO C, FONT G, PICO Y.Comparison of microextraction procedures to determine pesticides in oranges by liquid chromatography-mass spectrometry[J].J Chromatogr A, 2002, 970(1/2): 201-212.
[16]佚名.NY/T 788—2004 农药残留试验准则[S].北京:中国农业出版社, 2004.
[17]中国农业科学院农业质量标准与检测技术研究所.农产品质量安全风险评估: 原理、方法和应用[M].北京: 人民卫生出版社, 2008: 232-233.
[18]杨大进, 王竹天, 宋书锋, 等.中药材类保健食品中添加剂限量标准研制[J].中国公共卫生, 2008, 24(3): 358-359.
[19]中华人民共和国卫生部, 中华人民共和国农业部.GB 2763—2012 食品安全国家标准食品中农药最大残留限量[S].北京: 中国标准出版社, 2012.
【责任编辑霍 欢】
ResiduedeterminationbySPE-HPLC-MS/MSandriskassessmentofflusilazoleintheginsengandsoil
WANG Chunwei1, WANG Yan1, XU Yuncheng1, CUI Lili2, GAO Jie1
(1 College of Agronomy, Jilin Agricultural University, Changchun 130118, China; 2 Institute of Special Wild Economic Animal and Plant Science, Chinese Academy of Agricultural Sciences, Changchun 130112, China)
【Objective】 To investigate flusilazole residues in ginseng and to conduct risk assessment.【Method】 A solid phase extraction (SPE) and high performance liquid chromatography coupled with mass spectrometry (SPE-HPLC-MS/MS) method was developed to determine the residual dissipation and final residues of flusilazole 400 g·L-1EC in ginseng root and soil at Fusong County and Ji’an City in 2011 and 2012.The dietary risk assessment was also conducted using the calculation of risk quotient (RQ).【Result and conclusion】 The half-lives of flusilazole were 7.85-9.94 d in root and 5.59-7.13 d in soil at spraying dosage of 90 g·hm-2.Final residues of flusilazole were below 0.043 3 mg·kg-1in root and below 0.037 5 mg·kg-1in soil, and the risk was very low with 4.59×10-5(much less than 1) of a risk quotient, and the residues could be declined to the safe level over 35 days after spraying once or twice at a dosage ranging from 60 to 90 g·hm-2.It is recommended that the MRL of flusilazole in ginseng should be 0.05 mg·kg-1temporarily, and its preharvest interval should be set at 35 days.
ginseng; flusilazole; residue; risk assessment; SPE-HPLC-MS/MS
2013- 12- 19优先出版时间2014- 09- 30
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20141003.1126.008.html
王春伟(1984—),男,博士研究生,E-mail: chunwei314319@163.com;通信作者:高 洁(1964—),女,教授,博士,E-mail:jiegao115@126.com
吉林省世行贷款农产品质量安全项目(2011-Z24);吉林省人参产业发展专项资金项目(2011省财政厅)
王春伟, 王 燕, 许允成,等.SPE-HPLC-MS/MS法测定人参及土壤中氟硅唑的残留及风险评估[J].华南农业大学学报,2014,35(6):58- 62.
S481.8
A
1001- 411X(2014)06- 0058- 05

