芹菜黄酮类物质降压降脂及抗肿瘤药理活性筛选
胡继松,陈静萍,陈 亮,武小芬,王克勤 ,刘仲华
(1.湖南省核农学与航天育种研究所,湖南 长沙 410125;2.湖南农业大学园艺园林学院,湖南 长沙 410128)
芹菜(Apium grauveolens L.)是人们经常食用的一种保健型蔬菜[1]。大量研究表明,芹菜中含有黄酮类化合物(芹菜素、芹菜苷)、α-芹子烯、β-芹子烯、多种脂肪酸等生物活性成分[2-4],具有抗氧化、清除自由基、抗炎、缓解视力疲劳、降脂、降压、阻滞癌细胞增殖、抑制雌激素和孕激素分泌等作用[5]。肝脏X受体(LXR)和胆汁酸受体(FXR)是编码转录因子的核受体超基因家族成员,在胆汁酸和胆固醇代谢过程中起调节作用,并与多种代谢性疾病密切相关[6]。研究旨在通过细胞模型确定芹菜中黄酮类化合物的药理活性,为芹菜开发新型天然黄酮类药物提供科学依据。
1 材料与方法
1.1 试验材料
芹菜素、芹菜苷、3′-甲氧基芹菜苷,纯度均为98%,芹菜醇提物(黄酮含量40%)和芹菜粗黄酮(黄酮含量70%)均为实验室自制样品。
SMMC-7721细胞株、肝癌细胞株HepG2、白血病细胞株HL-60、LXR细胞模型、FXR激活和抑制细胞模型均由深圳微芯公司提供;磷酸盐缓冲液(PBS)、杜氏磷酸盐缓冲液(DPBS)、培养液和消化液购自Hyclone公司;二甲亚砜(DMSO)购自美国Sigma公司;甲臢化合物(MTS)和吩嗪硫酸二甲酯(PMS)购自Promega公司;FuGENE6试剂盒购自罗氏公司;96孔细胞培养板购自Falcon公司。
1.2 试验方法
1.2.1 细胞活性测定 以SMMC-7721细胞株为材料,采用四氮唑盐酶还原法(MTS)进行细胞活性测定。细胞根据董新荣等[7]的方法进行培养,稀释至适宜浓度进行后续试验。在96孔板中每孔分别加入100 μL细胞液,于37 ℃、5 % CO2条件下培养约24 h,弃去培养液,补加190 μL新鲜培养液;按表1的浓度添加各受试药物10 μL,同时以添加相应体积的培养液和5-氟尿嘧啶分别作为阴性对照和阳性药物对照,混匀后培养48 h后取出,吸出孔中培养液;另外加入培养液60 μL与MTS、PMS的混合液20 μL继续培养,2 h后取出在波长490 nm处测定吸光值。
细胞活性计算公式:细胞活性=(A样-A阴)/(A阳-A阴) (1)
式中,A样、A阳和A阴分别为样品组、添加阳性药物溶液对照组和阴性对照组在490 nm处的吸光值。根据公式(1)计算出细胞活性,确定后续试验加药浓度。
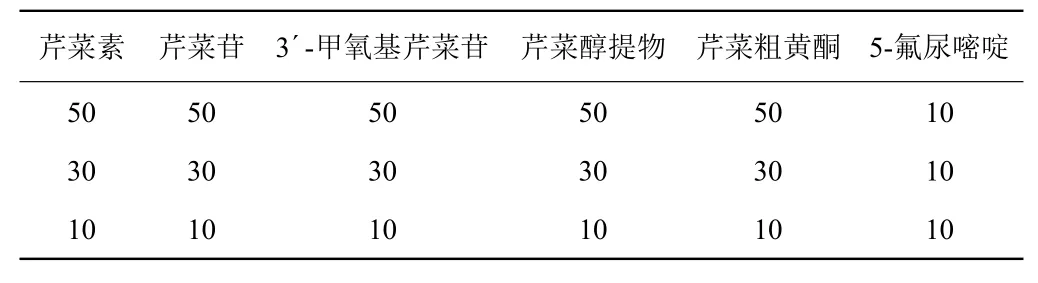
表1 MTS加药浓度试验方案 (μg/m L)Table 1 Design of adding sample concentrations for MTS
1.2.2 药物活性的高通量筛选 LXR、FXR核受体模型的试验:第1 d每孔种20 000个肝癌细胞,培养体系100 μL,采用FuGENE6试剂盒法将质粒转染到细胞中;第2 d弃去原有100 μL培养液,再加入200 μL新鲜培养液,同时按1.2.1确定的浓度加入相应的药物;第3 d检测荧光酶强度(Luciferase)和转染效率(GFP)。HepG2和HL-60肿瘤细胞模型的试验:第1 d每孔分别种HepG2、HL-60细胞30 000个,培养体系为190 μL;第2 d按表2进行加药试验;第4 d加入MTS与PMS的混合液20 μL,继续培养 2 h后取出在波长490 nm处测定吸光值。
1.2.3 受试药物对模型效果的检测 取出细胞培养板,吸出孔中培养液并用PBS清洗细胞,然后加入80 μL的细胞裂解液(裂解液稀释5倍后使用),混匀后静置5 min。其中,取20 μL裂解后的细胞液用黑板测荧光酶强度;取50 μL裂解后的细胞液用黑板测定转染效率。避光条件下每孔加入50 μL 荧光酶强度底物,立即于485 nm波长下检测。细胞接种数量、化合物毒性及转染效率等因素造成的误差采用同时共转染GFP质粒(试验内参)来较正。试验结果的荧光酶强度均采用转染效率值进行校正。转染效率测定时不再加入任何试剂,直接用荧光超微板检测于在527 nm处检测其吸光值。LXR、FXR模型试验结果通过相对激活倍数来表示,其中溶剂对照值为1,值越大则说明样品激活能力越高。
激活倍数=(LUC样品/GFP样品)/ (LUC空白/GFP空白) (2)
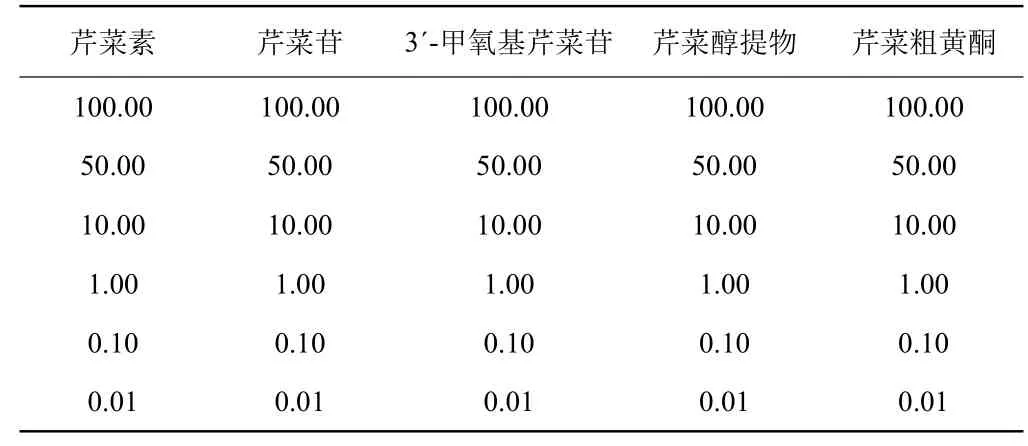
表2 肿瘤细胞模型(HepG2、HL-60)生长抑制试验加药方案 (μg/m L)Table 2 Design of adding sample for screening agonist experiment
溶剂阳性对照组激活倍数为4.21,值越小说明抑制能力越强。所有试验均重复测定2次。
2 结果与分析
2.1 药物添加浓度的确定
药物添加浓度过高会对细胞产生毒性而损伤细胞,浓度过低会导致表达效果不清晰。试验结果表明,阳性药物对照组的细胞值为1.00,无细胞阴性对照组的细胞值为0,样品值低于0.80被确认为能够抑制细胞生长,样品值在0.80以上则被认为基本不抑制细胞生长,其中值越小说明抑制程度越高。由表3可知,当药物浓度为10 μg/m L时,细胞生长基本不受抑制,但是当浓度提高至30 μg/m L以上时,芹菜素明显抑制细胞的生长。因此为了便于药品间的比较,最终所有药物的添加浓度均确定为10 μg/m L。
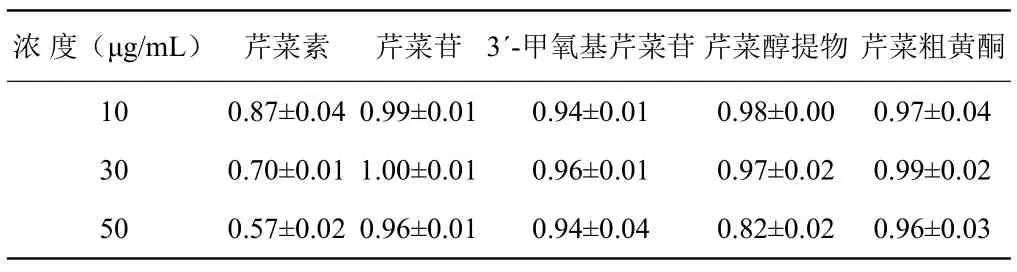
表3 添加不同浓度药物对SMMC-7721细胞株细胞活性的影响 Table 3 Effect of adding different concentrations of drugs on cell activity in SMMC-7721 cell line
2.2 芹菜黄酮类物质对LXR核受体模型的效果
LXR是代谢疾病治疗的靶点之一,对脂代谢的转录调控具有重要作用。采用相对激活倍数来评价LXR模型的试验结果,其中溶剂对照组的激活值为1.00;当样品激活值≥1.00,说明有激活效果;激活值≥1.50,说明激活效果显著;值越大则激活能力越高。由图1可知,5种芹菜黄酮类物质对LXR受体模型均表现出不同程度的活性,其中芹菜素和芹菜醇提物激活效果显著,激活值分别为2.22和1.54。5种芹菜黄酮类物质对LXR核受体模型的激活顺序为:芹菜素>芹菜醇提物>芹菜粗黄酮>3′-甲氧基芹菜苷>芹菜苷。
2.3 芹菜黄酮类物质对FXR核受体模型的效果
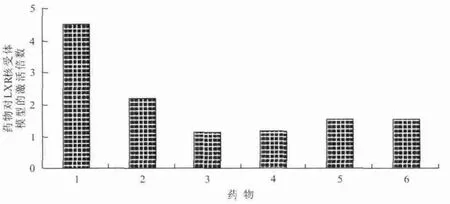
图1 芹菜黄酮类物质对LXR核受体模型高通量筛选结果Fig.1 The result of celery flavonoids on LXR by HTS
FXR通过影响胆汁酸的生物合成从而调节体内胆固醇代谢。由图2可知,仅芹菜苷样品的激活值低于1.00,其他药物的激活值均高于1.00。这表明芹菜素、3´-甲氧基芹菜苷、芹菜醇提物、芹菜粗黄酮对FXR核受体模型有一定的激活活性。其中,芹菜素的激活效果最佳,激活值为1.15,说明芹菜素具有增加FXR受体敏感性的作用。同时,以鹅去氧胆酸为对照,该物质对FXR核受体模型有一定的抑制作用,因此药物的诱导值越小则抑制作用越强。从图2中可以看出,5种芹菜黄酮类物质对FXR抑制模型的作用值均大于鹅去氧胆酸的诱导倍数(4.21),这说明5种芹菜黄酮类物质对FXR核受体模型无明显抑制作用。
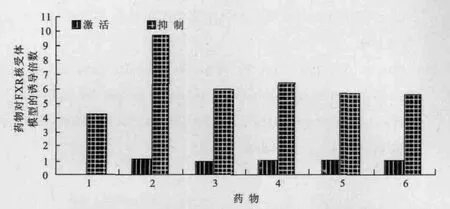
图2 芹菜黄酮类物质对FXR核受体模型的高通量筛选结果Fig.2 The result of theafl avins on FXR by HTS
2.4 芹菜黄酮类物质对肿瘤细胞模型HepG 2和HL-60的效果
黄色新型甲臢化合物能够被活细胞线粒体中的脱氢酶还原为甲臜,生成甲臢的量与培养物中活细胞的数量成正比,因此可根据甲臢的吸光度值推算出活细胞数目,从而评价药物对肿瘤细胞抑制或杀伤的能力。在MTS试验中,阴性对照和阳性药物对照组活的细胞数量分别为0和1.00,以此为依据计算出受试样品组活细胞的相对数量。当数值低于0.50时,说明药物对肿瘤细胞生长有重度抑制作用;数值在0.50~0.80之间时,表示药物对肿瘤细胞生长有轻度抑制作用;数值高于0.8时,则表示药物对肿瘤细胞生长不具抑制效果。
从表4和表5中可以看出,当药物的添加浓度为100 μg/m L时,芹菜素和芹菜醇提物对HepG2肝癌细胞和HL-60白血病细胞均具有重度抑制作用,其中这两种物质对肝癌细胞的半数抑制浓度(GI50)分别为3.31 μg/m L和66.07 μg/m L,对白血病细胞的GI50分别为1.62 μg/m L和44.67 μg/m L。这说明这两种芹菜黄酮类物质对治疗肝癌和白血病都有一定的药理活性。而芹菜苷、3´-甲氧基芹菜苷、芹菜粗黄酮对HepG2肝癌细胞和HL-60白血病细胞筛选数值均大于0.8,GI50均大于100,则说明这三种药物基本不抑制肝癌细胞和白细胞的生长。
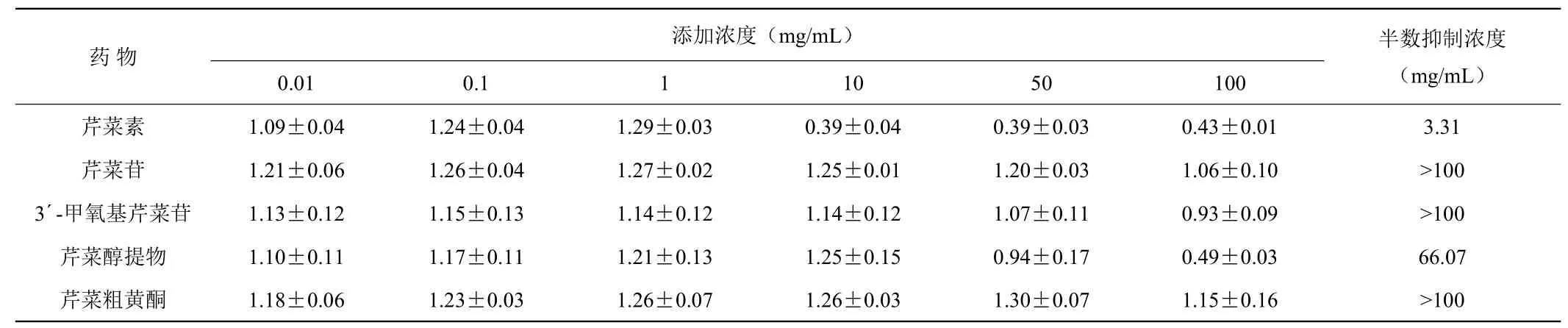
表4 芹菜黄酮类物质对HepG2肝癌细胞的高通量筛选结果Table 4 The result of celery fiavonoids on Hep G2 by HTS
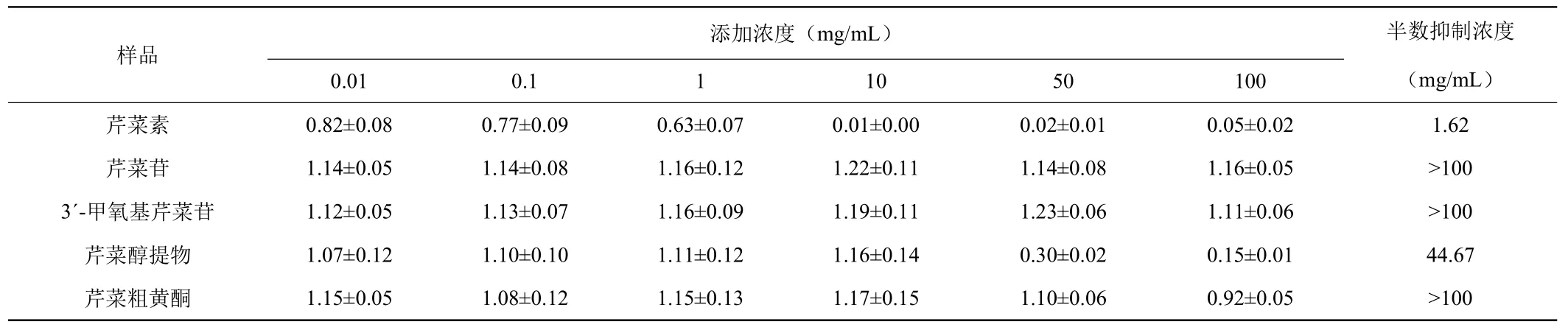
表5 芹菜黄酮类物质对HL-60白血病细胞高通量筛选结果Table 5 The result of celery fiavonoids on HL-60 by HTS
3 结论与讨论
研究采用高通量筛选技术,通过LXR模型、FXR激活和抑制模型来研究芹菜黄酮类物质对代谢综合症的作用效果。结果表明,当样品浓度为10 μg/m L,芹菜素在LXR受体模型上表现出一定的活性,并可有效提高FXR受体模型的敏感性,从而延缓动脉粥样硬化进一步恶化,降低心血管疾病的发生几率。同时,通过激活LXR模型可增加胆固醇从肝脏的排出量,从而减少小肠对胆固醇的吸收,进而调节血脂水平。这一结果与夏藿、梁华等[8-9]的研究结果一致,表明芹菜提取物具有降血脂的效果。
5种芹菜黄酮类化合物对肿瘤细胞的抑制效果表现出较大差异。芹菜素和芹菜醇提物样品对HepG2和HL-60有一定的抑制作用。当浓度为100 μg/m L时,芹菜素和芹菜醇提物抑制HepG2的GI50值分别为3.31 μg/m L和66.07 μg/m L,抑制HL-60的GI50值分别为1.62 μg/m L和44.67 μg/m L。该结果与Gao、胡太平等[10]的研究结果相似。而试验中芹菜粗黄酮、芹菜苷、3´-甲氧基芹菜苷对HepG2和HL-60这两种肿瘤细胞均无明显抑制效果,这与他人的研究结果有一定的差异。这可能与试验设计的浓度以及所选取的肿瘤细胞有关,有待进一步研究。
[1]刘咏松.芹菜的本草研究及功用[J].四川中医,2004,22(7):25-26.
[2]刘佳微,李芝兰,刘玲飞,等.芹菜素对雄性小鼠肝脏功能影响的实验研究[J].中国现代医学杂志,2014,24(2):29-33.
[3]张 伟,李福荣.芹菜籽提取物诱导卵巢癌SKOV-3细胞凋亡的实验研究[J].泰山医学院学报,2013,(12):887-889.
[4]张捷莉.两种不同芹菜籽油中脂肪酸的GC/MS分析[J].中国油脂,2004,29(6):70-71.
[5]历 强,马建仓.芹菜素的药理学研究进展[J].国外医学中医中药分册,2003,25(3):147-149.
[6]秦 俭,韩天权,张圣道.核受体LXR和FXR对脂类代谢的调节[J].国外医学中医中药分册,2005,32(3):223-226.
[7]董新荣,刘仲华.高通量筛选辣椒素与辣椒素酯生物活性的初步研究[J].中国食品学报,2009,9(2):5-10.
[8]夏 藿,隋焕平,邱 隽.芹菜提取物对喂饲高脂饲料大鼠血脂的影响[J].中国公共卫生,2001,17(4):337-338.
[9]梁 华,夏 薇,苑林宏,等.芹菜提取物对自发高血压大鼠血压及高脂模型大鼠血脂的影响[J].疾病控制杂志, 2005,9(2) :97-99.
[10]Gao H,Liu B G,Liu F,et al.Anti-Proliferative Effect o f Camellianin A in Adinandra nitida Leaves and Its Apoptotic Induction in Human Hep G2 and MCF-7 Cells [J].Molecules,2010,15(6):3878-3886.

