番石榴叶具有α-葡萄糖苷酶抑制活性的倍半萜杂二醛分离与鉴定
欧阳文 ,朱晓艾 ,刘润南 ,刘晓娟 ,粟龙杰 ,谢 磊 ,曹 庸 *(.湖南中医药大学药学院,湖南 长沙 4008;.华南农业大学食品学院,广东 广州 5064)
番石榴叶具有α-葡萄糖苷酶抑制活性的倍半萜杂二醛分离与鉴定
欧阳文1,朱晓艾2,刘润南1,刘晓娟2,粟龙杰1,谢 磊1,曹 庸2*(1.湖南中医药大学药学院,湖南 长沙 410208;2.华南农业大学食品学院,广东 广州 510642)
目的分离纯化番石榴叶乙酸乙酯萃取物,并对其抑制α-葡萄糖苷酶活性作用进行研究。方法采用硅胶、凝胶柱层析分离纯化,波谱法进行结构鉴定,比色法进行活性测定。结果分离得到三种倍半杂萜二醛,分别鉴定为psidials A,psiguadial A和guajadial;活性测试结果显示guajadial具有抑制α-葡萄糖苷酶活性,且显著优于阿卡波糖。结论首次报导guajadial为番石榴叶具有抑制α-葡萄糖苷酶活性的成分。
番石榴叶;倍半萜杂二醛;分离鉴定;α-葡萄糖苷酶
随着世界人口的老龄化以及饮食结构、生活方式的改变,糖尿病己经成为一种常见病、多发病,由糖尿病并发症引起的死亡人数己列于心脑血管疾病和癌症之后,成为第三大死亡原因,因此寻找安全、有效的途径预防和治疗糖尿病的发生发展已成为紧迫的国际性任务[1-2]。番石榴(Psidium guajava Linn.)为桃金娘科番石榴属果树,民间的广泛应用和大量的科学研究结果证明番石榴叶具有明显的降糖作用且无毒副作用[3-6],在日本,FOSHU(特定保健用食品)已有批准作为防治II型糖尿病的含番石榴叶提取物的番石榴茶上市[7]。Oh等[8]报道了番石榴叶乙酸乙酯萃取物能够抑制α-葡萄糖苷酶,同时可改善高凝血症;Wang等[9]通过建立抑制α-葡萄糖苷酶模型,证明了番石榴叶乙酸乙酯萃取物和正丁醇萃取物为具有抑制α-葡萄糖苷酶活性的最佳组分。本实验前期的结果表明,乙酸乙酯萃取物具有抑制α-葡萄糖苷酶活性的作用,本文继续对番石榴叶乙酸乙酯萃取物进行了分离纯化研究,获得了三个倍半萜杂二醛化合物,同时通过96孔比色法,以阿卡波糖为阳性对照组,对三个倍半萜杂二醛单体抑制α-葡萄糖苷酶活性进行了研究。
1 材料
1.1 实验材料
番石榴叶,于2012年9月采自广东省茂名市林业局番石榴种植基地,经湖南吉首大学廖博儒教授鉴定为桃金娘科番石榴属植物Psidium guajavaLinn.,植物标本(2012-09-A01)现存于华南农业大学食品学院天然活性物研究中心。
1.2 仪器与试剂
INOVA-500MHz高分辨超导核磁共振谱仪(瑞士Bruker公司),万分之一电子天平 (梅特勒-托利多),Wallac VICTOR31420酶标仪 (美国PE公司)。α-葡萄糖苷酶、4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)(日本 TCI公司);阿卡姆糖(Sigma 公司);薄层层析用硅胶G、H,柱层析用硅胶(100~200目)(青岛海洋化工厂),Sephadex LH-20(美国GE公司),其他试剂均为分析纯。水为超纯水。
2 方法
2.1 提取与分离纯化
番石榴叶2 kg,粉碎成粗粉,用12倍体积95%乙醇回流冷浸提取3次,60℃减压回收溶剂,加适量水分散,乙酸乙酯液充分萃取,减压回收溶剂得乙酸乙酯浸膏45.9 g。取乙酸乙酯萃取浸膏40 g,经硅胶常压、低压柱层析,重结晶及葡萄糖凝胶LH-20(SephadexLH-20)层析,共分离得到了化合物1(132 mg)、化合物 2(22 mg)、化合物 3(42 mg)。
2.2 抑制α葡萄糖苷酶活性测定
[10-11],略有改动,在96孔板中进行比色法测定:首先将20 μL的α-葡萄糖苷酶 (0.8 U/mL)加入到样品孔中,平行6份,然后将测试样品溶于DMSO配制成母液,用0.01 mol/L pH 6.8磷酸缓冲液按一定比例稀释,每孔加入样品溶液120 μL(测试样品的最终浓度见表1),37℃条件下预培养15 min,再加入5 mmol/L反应底物4-硝基酚-α-D-吡喃葡萄糖苷溶液20 μL。37℃水浴反应15 min后,每个样品孔中加入0.2 mol/L的Na2CO3溶液80 μL终止反应,在405 nm波长处比色测定吸光度。
实验设阴性空白、阴性对照、样品空白、样品组;其中阴性对照为溶解样品溶液按测试样品的最终浓度同样用磷酸缓冲液稀释加入反应,阴性空白为缓冲溶液代替酶溶液;样品空白为相同体积的磷酸缓冲液代替酶溶液。化合物抑制率由样品OD值对于空白和对照OD值计算,计算公式如下:

2.3 结构鉴定
对所获得的单体化合物,采用薄层层析分析纯度,纯度合格后测定单体化合物的核磁共振谱,同时对获得的波谱数据综合解析,并与文献比较进行化合物结构鉴定。
2.4 统计学分析
3 结果
3.1 抑制α-糖苷酶活性测定
通过建立抑制α-葡萄糖苷酶活性测试模型,以阿卡波糖为阳性对照,测定了乙酸乙酯萃取物的抑制活性,结果表明阿卡波糖在625~156 μg/mL范围内剂量依赖性地抑制α-葡萄糖苷酶的活性,其IC50为(358.2±9.2)μg/mL,与文献数据[11]接近;乙酸乙酯萃取物在312.5~1 250 μg/mL范围内呈剂量依赖性地抑制α-葡萄糖苷酶的活性,其IC50为(1 129.9±53.7)μg/mL。
继续对乙酸乙酯萃取组分进行分离纯化,获得了三个单体化合物,测定其抑制α-葡萄糖苷酶活性,结果显示化合物1(psidials A)和化合物2(psiguadial A)在 625~10 μg/mL 浓度范围内无明显抑制效果, 而化合物 3 (guajadial)在 78.1~19.3 μg/mL浓度内呈剂量依赖性地抑制α-糖苷酶活性,其 IC50为(52.3±2.6)μg/mL,显著优于阳性对照阿卡波糖。见表1。
表1番石榴叶乙酸乙酯萃取物和guajadial抑制 α-葡萄糖苷酶活性测定 (±s,n=6)
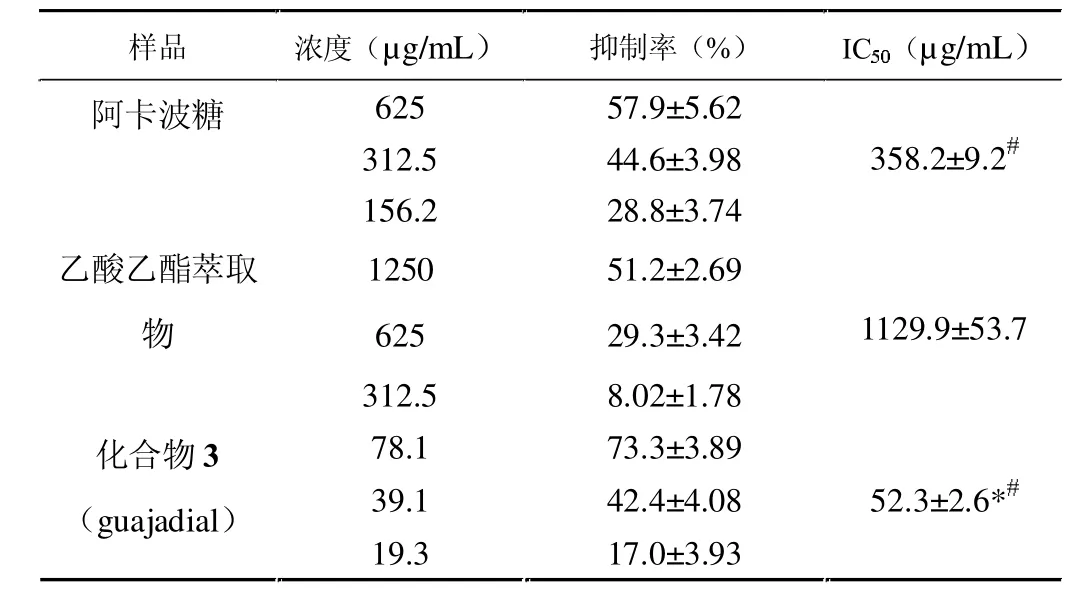
表1番石榴叶乙酸乙酯萃取物和guajadial抑制 α-葡萄糖苷酶活性测定 (±s,n=6)
注:与乙酸乙酯萃取物比较#P<0.05;与阿卡波糖比较*P<0.05。
阿卡波糖625 57.9–5.62 312.5 44.6–3.98 156.2 28.8–3.74乙酸乙酷萃取物1250 51.2–2.69 625 29.3–3.421129.9–53.7 312.5 8.02–1.78化合物3(guajadial) 19.3 17.0–3.93 78.1 73.3–3.89 39.1 42.4–4.08
3.2 单体结构鉴定
3.2.1 化合物1 无色方状结晶,香草醛-浓硫酸显紫红色,1H-NMR (CDCl3,500 MHz):δ13.46,13.11,10.12,10.17(1H,each s),7.1-7.3(5H,m),5.05(1H,d,J=12.0 Hz),4.20 (1H,d,J=6.0 Hz),0.98,1.01,1.19(3H,each s);13C-NMR(CDCl3,125 MHz):δ59.3(C-1),23.9(C-2),47.8(C-3),88.0(C-4),35.0(C-5),24.4(C-6),35.5(C-7),150.8(C-8),42.2(C-9),36.1(C-10),34.7(C-11),29.7(C-12),21.7(C-13),22.2(C-14),111.2(C-15),35.0(C-1’),107.5(C-2’),168.5(C-3’),104.2(C-4’),167.5(C-5’),104.7(C-6’),164.1(C-7’),138.6(C-8’),129.9(C-9’),128.0(C-10’),126.9(C-11’),128.0(C-12’),129.9(C-13’),192.0(C-14’),191.6(C-15’)。以上数据和文献[12]报道的psidials A一致。
3.2.2 化合物2 无色针状结晶,香草醛-浓硫酸显紫红色,1H-NMR (CDCl3,500 MHz):δ13.78,13.56,10.40,10.14(1H,each s),7.1-7.3(5H,m),4.5(1H,s),1.14(3H,s),1.12(3H,d,J=6.5 Hz),0.93(3H,s),0.59(1H,m),0.31 (1H,dd,J=8.5,12.0 Hz),0.25(3H,s);13C-NMR(CDCl3,125 MHz):δ104.1(C-1),36.6(C-2),37.9(C-3),47.8(C-4),48.7(C-5),26.3(C-6),23.9(C-7),20.3(C-8),30.3(C-9),39.9(C-10),19.2(C-11),28.4(C-12),14.3(C-13),17.4(C-14),24.9(C-15),53.2(C-1’),114.2(C-2’),166.7(C-3’),108.2(C-4’),168.2(C-5’),105.6(C-6’),170.5(C-7’),140.9(C-8’),130.3(C-9’),127.6(C-10’),126.4(C-11’),127.6(C-12’),130.3(C-13’),193.7(C-14’),191.8(C-15’)。 以上数据和文献[13]报道的psiguadial A一致。
3.2.3 化合物3 无色针状结晶,香草醛-浓硫酸显紫红色,1H-NMR (CDCl3,500 MHz):δ13.46,13.08,10.12,10.08(1H,each s),7.1-7.3(5H,m),4.56(1H,s),4.06(1H,s),3.40(1H,d,J=10.0 Hz),1.28(3H,s),1.03(3H,s),1.00(3H,s);13C-NMR(CDCl3,125 MHz):δ53.2(C-1),22.2(C-2),37.1(C-3),84.3(C-4),43.4(C-5),30.4(C-6),35.4(C-7),150.7(C-8),41.3(C-9),36.7(C-10),33.8(C-11),30.3(C-12),22.0(C-13),21.2(C-14),110.2(C-15),43.4(C-1’),105.5(C-2’),163.4(C-3’),104.1(C-4’),168.3(C-5’),104.7(C-6’),169.5(C-7’),143.7(C-8’),128.7(C-9’),127.9(C-10’),126.2(C-11’),127.9(C-12’),128.7(C-13’),192.1(C-14’),191.5(C-15’)。以上数据和文献[14]报道的 guajadial一致。
以上三种化合物结构式见图1。
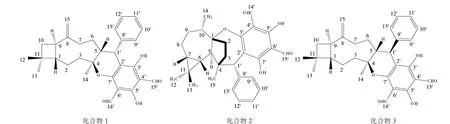
图1 番石榴叶乙酸乙酯萃取物三种倍半杂萜二醛结构式
4 讨论
从具有抑制α-葡萄糖苷酶活性的乙酸乙酯萃取物中分得的三种倍半杂二醛,经CA文献检索,该类罕见新颖骨架唯独存在于番石榴叶中。
通过单体化合物的抑制α-葡萄糖苷酶活性测定,表明化合物3(guajadial)的抑制活性显著优于阳性对照物阿卡波糖,推测其为番石榴叶降糖活性成分之一。
化合物 1(psidials A)和化合物 3(guajadial)为同分异构体,两者的差异仅仅在1’位苯基取代的空间构效上的差异,其中化合物1的C-1’苯基为α构构型,无抑制α-葡萄糖苷酶活性的作用,而化合物3的C-1’苯基为β构型,有显著抑制α-葡萄糖苷酶活性的作用,结合文献[15]表明苯基的存在与否对于降糖活性起关键性作用,同时其空间构型也是影响活性的重要因素。
参考文献:
[1]Lin Y,Sun Z.Current views on type 2 diabetes[J].Journal of Endocrinology,2010(204):1-11.
[2]徐斯盛,张惠斌,周金培,等.新型抗糖尿病药物的研究进展[J].中国药科大学学报,2011,42(2):97-106.
[3]Gutierrez R M P,Mitchell S,Solis R V.Psidium guajava:A review of its traditional uses,phytochemistry and pharmacology[J].Journal of Ethnopharmacology,2008(117):1-27.
[4]王 波,刘衡川,鞠长燕.攀枝花地区野生番石榴叶不同提取物降血糖作用研究[J].四川大学学报(医学版),2005,36(6):858-861.
[5]蔡丹昭,刘华钢,陈洪涛,等.番石榴叶总黄酮对实验性糖尿病小鼠血糖水平的影响[J].生命科学研究,2009,13(1):34-37.
[6]OjewoleJ.Hypoglycemicand hypotensiveeffectsofPsidium guajava Linn.(Myrtaceae)leaf aqueous extract[J].Methodsand Findings in Experimental and Clinical Pharmacology,2005,27(10):689-695.
[7]Yoriko D,Kouji M.Anti-hyperglycemic and anti-hyperlipidemic effects of guava leaf extract[J].Nutrition&Metabolism,2010,7(1):9-13.
[8]Won K O,Chul H L,Myung S L,et.al.Antidiabetic effects of extracts from Psidium guajava[J].Journal of Ethnopharmacology,2005,96:411-415.
[9]Wang H,Du Y J,Song H C.Alpha-Glucosidase and alphaamylase inhibitory activities of guava leaves.Food Chemistry[J],2010,123(1):6-13.
[10]Feng J,Yang X W,Wang R F.Bio-assay guided isolation and identication ofα-glucosidase inhibitorsfrom theleavesof Aquilaria sinensis[J].Phytochemistry,2011(72):242-247.
[11]Li W,Fu H W,Bai H,Sasaki T,Kato H,Koike K.Triterpenoid saponins from Rubus ellipticus var.obcordatus[J].Journal of Nature Produce,2009(72):1 755-1 760.
[12]Fu H Z,Luo Y M,Li C J,et.al.Psidials A-C,Three Unusual Meroterpenoids from the Leaves of Psidium guajava L[J].Organic Letters,2010,12(4):656-659.
[13]Shao M,Wang Y,Liu Z,et.al.Psiguadials A and B,Two Novel Meroterpenoids with Unusual Skeletons from the Leaves of Psidium guajava[J].Organic Letters,2010,12(21):5 040-5 043.
[14]Yang X L, Hsieh K L,Liu J K. Guajadial:An Unusual Meroterpenoid from Guava Leaves Psidium guajava[J].Organic Letters,2007,9(24):5 135-5 138.
[15]刘美凤,蒋利荣,刘华鼐,等.番石榴叶抗II型糖尿病活性成分的虚拟筛选[J].华南理工大学学报(自然科学版),2011,39(3):28-31.
(本文编辑 杨 瑛)
Sesquiterpenoids with α-Glucosidase Inhibitory Activities from the Leaves of Psidium guajava Linn.
OU Yangwen1,ZHU Xiaoai2,LIU Runnan1,LIU Xiaojuan2,SU Longjie1,XIE Lei1,CAO Yong2*
(1.School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208;2.College of Food Science,South China Agricultural University,Guangzhou,Guangdong 510642,China)
ObjectiveTo study the α-glucosidase inhibitory active compounds from the ethyl acetate extract of guava leaves.MethodsThe compounds were separated from the ethyl acetate extract by repeating silica gel and Sephadex LH-20 column chromatography.The1H-NMR,13C-NMR techniques were used to identify the chemicalstructures.The α-glucosidaseinhibitory activities were tested by colorimetry.ResultsThree special meroterpenoids were isolated and identified as psidials A,psiguadial A and guajadial.Guajadial showed α-glucosidase inhibitory activities significantly and its activity was better than that of Acarbose.Conclusions Guajadial as one of the α-glucosidase inhibitory active compound from Guava leaves was reported for the first time.
leavesofPsidium guajava Linn.;Meroterpenoids;isolation and structural identification;α-Glucosidase
* 曹 庸,男,教授,E-mail:caoyong2181@scau.edu.cn。
R284.1
A
10.3969/j.issn.1674-070X.2014.08.005.017.04
2014-05-17
国家自然科学青年基金项目(31201321);湖南省教育厅项目(13B084);广州市科技计划项目(2013J4100075);湖南中医药大学本科教学质量工程项目(TD-007)。
欧阳文,男,博士,讲师,研究方向:天然产物化学。

