脂肪来源干细胞对兔皮肤组织扩张后回缩率的影响
阎 贺, 张永平, 徐淑娟, 高 涛, 谭慎兴, 杨彪炳
实验研究
脂肪来源干细胞对兔皮肤组织扩张后回缩率的影响
阎 贺, 张永平, 徐淑娟, 高 涛, 谭慎兴, 杨彪炳
目的探讨在皮肤组织扩张过程中注射脂肪来源干细胞对扩张皮瓣回缩率的影响。方法取健康新西兰大白兔的脂肪,体外分离、培养并传代脂肪来源干细胞,行免疫细胞化学表面标志物及表皮细胞诱导分化鉴定,并利用EdU染色对脂肪来源干细胞进行标记;20只新西兰大白兔随机分为实验组和对照组,每组各10只;在兔背部埋置一30 ml扩张器;实验组在扩张皮下注射1 ml脂肪来源干细胞悬液,细胞密度为5×106/ml;对照组仅注射1 ml无血清DMEM培养基;常规组织扩张至预期容量;切取扩张组织,观察切片厚度及组织学变化;计算两组回缩率并作统计学分析;采用免疫组化染色对组织中血管内皮生长因子和内皮细胞特异性标记物(CD31)进行检测。结果与对照组相比,实验组扩张皮瓣回缩率明显降低(P<0.05);组织学显示,实验组扩张皮肤厚度大于对照组(P<0.05);免疫组化显示,实验组CD31、VEGF表达量增多,毛细血管增生明显。结论脂肪来源干细胞能够促进新生血管生成及皮肤组织再生,很大程度地减少了扩张皮肤组织的回缩率,从而提高了皮肤扩张效率。
脂肪来源干细胞; 皮肤扩张; 回缩率; 血管生成
目前,皮肤软组织扩张技术已广泛应用于整形外科。然而,扩张的皮瓣因其近期和远期的回缩往往难以达到预期的效果。因此,寻找一种能够减少皮瓣回缩的有效方法,具有重要的临床意义。脂肪来源干细胞(adipose-derived stem cells, ADSCs)是从脂肪组织分离出来的多能干细胞,经诱导后,可以向骨、软骨、脂肪等间充质细胞甚至上皮细胞分化[1-2]。本实验旨在探讨在皮肤扩张过程中,通过注入脂肪来源干细胞促进新生皮肤组织再生,从而降低回缩率的可能性,为建立更适应于临床的皮肤扩张模型提供实验依据。
1 材料与方法
1.1 实验动物 6个月龄雄性新西兰大白兔20只,体质量2~3 kg,购自潍坊医学院动物中心。
1.2 实验材料 30 ml硅橡胶软组织皮肤扩张器(余姚市久盛硅橡胶制品厂);EdU试剂盒(广州市锐博生物科技有限公司)。
1.3 ADSCs的分离、培养、传代及鉴定 取大白兔新鲜脂肪,放置于无菌盘中,用PBS缓冲液冲洗,去除红细胞和组织碎片,剪碎至细小颗粒状,1200 r/min离心5 min,消化,经200目筛网过滤后,加入DMEM培养液终止消化,离心,弃上清,留贴壁细胞;用低糖DMEM培养液重悬并接种至培养瓶中,在37 ℃、5%CO2的培养箱中孵育,观察细胞生长及形态特征。用免疫细胞化学法检测ADSCs表面特异性标记物CD34、CD44、CD29及CD106;经表皮细胞生长因子(epidermal growth factor, EGF)诱导ADSCs向表皮细胞表型分化,并鉴定其CK19的表达。
1.4 EdU标记ADSCs 使用第3 代细胞作为实验细胞。将实验细胞接种于96孔板中,接种密度为1×105/孔,培养至生长阶段。用10 μM 浓度的EdU标记ADSCs,并孵育12 h。按照EdU试剂盒染色步骤进行染色,荧光显微镜下进行观察。
1.5 扩张模型的建立 将20只大白兔随机分实验组和对照组,每组各10只。3%戊巴比妥钠静脉麻醉。术区脱毛、消毒、铺巾。于大白兔背部垂直于脊柱方向切开约2 cm长的切口,在浅筋膜深层剥离出一腔隙,实验组和对照组均置入30 ml肾形扩张器,向扩张囊内注入20 ml生理盐水,使之充盈,严密缝合伤口。术后肌注青霉素40万u,以防感染。将经EdU标记的第3代ADSCs,经胰酶消化分离,用无血清DMEM配制成浓度为5×106/ml的细胞悬液。在实验组扩张皮下注入ADSCs悬液1 ml;对照组仅注射无血清DMEM培养基1 ml。1周后伤口愈合拆线,拆线后开始注水,每3天注水1次,每次10 ml,最终注水量120 ml,4周后完成扩张(图1)。
1.6 皮肤回缩率的计算以及组织学观察 在取出扩张器之前,在扩张皮瓣顶部正中央部位标记一个2.5 cm×2.5 cm的方格,并对其照相。取出扩张器后,将标记部位切下放置于玻璃上, 待其自由回缩完全后,再对其照相。用图像分析软件对扩张皮肤组织收缩前后的面积进行测量。同时将扩张皮瓣放入4%多聚甲醛中固定,常规石蜡组织切片,HE染色并进行组织学观察。在低倍光镜下,用显微测量尺对皮肤组织切片全层厚度进行测量并对比。

1.7 ADSCs细胞示踪及免疫组织化学检查 对扩张皮肤组织进行常规石蜡组织切片,按照EdU试剂盒方法,对切片染色并用荧光显微镜观察。采用免疫组织化学染色,对组织中血管内皮生长因子(vascular endothelial growth factor, VEGF)和内皮细胞特异性标记物(CD31)进行检测。
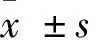
2 结果
2.1 ADSCs形态学观察及免疫细胞化学鉴定 原代细胞6~8 h开始贴壁生长,24 h后贴壁细胞充分伸展,培养至第3代,细胞铺满瓶底,排列较整齐,并形成集落,彼此融合呈长梭形分布。 免疫细胞化学检测结果显示,ADSCs特异性标志物CD44、CD29阳性表达,而造血系统相关抗原CD34、CD106则为阴性表达。ADSCs向表皮细胞诱导结果显示,CK19阳性表达。
2.2 EdU标记ADSCs 在共聚焦显微镜下观察可见,被EdU染色的细胞核呈红色,经Hoechst染色的背景细胞呈蓝色,将两者重叠后呈现橙红色,这表明EdU成功标记ADSCs(图2)。
2.3 扩张皮肤回缩率 两组扩张皮肤离体后均有回缩,实验组扩张皮肤回缩率明显小于对照组(P<0.05),见表1。
表1 皮肤扩张后两组回缩率
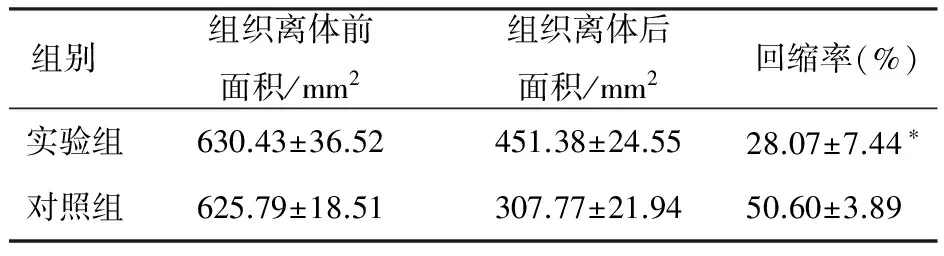
组别组织离体前面积/mm2组织离体后面积/mm2回缩率(%)实验组630.43±36.52451.38±24.5528.07±7.44∗对照组625.79±18.51307.77±21.9450.60±3.89
注:n=10,*与对照组比较P<0.05
2.4 ADSCs在扩张皮肤中的转归及组织学检查 在共聚焦显微镜下观察发现,实验组经EdU标记的红色荧光细胞参与了皮肤结构的生成;组织学检查发现,两组皮肤扩张后,实验组较对照组皮肤增厚更加明显,尤其是表皮层(表2,图3,4)。胶原纤维排列疏松,纤维间隙增加,偶见胶原纤维断裂;免疫组织化学显示:与对照组相比,实验组VEGF表达量增加,微小血管密度增加,内皮细胞特异性标记物CD31表达量增加(图5)。
表2 皮肤扩张后两组皮肤厚度
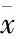

组别扩张后全层皮肤厚度/mm扩张后表皮厚度/μm实验组4.11±0.14∗137.20±2.34∗对照组2.89±0.16113.17±6.11
注:n=10,*与对照组比较P<0.05
3 讨论
皮肤软组织扩张术最早由CG Neumann应用于临床并获得成功,现已成为整形外科手术中尤为重要的一种技术手段。根据皮肤扩张研究理论,皮肤组织扩张是一种复杂的机械应力过程,其中,额外皮肤的产生主要来自新生皮肤再生[3],以此来实现扩张效应。在皮肤牵拉过程中,容易产生一种类似创伤的微环境[4],由于皮肤再生能力有限,单纯的增加皮肤机械应力很难促进皮肤组织生长,且易导致皮肤组织更大回缩,甚至坏死。因此,我们尝试通过局部注射ADSCs的方法,促进皮肤再生,降低皮肤回缩率,从而增加皮肤组织扩张效率。近年来,已报道了许多提高皮肤扩张效率的方法。1985年,P Lee等研究了药物罂粟碱对组织扩张皮瓣的影响,他发现使用罂粟碱可以通过增加扩张皮瓣的血流量来提高皮肤扩张效率;栾杰等[5]也发现,外用罂粟碱霜可以提高皮肤组织扩张效率,缩短扩张时间,增加扩张皮瓣的成活长度;另外,二甲基亚砜[6]、类固醇类和茶碱类药物[7]也被证实能够加速组织扩张。然而,这些药物的不良反应限制了其在临床上的广泛应用。
干细胞技术目前正以其无可比拟的优越性,被应用于多种临床治疗及研究。同其他干细胞相比,ADSCs具有来源丰富、易于获得以及低免疫原性[8]等优点。本实验旨在探讨通过局部注射ADSCs,增加扩张皮肤血管再生及新生组织形成,从而降低扩张皮肤回缩率的可能性。据报道,ADSCs在体外可以分化为内皮细胞,将ADSCs放在添加了甲基纤维素和VEGF的培养基中培养,可发现有内皮细胞特异性标志物CD31的表达[9];ADSCs在无血清培养条件下进行诱导后,CD31表达量明显增加,这表明其能够向血管内皮细胞分化[10];还有研究发现,脂肪来源干细胞在VEGF、bFGF诱导下,能够分化为内皮细胞[11],这为ADSCs在体内分化为血管内皮细胞,进而促进新生血管的形成,提供了一定的理论依据。在临床应用方面, ADSCs局部应用可促进缺血皮瓣毛细血管增生,减少缺血皮瓣的坏死,明显提高皮瓣的成活率[12];更有学者展望,将ADSCs应用于难愈性创面的治疗[13]。这些都表明,ADSCs对组织再生、修复具有重要的临床意义。
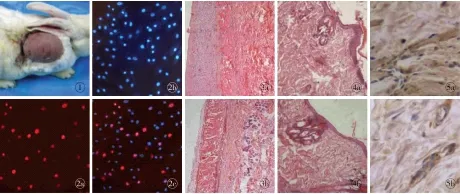
图1 皮肤组织扩张模型图2 标记ADSCs (×200) a.Edu标记ADSCs b.Hoechst标记ADSCs c.两者重叠图3 扩张皮肤组织(HE ×50) a.实验组 b.对照组图4 扩张皮肤组织(HE ×200) a.实验组 b.对照组图5 实验组扩张皮肤免疫组化 (SP ×400) a.VEGF表达 b.CD31表达
Fig1 Expansion model of skin tissue.Fig2 Labeled ADSCs (Confocal microscopy ×200). a. ADSCs labeled with EdU. b. ADSCs labeled with Hoechst. c. Overlap of EdU and Hoechst.Fig3 Tissue after skin expansion (HE ×50). a. experimental group. b. control group.Fig4 Tissue after skin expansion (HE ×200). a. experimental group. b. control group.Fig5 Immunohistochemistry of expanded skin in the experimental group (SP ×400) a. the expression of VEGF. b. the expression of CD31.
我们采用皮下局部注射ADSCs,可聚集更高浓度的细胞,更有利于ADSCs 发挥作用。免疫组织化学显示,实验组血管内皮细胞特异性标记物CD31的表达量增加,说明了ADSCs在皮肤扩张过程中,至少有一部分转化成了内皮细胞。这些新生的内皮细胞参与了新生血管壁结构的形成,从而保证了扩张皮肤更好的血液供应,对新生组织的营养支持具有重要意义。VEGF表达量增多也说明了这一点,以往研究证明,ADSCs 能够分泌VEGF等各种生长因子[14]。ADSCs通过不断分泌VEGF,在扩张皮肤再生过程发挥重要作用。VEGF还可以通过刺激内皮细胞形成新生血管来促进血管增生,并通过促进内皮细胞增殖分化,从而促进新生血管形成。众所周知,被扩张的皮肤组织越薄,回缩率越大;反之,皮肤组织越厚,其回缩率就会越小。组织学发现,实验组扩张皮肤厚度远远大于对照组,且表皮增厚更加明显,相对于对照组表现出更强的皮肤组织再生能力。
为了探寻ADSCs最终的分化方向,我们对移植的ADSCs进行EdU标记。与传统的免疫荧光染色(BrdU)检测方法相比,EdU标记更加简便,且对细胞影响小[15-16]。有报道称,EdU最佳标记浓度是10 μM,12 h[17]。因此,我们采用10 μM的最佳浓度进行标记。荧光显微镜显示,EdU标记的ADSCs主要集中在真皮、皮下组织,说明ADSCs参与了皮肤的再生过程。
然而,本实验并没有研究ADSCs对扩张皮瓣的远期效果,这需要我们进一步地长期观察研究;此外,皮肤组织扩张器置入体内,作为一种外来异物,大多会诱发异物排斥反应,通过介导免疫炎症反应,导致纤维包膜的形成,这会对机械扩张产生一种反牵拉的力。虽然ADSCs在扩张过程中能够促进皮肤组织再生,减少回缩率,但是纤维包膜的形成,还是会对组织扩张效率造成很大的影响。如何更有效地抑制纤维包膜形成,有待我们进一步研究。
综上所述,在皮肤软组织扩张中,ADSCs是一种很有前途的治疗方法,对提高皮肤扩张效率,减少皮肤回缩率,有着重要的临床意义。虽然目前有很多方法可以促进扩张皮肤组织再生,但ADSCs对皮肤再生发挥的作用及效果更加明显直接,这也为今后的临床实际应用提供了参考。
[1] Zuk PA, Zhu M, Ashjian P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002,13(12):4279.
[2] Hata Y. Do not forget the fundamental merits of repair using a tissue expander[J]. Plast Reonstr Surg, 2002,109(2):819-822.
[3] de Filippo RE, Atala A. Stretch and growth: the molecular and physiologic influences of tissue expansion[J]. Plast Reconstr Surg, 2002,109(7):2450-2462.
[4] Li C, Zheng Y, Wang X, et al. Bone marrow-derived stem cells contribute skin regeneration in skin and soft tissue expansion[J]. J Cell Physiol, 2011,226(11):2834-2840.
[5] 栾 杰, 唐 勇, 杨佩瑛, 等. 外用罂粟碱霜加速组织扩张的实验研究[J]. 中华整形外科杂志, 2002,18(1):29-32.
[6] Raposio E, Santi PL. Topical application of DMSO as an adjunct to tissue expansion for breast reconstruction[J]. Br J Plast Surg, 1999,52(3):194-197.
[7] Matt BH, Squier CA, Kelly KM, et al. Enhancement of expansion of guinea pig skin by local delivery of an anticontractile agent using a new bilumen expander[J]. Ann Plast Surg, 1990,24(4):335-341.
[8] 梁 爽, 袁桂峰, 钟毓娟, 等. 小鼠脂肪干细胞的免疫原性及移植安全性[J]. 中国组织工程研究, 2012,16(1):47-50.
[9] Planat-Benard V, Silvestre JS, Cousin B, et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives[J]. Circulation, 2004,109(5):656-663.
[10] 郭峘杉, 颜 玲. 无血清培养促进脂肪干细胞向血管内皮细胞分化[J]. 中国组织工程研究, 2013,(36):6443-6448.
[11] 薛 君, 边云飞, 郭泽君, 等. 体外诱导人脂肪干细胞向内皮细胞分化的研究[J]. 中国分子心脏病学杂志, 2009,9(1):24-27.
[12] 李光早, 孙庆章, 熊竹友, 等. 人脂肪干细胞对兔任意型皮瓣成活的影响[J]. 中华整形外科杂志, 2011,27(2):119-123.
[13] 吴 军. 干细胞移植治疗难愈性创面的展望[J]. 中华烧伤杂志, 2007,23(1):3-5.
[14] Kim WS, Park BS, Sung JH. The wound-healing and antioxidant effects of adipose-derived stem cells[J]. Expert Opin Biol Ther, 2009,9(7):879-887.
[15] Kee N, Sivalingam S, Boonstra R, et al. The utility of Ki-67 and BrdU as proliferative markers of adult neurogenesis[J]. J Neurosci Methods, 2002,115(1):97-105.
[16] Kiel MJ, He S, Ashkenazi R, et al. Haematopoietic stem cells do not asymmetrically segregate chromosomes or retain BrdU[J]. Nature, 2007,449(7159):238-242.
[17] 张 怡, 王克明, 李发成, 等. EdU 体外标记人脂肪干细胞的实验研究[J]. 中国美容医学, 2013,22(1):43-47.
Effectofadipose-derivedstemcellsontheretractionrateafterskintissueexpansioninrabbit
YANHe,ZHANGYong-ping,XUShu-juan,etal.
(WeifangMedicalUniversity,Weifang261053,China)
ObjectiveTo investigate the effect of adipose-derived stem cells (ADSCs) on the retraction rate after skin tissue expansion in rabbit.MethodsFat isolated from healthy rabbits was isolated, cultured and then generated in vitro for 3 passages into the ADSCs. The characterizations of ADSCs were determined by their surface markers and their ability to differentiate into epidermal cells. The ADSCs were marked by EdU. Twenty rabbits were randomly divided into experimental and control groups, 10 rabbits for each group. A tissue expander (30 ml) was buried in the back of the rabbit with 5×106/ml ADSCs (1 ml) subcutaneous injection in the experimental group and only 1ml serum-free DMEM injection the control group, respectively. The tissue was expanded conventionally to expected capacity. The retraction rates in the 2 groups were calculated and statistically analyzed. Immunohistochemical staining was used to detect the expression of endothelial cell marker (CD31) and vascular endothelial growth factor (VEGF).ResultsCompared with the control group, skin retraction rate in the experimental group was significantly lower (P<0.05). Immunohistochemical staining showed that CD31, VEGF expression increased in the experimental group, and also demonstrated a significant increase in capillary density.ConclusionIt suggests that ADSCs can promote neovascularization and skin tissue regeneration and significantly reduce the retraction rate of the skin tissue, thereby increasing the efficiency of skin expansion.
Adipose derived stem cells; Skin expansion; Retraction rate; Angiogenesis
10.3969/j.issn.1673-7040.2014.06.019
R318;R622
A
1673-7040(2014)06-0370-04
2014-03-02)
潍坊医学院科技创新研究基金资助项目(K11TS1006)
261053 山东 潍坊,潍坊医学院(阎 贺,张永平,徐淑娟,高 涛,谭慎兴);潍坊医学院整形外科医院 整形外科(杨彪炳)
阎 贺(1989-),男,山东省淄博人,硕士研究生.
杨彪炳,261053,潍坊医学院 整形外科医院,电子信箱:ybiaobing@163.com

