小叶榕叶抗炎成分分析及活性评价
黄 洋,邵慧凯,李 康,刘盛权,谢淑桐
(广东药学院药科学院,广东广州 510006)
小叶榕叶是桑科植物榕属小叶榕Ficus microcarpa的干燥叶子,全年可采,阴干入药,其作为岭南民间用药,在我国南方分布广泛,其水提物干浸膏作为咳特灵胶囊的主要成分被收载在《中华人民共和国卫生部药品标准》中药成方制剂第十四分册中。小叶榕叶具有抗炎、杀菌、镇痛和止咳平喘等作用[1],临床上常将其干浸膏用于咳嗽、哮喘等多种疾病的治疗[2]。它抗炎的药效已有大量相关文献报道[3],但从有效部位的角度去研究其抗炎药效物质罕见相关文献报道,此外,采用脂多糖 (Lipopolysaccharide,LPS)建立体外炎症模型去探讨其作用机理也未见学者涉足。深入了解炎症的作用机理,可对中药小叶榕叶的抗炎药效物质基础提供可靠的理论指导。前期研究结果发现其有效部位在小叶榕叶水提物的乙酸乙酯层萃取部位[4];本研究主要对该部位进行化学成分分析以及活性评价,为寻找其发挥抗炎药效的物质基础以期为小叶榕叶浸膏的质量控制提供可靠的数据参考。
1 仪器与材料
1.1 仪器 AUW220D型十万分之一电子天平(日本岛津公司);Kafler显微熔点测定仪 (北京泰克仪器有限公司);旋转蒸发器 (巩义市英峪高科仪器厂);涡旋混合器 (天津药典标准仪器厂);HH-S型恒温水浴锅 (巩义市予华仪器有限公司);电热套 (海宁市新华医疗器械厂);AVANCEIII500MHz型核磁共振波谱仪 (瑞士布鲁克拜厄斯宾有限公司);Bruker AVANCEIII 500MHz全数字超导核磁共振谱仪 (瑞士 Bruker公司);GZX-9240MBE型数显鼓风干燥箱 (上海博迅实业有限公司医疗设备厂);WFH-203型三用紫外分析仪(上海精科实业有限公司)。PerkinElmer Spectrum-100型傅立叶变换红外光谱仪 (KBr压片);Bruker AV-400超导核磁共振仪 (瑞士Bruker公司);四级杆串联飞行时间质谱 (美国Waters公司)。CO2培养箱 (美国Thermo electron公司);倒置显微镜(广州湘仪机电设备有限公司);超净工作台 (苏州净化设备厂);全波长多功能酶标仪 (美国Biorad公司),HH-S型恒温水浴锅 (巩义市予华仪器有限公司);离心机 (美国Thermo electron公司)。
1.2 试剂和药材 小叶榕新鲜叶子采自广州大学城穗石村,经广东药学院中药学院生药学教研室刘基柱教授鉴定为桑科榕属的植物榕树的叶,采摘叶子于室内阴干。
RAW264.7细胞株 (中山大学实验动物中心细胞库);地塞米松 (Dexamethasone,DEX,上海源叶生物科技有限公司);LPS(美国Sigma公司,L2880);DMEM培养基 (美国 Hyclone公司);胎牛血清 (Gibco公司);胰酶 (Gibco公司);双抗(Hyclone公司);噻唑蓝 (美国 Axygen公司);NO检测试剂盒 (碧云天生物技术研究所);TNF-α试剂盒 (武汉华美生物工程有限公司);血球计数板 (上海求精生化试剂仪器有限公司);DMSO(天津市大茂化学试剂厂),PBS(北京鼎国昌盛生物科技技术有限责任公司);柱层析硅胶 (200~300目,分析纯)、薄层层析硅胶G(青岛海洋化工集团);化学试剂均为分析纯。显色剂为10%硫酸乙醇溶液,乙醇为食用级,实验中所用其他试剂均为分析纯。
2 提取与分离
2.1 提取 取新鲜阴干后小叶榕叶约20 kg,剪碎后水提取,液料比20∶1,回流提取3次,每次2 h,浓缩至适当的相对密度后,静置冷却。按部颁标准用95%乙醇醇沉至含醇体积分数为80%~85%,慢加快搅,静置24 h,抽滤,回收乙醇。在旋转蒸发仪上减压浓缩,加水形成悬浮液,加石油醚脱酯,水相加乙酸乙酯萃取,取有机相,减压浓缩,得到乙酸乙酯浸膏,真空干燥。
2.2 分离 取乙酸乙酯层干浸膏约200 g,与适量硅胶 (200~300目)研磨均匀,在干燥器中挥干,上硅胶柱 (200~300目),其洗脱溶剂和比例见图1和图2所示,减压旋干,根据TLC检识结果合并相近的流份,各部分经反复硅胶柱层析和重结晶得到化合物1~10。
3 细胞培养
取对数生长期的细胞,经0.25%胰酶消化,用含 10%胎牛血清、100 μL/mL青霉素、0.1 mg/mL硫酸链霉素的 DMEM培养基,于37℃、5%CO2培养箱中培养。根据代谢情况1~2 d换一次液,至对数期备用。
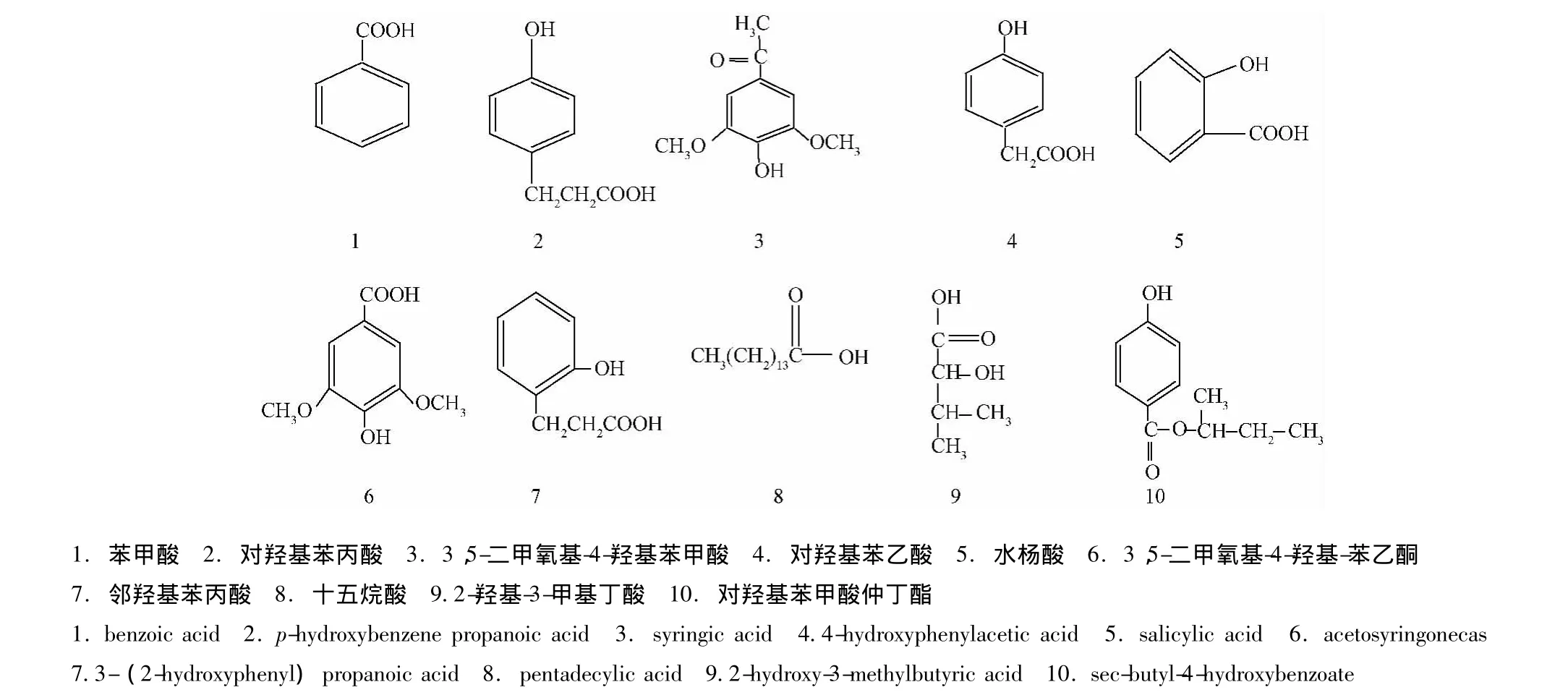
图1 化合物结构图Fig.1 Structure of ten compounds
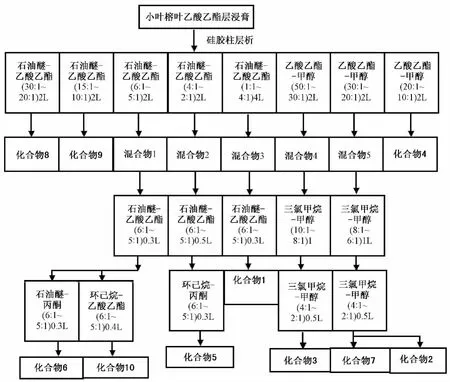
图2 小叶榕叶乙酸乙酯层分离流程图Fig.2 Flow chart of the ethyl acetate layer from Ficus microcarpa L.f.
3.1 各单体成分对RAW264.7细胞活性的影响取对数生长期的RAW264.7细胞,用0.25%的胰酶消化,吹打,使其成为均匀的单细胞悬液,计数细胞,用培养基稀释成约1.2×105个/mL并接种于96孔板中,每孔100 μL,置37℃、5%CO2培养箱培养4 h。细胞贴壁后,试验组加入试验药物(50.0、10.0、5.0、1.0、0.1 μg/mL)和阳性药物地塞米松 (10.0 μg/mL),正常组 (不加药物的细胞空白孔),LPS组 (1.0 μg/mL)、调零孔 (不接种细胞的空白孔),溶剂组 (含0.1%DMSO),每个质量浓度设置5个复孔。连续孵育20 h,在实验结束前4 h,每孔加入 MTT(5.0 mg/mL)20 μL,继续孵育至实验结束,吸弃上清,每孔加入150 μLDMSO充分溶解细胞沉淀,振荡15 min,在l h内用酶标仪在波长490 nm测量,参比波长为630 nm处测定OD值,实验重复3次。药物对细胞生长的抑制作用以存活率表示,存活率越高,表明药物毒性越低。存活率计算公式如下:
存活率 (%)=(药物干预孔A -空白对照孔A)/(正常细胞孔A-空白对照孔A)×100%。
3.2 细胞培养液中NO测定 取对数生长期的RAW264.7细胞,用0.25%的胰酶消化,吹打,使其成为均匀的单细胞悬液,计数细胞,用培养基稀释成约1.0×105个/mL并接种于96孔板中,每孔100 μL,于37℃、5%CO2培养箱培养4 h。细胞贴壁后,设置正常组、LPS组、给药组 (各单体成分50.0 μg/mL,20 μg/mL,10.0 μg/mL)和阳性药物DEX(10.0 μg/mL);再往培养体系中加入终质量浓度为1.0 μg/mL LPS作为刺激剂,置37℃,5%CO2培养24 h,轻轻吸取上清。按照NO试剂盒操作进行检测;抑制率 (%)=(模型组细胞因子浓度-给药组细胞因子浓度)/(模型组细胞因子浓度-正常组细胞因子浓度)×100%。
3.3 ELISA法检测各单体成分对TNF-α的抑制作用 取对数生长期的RAW264.7细胞,用0.25%的胰酶消化,吹打,使其成为均匀的单细胞悬液,计数细胞,用培养基稀释成约2.5×105个/mL,接种于96孔板中,每孔100 μL,于37℃、5%CO2培养箱培养4 h。细胞贴壁后,设置正常组、LPS组、给药组 (各单体成分 50.0μg/mL,20 μg/mL,10.0 μg/mL)和阳性药物 DEX(10.0 μg/mL);再往培养体系中加入终质量浓度为1.0 μg/mL LPS作为刺激剂,置37℃,5%CO2培养24 h,收集上清液并以酶标仪读取450 nm波长处的吸光度值,根据相应的ELISA试剂盒说明书操作并根据标准曲线计算TNF-α的量,并进行组间比较;抑制率 (%)=(模型组细胞因子浓度-给药组细胞因子浓度)/(模型组细胞因子浓度-正常组细胞因子浓度)×100%。
4 统计学分析
各项实验重复3次,使用 SPSS 17.0中的one-way ANOVA进行多个样本间的两两比较,结果以来表示,P<0.05为结果具有显著性差异。
5 结果
5.1 化合物结构鉴定
化合物1:无色针晶,mp 122~124℃。IR(KBr)νmax:3071,3012,2952,2834,2672,2 558, 1 688, 1 583, 1454 cm-1。1H-NMR(500MHz,CDCl3)δ:8.16(2H,d,J=7.7 Hz,2,6-H),7.65(1H,t,J=7.4 Hz,4-H),7.52(2H,t,J=7.7 Hz,3,5-H)。13C-NMR(126 MHz,CDCl3)δ:172.55(C-7),134.04(C-4),130.44(C-6),129.54(C-2),128.72(C-3,5),130.1(C-1)。以上数据与文献 [5]报道一致,可以确定化合物1为苯甲酸。
化合物2:白色结晶,mp 130~131℃。IR(KBr)νmax:3400,2956,1705,1610,1452,1410 cm-1。1H-NMR(500 MHz,MeOD)δ:7.02(2H,dt,J=8.6,2.8,2.1 Hz,2,6-H),6.69(2H,dt,J=8.6,2.8,2.1 Hz,3,5-H),2.79(2H, t, J=7.7Hz),2.52(2H, t, J=7.7 Hz)。13C-NMR(126 MHz,MeOD)δ:176.96(C-3'),156.78(C-4),132.96(C-1),130.26(C-2,6),116.32(C-3,5),37.21(C-1'),31.27(C-2')。其中7.02(2H,dt,J=8.6,2.8,2.1 Hz,2,6-H),6.69(2H,dt,J=8.6,2.8,2.1 Hz,3,5-H),这两组氢信号表明苯环存在1,4取代模式。碳谱中出现δ 176.96(s)为羧酸中羰基碳信号。以上数据与文献 [6]报道一致,可以确定化合物2为对羟基苯丙酸。
化合物3:白色针晶,mp 212~213℃。IR(KBr)νmax:3372,1700,1620,1523,1463 cm-1。1H-NMR(500 MHz,MeOD)δ:7.35(s,1H),δ 3.91(d,J=4.2 Hz,3H)。13C-NMR(126 MHz,MeOD)δ:168.6(s),147.66(s),107.18(s),55.60(s)。但从1H-NMR和13C-NMR可以看出,出现了4个碳信号和两个氢信号,所以推测其可能含有一对称结构,而其中δ 3.91(d,J=4.2 Hz,3H)为甲氧基信号,据此可以推测在苯环上有一对称取代的甲氧基。δ 7.35(s,1H)为苯环对称1,3,4,5取代的信号。以上数据与文献 [7]报道一致,可以确定化合物3为3,5-二甲氧基-4-羟基苯甲酸。
化合物4:白色针晶,mp 150~153℃。IR(KBr)νmax:3366,2975,2898,1711,1616,1517 cm-1。1H-NMR(500 MHz,MeOD)δ:7.12(2H,d,J=9.0 Hz),6.78(2H,d,J=9.0 Hz),3.49(s,2H)。13C-NMR(126 MHz,MeOD)δ:175.11(s),156.23(s),130.14(s),125.63(s),115.10(d,J=24.8 Hz),47.81(dp,J=42.9,21.4 Hz),39.94(s)。在芳香区给出了两组芳香质子信号δ 7.12(2H,d,J=9.0 Hz),δ 6.78(2H,d,J=9.0 Hz)提示对位取代苯的存在。以上数据与文献[8]报道一致,可以确定化合物4为对羟基苯乙酸。
化合物5:白色针晶,mp 160~161℃,IR(KBr)νmax:3239,2864,1668,1525,1405 cm-1。1H-NMR(500 MHz,CDCl3)δ:10.42(2H,2-OH,7-OH),7.97(dd,J=8.0,1.7 Hz,1H,H-6),7.53(1H,dt,J=1.5,8.0 Hz,H-4),7.05(d,J=8.4 Hz,1H,H-3),6.96(1H,J=8.0 Hz,H-5)。13C-NMR(126 MHz,CDCl3)δ:176.25(C-7),163.64(C-2),138.44(C-4),132.40(C-6),121.06(C-5),119.29(C-3),112.75(C-1)。以上数据与文献 [9-10]基本一致,可以确定化合物5为水杨酸。
化合物6:白色针晶,mp 123~125℃,IR(KBr)νmax:3369,2984,2945,1665,1604,1517,1463 cm-1。1H-NMR(500 MHz,MeOD)δ:8.04(1H,4-OH),7.32(2H,s,H-2,6),3.92(6H,s,3,5-OMe),2.57(3H,s,8-Me)。13CNMR(126 MHz,MeOD)δ:197.4(C-7),147.78(C-3,5),140.13(C-4),127.98(C-1),106.25(C-2,6),55.65(3,5-OMe),25.10(C-8)。以上数据与文献[11]基本一致,可以确定化合物6为3,5-二甲氧基-4 羟基-苯乙酮。
化合物7:白色针状结晶,IR(KBr)νmax:3385,2976,1690,1594,1448 cm-1。1H-NMR(500 MHz,MeOD)δ:7.89(m,1H),7.03(2H,m,H-4,6),6.83(1H,d,J=7.9 Hz,H-5),6.70(1H,d,J=7.9 Hz,H-5),2.82(2H,t,J=6.1 Hz,H-7),2.55(2H,t,J=6.1 Hz,H-8)。13C-NMR(126 MHz,MeOD)δ:175.82(C=O),155.51(C-2),131.80(C-1),129.04(C-6),121.51(C-5),114.93(C-3),36.00(C-8),30.04(C-7)。以上数据与文献 [12]基本一致,可以确定化合物7为邻羟基苯丙酸。
化合物 8:白色粉末,mp 61~63℃,IR(KBr)νmax:3367,2925,2854,1712 cm-1。1HNMR(500 MHz,CDCl3)δ:2.34(2H,t,J=7.5Hz),1.62(2H,m),1.30(11H,m),0.92(3H,t)。13C-NMR(126 MHz,CDCl3)δ:180.29(C=O),34.28(C-2),32.1(C-13),30.35 ~28.39(C-4~C-12),24.89(C-3),22.91(C-14),14.33(C-1)。以上数据与文献 [13]基本一致,可以确定化合物8为十五烷酸。
化合物 9:无色针晶,mp 86~88℃,IR(KBr)νmax:3444,2965,2941,2858,1708,1470,1059 cm-1。1H-NMR(500 MHz,MeOD)δ 3.53(tt,J=10.7,3.9 Hz,1H),2.33 ~ 2.15(m,1H),2.01(dd,J=8.5,4.8 Hz,4H),1.56~1.40(m,2H),1.39~1.17(m,2H)。13CNMR(126 MHz,MeOD),179.52(C-1),70.57(C-2),43.53(C-3),35.34(C-4),28.53(C-5)。以上数据与数据库 [14]中2-羟基-3-甲基丁酸报道一致[14]。
化合物10:白色针晶,mp 122~124℃,IR(KBr)νmax:3297,3025,2956,2934,1743,1593,1518,1445 cm-1。13C-NMR(126 MHz,MeOD)δ:179.06(s),156.19(s),130.43(s),127.21(s),115.16(d,J=12.3 Hz),82.08(s),40.05(s),28.30(s),26.66(s)。1H-NMR(500 MHz,MeOD)δ:7.12(2H,d,J=9.0 Hz),6.78(2H,d,J=9.0 Hz)提示对位取代苯的存在。以上数据与数据库中对羟基苯甲酸仲丁酯报道一致[15]。
5.2 单体化学成分MTT细胞活性试验 将不同质量浓度各单体化学成分 (0.1、1.0、5、10、50 μg/mL)以及阳性药物 DEX(10.0 μg/mL)、LPS组 (1.0 μg/mL)、溶剂组 (加入0.1%DMSO培养基)和各质量浓度水提物 (0.3、0.6、1.0、2.3、4.5 μg/mL)刺激24 h后,巨噬细胞活性通过MTT法检测,相比正常组结果如图3所示:各单体成分在0.1~50 μg/mL范围内以及DEX、LPS组、溶剂组 (0.1%DMSO培养基)对RAW264.7细胞的活力均无影响,结果见图3。

图3 不同质量浓度各单体化学成分及水提物和相关试剂对RAW264.7细胞的存活率影响Fig.3 Effects of the isolated chemical compositions and the water extract,adding up to related reagents combining with solvent on RAW264.7 viability
5.3 单体化学成分对RAW264.7细胞上清液中NO因子释放的抑制情况 用LPS刺激RAW264.7细胞可产生大量的NO,模型组细胞上清液中NO产物亚硝酸盐量显著提高,与空白对照组相比有显著性差异 (P<0.01);各单体化学成分的不同剂量在24 h内对细胞上清液中亚硝酸盐量的抑制情况,结果见表1、图4。

表1 各单体化学成分对RAW264.7细胞分泌NO的影响Tab.1 Effect of the chemical compositions on NO secretion in RAW264.7
5.4 各单体化学成分对RAW264.7细胞上清液中TNF-α因子释放的抑制情况 结果显示 LPS 1.0 μg/mL诱导大鼠腹腔巨噬细胞分泌TNF-α,且与空白对照组相比有显著性差异 (P<0.01);不同质量浓度各单体化学成分对LPS诱导的巨噬细胞中TNF-α的分泌的抑制情况见下表2。
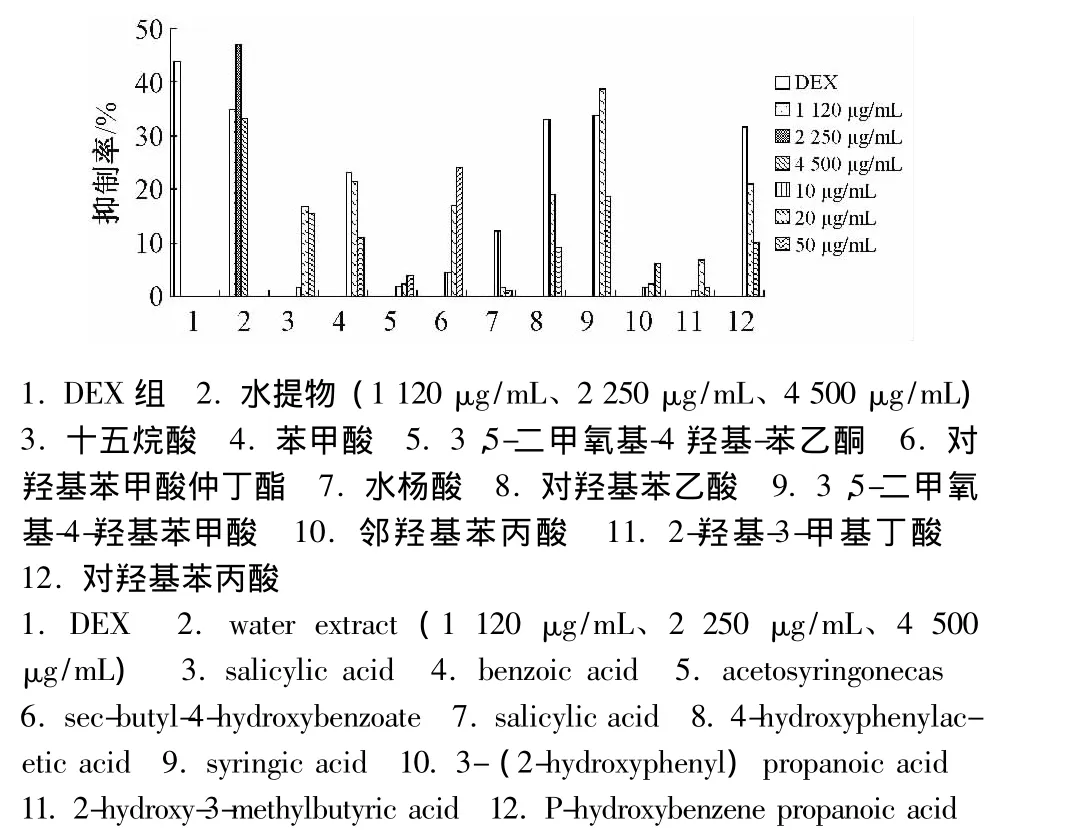
图4 NO抑制率柱状图Fig.4 Histogram of NO inhibition

表2 各单体化学成分对RAW264.7细胞分泌TNF-α的影响Tab.2 Effect of the chemical compositions on TNF-α secretion in RAW264.7
6 讨论
小叶榕叶是岭南常用中草药,始载于《南方草木状》,有着广泛民间用药基础[16]。其乙酸乙酯层具有抗炎药效早有文献报道[2],且经本课题组前期试验研究也证实无误,但深究其抗炎药效的物质基础研究颇少,前期药效研究已筛选出有效部位为乙酸乙酯萃取部位,故本研究采用硅胶柱层析、重结晶等手段从有效部位化学成分群中分离纯化并得到了10个单体成分,并测试了10个单体化合物对巨噬细胞RAW264.7的生长抑制作用以及对RAW264.7细胞中NO和TNF-α代谢的抑制情况。结果显示,各单体成分在0.1~50 μg/mL范围内对细胞的增殖抑制作用情况并无影响,将各单体成分 (高、中、低3个浓度水平)分别刺激LPS诱导的小鼠腹腔巨噬细胞RAW264.7炎症模型,通过检测细胞上清液中释放NO和TNF-α因子的表达发现,与模型组相比较,炎症因子NO的测试结果发现有6个药效显著的单体化合物,分别是苯甲酸、对羟基苯丙酸、3,5-二甲氧基-4-羟基苯甲酸、对羟基苯乙酸、水杨酸、对羟基苯甲酸仲丁酯。其抑制率大小见表1,其中苯甲酸、水杨酸、对羟基苯丙酸存在一定剂量依赖性。此外,采用ELISA试剂盒对该细胞上清液中TNF-α表达情况进行测试发现,利用SPSS统计学软件处理数据,相比较模型组,药效显著的单体成分为苯甲酸、3,5-二甲氧基-4-羟基苯甲酸、对羟基苯乙酸、水杨酸、3,5二甲氧基-4-羟基-苯乙酮、邻羟基苯丙酸。其抑制率大小情况见表2,其中3,5二甲氧基-4-羟基-苯乙酮呈现出较好的剂量依赖性。
中药药效物质基础是指中药进入人体内作用于多个靶点并产生整体功效的化学成分组[17],本研究采用生物活性追踪中药活性成分的分离纯化,最终阐明中药活性成分与药效之间的关联性。实验结果也显示出小叶榕叶发挥药效也具有整体性和多靶标性的特点。该药效物质的发现可为下一步控制小叶榕浸膏的质量标准提供可靠参考,同时也为小叶榕叶发挥抗炎药效的物质基础和作用本质进行揭示。
[1]刘力恒,王立升,王天文,等.小叶榕化学成分及药理活性的研究进展[J].时珍国医国药,2008,19(2):390-392.
[2]戴 臻,李书渊,房志坚,等.HPLC法测定不同采收期小叶榕叶中异牡荆苷的含量[J].广东药学院学报,2008,24(3):231-235.
[3]陈 露,蓝鸣生,王 硕.小叶榕不同提取物的主要药效学研究[J].广西植物,2009,29(6):871-874.
[4]陈艳芬,江 涛,唐春萍,等.小叶榕不同提取物镇咳祛痰作用的比较研究[J].中医药导报,2010,16(7):98-99.
[5]黄肖霄,牛 超,高品一,等.山楂叶的化学成分[J].沈阳药科大学学报,2007,27(8):615-616.
[6]刘岱琳,庞发根,张家欣,等.密花石豆兰的化学成分研究[J].中国药物化学杂志,2005,15(2):104-107.
[7]张卫东,陈万生,孔德云,等.灯盏细辛化学成分的研究[J].中国药学杂志,2000,35(8):514-516.
[8]廖志新,王明奎,彭树林,等.菱叶紫菊的化学成分[J].药学学报,2002,37(1):37-40.
[9]吴 斌,吴立军,张 磊,等.麻叶千里光抗菌化学成分的研究[J].沈阳药科大学学报,2004,21(5):341-345.
[10]王 勇,王 英,王国才,等.舞草的化学成分[J].中国天然药物,2007,5(5):357-359.
[11]王晓良,陈明华,王 芳,等.板蓝根水提取物的化学成分研究[J].中国中药杂志,2013,38(8):1173-1182.
[12]陈 辉,杨立功,郑晓珂,等.蔓生卷柏的化学成分研究[J].天然产物研究与开发,2012,24(7):903-904.
[13]李彦文.小叶榕化学成分和质量标准研究 [D].北京:北京中医药大学,2008:5.
[14]Yamaji T,Saito T,Hayamizu K,et al.National institute of advanced industrial science and technology(AIST)[DB].SpectralDatabase for Organic Compounds, Japan, 2007,SDBS:13307.
[15]Yamaji T,Saito.T,Hayamizu K,et al.National institute of advanced industrial science and technology(AIST) [DB].Spectral Database for Organic Compounds,Japan,2007,SDBS:6930.
[16]李彦文,孙志蓉,李志勇,等.小叶榕镇咳祛痰及抗炎药理作用研究[J].时珍国医国药,2010,21(11):3-4.
[17]陈 梅,赵 鑫,沈 舒,等.中药药效物质基础研究思路与方法概述[J].海峡药学,2010,22(3):11-13.

