党参多糖对实验动物胃肠道功能的影响
马方励,沈雪梅,时 军
(1.无限极(中国)有限公司,广东广州 510665;2.广东药学院中药学院,广东 广州 510006)
党参(Radix Codonopsis)为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.、素花党参Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen或川党参Codonopsis tangshen Oliv.的干燥根,性平味甘,为补气良药,历代医家常替代人参药用。党参具有补气益肺功效,其健脾养胃功效亦很突出,因其健脾而不燥、养胃而不湿,常被用于改善消化类的方剂及保健食品组方中。《本草从新》描述,党参“补中益气,和脾胃除烦渴”。《本草正义》亦有描述,“党参力能补脾养胃,润肺生津,健运中气,本与人参不甚相远。其尤可贵者,则健脾运而不燥,滋胃阴而不湿”[1]。
多糖类成分是党参药材中的重要活性成分,含量达10% ~20%[2]。多糖类成分药理活性明显,如增强免疫功能和超氧化物歧化酶(SOD)活性、降低丙二醛(MDA)的含量、清除超氧和羟自由基、促进脾脏造血等。另外,多糖还可显著降低胃液、胃酸分泌和胃蛋白酶活性[3-4]。然而,关于党参多糖改善消化功能的研究报道较少,笔者从实验动物食物摄取量、体重增加、胃液活力及消化道黏膜切片观察等角度,考察党参多糖对实验动物胃肠道功能的影响,以期阐述党参“健脾益胃”的机制。
1 材料与方法
1.1 材料
1.1.1 药材与试剂 甘肃产党参药材,安徽归然药业有限公司,批号20120318;复方地芬诺酯片,江苏平光制药有限公司,批号1205221;活性炭,天津咸水沽化工有限公司;阿拉伯树胶,天津永大化工有限公司。
1.1.2 实验动物 昆明种雄性小鼠,体重(20±2)g(合格证号SCXK粤2011-0015),南方医科大学实验动物中心;SD雄性大鼠,体重(140±10)g(合格证号SCXK粤2011-0015),南方医科大学实验动物中心。
1.1.3 仪器 海精科YP1002N百分之一电子天平电子分析天平,上海玖梧康德莱一次性注射器、手术器械,测量器具等。
1.2 方法
1.2.1 党参多糖的提取与纯化 取党参药材,60℃烘干,剪碎,以浓度95%乙醇冷浸提取3次,每次12 h。药渣于室温通风处晾干,加水热提取3次,合并滤液,将滤液浓缩成稠浸膏状后,加无水乙醇调整醇浓度至80%后,静置过夜。将提取液过滤,收集沉淀物,即得党参粗多糖。将粗多糖用浓度5%三氯醋酸溶解,离心(3 000 rpm),上清液浓缩成稠浸膏,用无水乙醇洗涤2次,离心(3 000 rpm),留沉淀物。将沉淀物减压干燥,即得精制多糖。按苯酚—硫酸法测定多糖纯度,含量(65.8±2.4)%(n=3),平均得率(19.9±1.9)%(n=3)。
1.2.2 样品溶液的配制 (1)受试样品溶液:称取适量的党参多糖提取物,加水配制成3种浓度(5、10、20 g·L-1)的党参多糖溶液各200 mL,置于冰箱中0~4℃保存,用前水浴加热至40~50℃;(2)四君子汤(实验室自制):将人参、白术、茯苓、炙甘草各10 g,加水煎煮3次,合并滤液,滤液浓缩至200 mL,放凉,置于冰箱中0~4℃保存,灌胃给药前水浴加热至40~50℃;(3)活性炭混悬液:称取阿拉伯树胶100 g,加水750 mL,煮沸至溶液呈透明,活性炭粉碎成细粉,称取50 g,加至上述溶液中煮沸3次,溶液放凉后加水定容到1 000 mL。0~4℃保存,用前摇匀;(4)复方地芬诺酯混悬液:取复方地芬诺酯片(每片2.5 mg)10片,研碎后加水至100 mL,临用前配制。
1.2.3 试验动物分组与给药 (1)大鼠试验组,共50只。设党参多糖3个剂量组 (50、100、200 mg·kg-1),空白组,阳性对照组(四君子汤浓缩液,7.5 mL·kg-1),每组10只。每日灌胃给药1次,空白组按同体积给予试验用水,试验期间自由进食;(2)小鼠试验组,共60只。设党参多糖3个剂量组(100、200、400 mg·kg-1)、空白组、阳性对照组(四君子汤浓缩液,15 mL·kg-1),模型对照组,每组10只。每日灌胃给药1次,空白组和模型对照组按同体积给予试验用水,试验期间自由进食。
1.2.4 大鼠体重、体重增重、摄食量和食物利用率[5]连续给药30 d,每周测体重和食物摄入量,计算食物利用率(见公式1)。

1.2.5 小鼠小肠运动试验[6]连续给药20 d,结束给药后禁食不禁水24 h,给予各给药组、空白组及模型对照组一次受试样品或蒸馏水,30 min后各给药组和模型对照组按剂量5 mg·kg-1给予复方地芬诺酯(制成0.05 g/100 mL混悬液),空白组给予蒸馏水,30 min后各组按10 mg·kg-1剂量给予指示剂(含5%的活性炭粉、10%阿拉伯树胶)。
25 min后断颈处死动物,解剖分离肠系膜,取出幽门(上端)至回盲部(下端)小肠管,测量小肠总长度及墨汁推进长度(幽门至墨汁前沿)。计算炭末推进比P(见公式2)及炭末推进率(见公式3)。
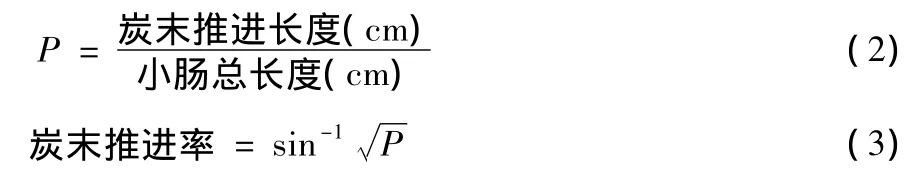
1.2.6 消化酶测定 受试试验大鼠与1.2.4项同为一组,末次给予受试样品后,大鼠禁食不禁水16 h。乙醚麻醉后,结扎大鼠幽门,收集2 h内排出的胃液,测定单位时间内胃液量。取胃液1 mL,加入0.05 mol·L-1盐酸溶液15 mL摇匀,放入新鲜制作的蛋白管两根。塞好瓶口,37℃恒温孵育24 h,取出蛋白管,用尺测量蛋白管两端透明部分的长度(mm),以四端之值求其平均值。计算胃蛋白酶活性(见公式4)和胃蛋白酶排出量(见公式5)。

1.2.7 胃肠切片制片及观察 连续给药30 d,结束给药后禁食不禁水24 h,腹腔注射乌来糖(剂量1.5 g·kg-1),麻醉后在无菌条件下取大鼠胃、十二指肠、空肠组织,经福尔马林(浓度10%)固定,24 h后常规石蜡包埋,4 mm厚连续切片,苏木素—伊红(HE)染色,光镜观察微黏膜表面特征及变化,摄片。
1.3 数据处理 采用SPSS 12.0软件进行统计分析,进行组间方差分析。若各组方差齐,采用单因素方差分析法(one way-ANOVA),以α=0.05为检验水准,采用LSD法进行各剂量组与对照组之间的均数比较;若方差齐性不能满足,采用Tamhane's T2法统计。
2 结果
2.1 大鼠体重、体重增重、摄食量和食物利用率试验
2.1.1 党参多糖对大鼠体重的影响 从第1周开始,党参多糖高剂量组大鼠体重均显著高于空白组(P<0.05或P<0.01);观察期末,中、高剂量组大鼠体重显著高于空白组 (P<0.05),与阳性对照组无差异。中剂量组、高剂量组大鼠总体重增长显著高于空白组(P<0.01),见表1。
2.1.2 党参多糖对大鼠摄食量的影响 第2周大鼠的摄食量明显增加,与空白组相比,党参多糖高剂量组摄食量均显著增加(P<0.01)。中、高剂量组总摄食量与空白组比较,差异有显著性 (P<0.05),见表 2。
表1 党参多糖对大鼠体重的影响(±s,n=10)
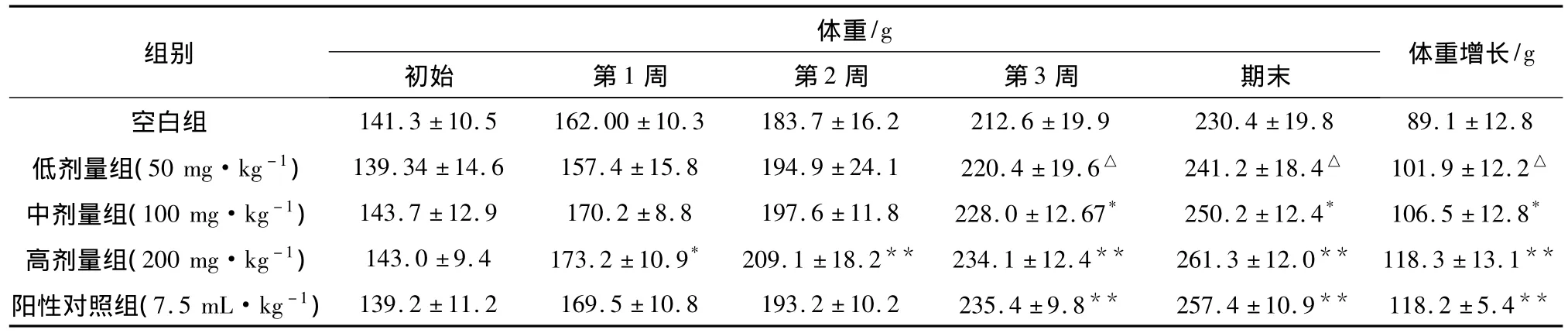
表1 党参多糖对大鼠体重的影响(±s,n=10)
注:与空白组比较,*P <0.05,**P <0.01;与阳性对照组比较,△P <0.05;△△P<0.01。
.9 230.4±19.8 89.1±12.8低剂量组(50 mg·kg-1) 139.34±14.6 157.4±15.8 194.9±24.1 220.4±19.6△ 241.2±18.4△ 101.9±12.2△中剂量组(100 mg·kg-1) 143.7±12.9 170.2±8.8 197.6±11.8 228.0±12.67* 250.2±12.4* 106.5±12.8*高剂量组(200 mg·kg-1) 143.0±9.4 173.2±10.9* 209.1±18.2** 234.1±12.4** 261.3±12.0** 118.3±13.1**阳性对照组(7.5 mL·kg-1) 139.2±11.2 169.5±10.8 193.2±10.2 235.4±9.8** 257.4±10.9** 118.2±5.4/g空白组 141.3±10.5 162.00±10.3 183.7±16.2 212.6±19组别 体重/g初始 第1周 第2周 第3周 期末 体重增长**
表2 党参多糖对大鼠摄食量的影响(±s,n=10)
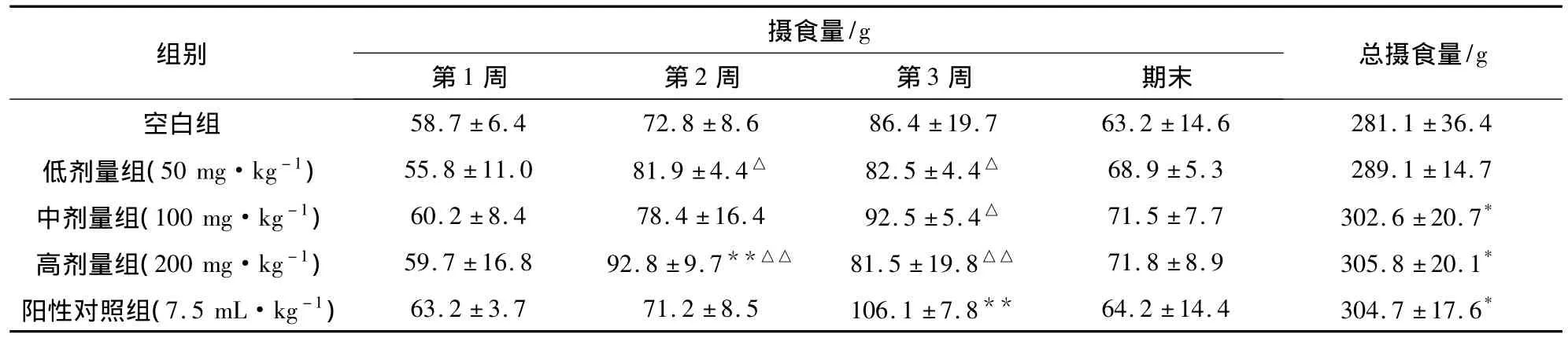
表2 党参多糖对大鼠摄食量的影响(±s,n=10)
注:与空白组比较,*P <0.05,**P <0.01;与阳性对照组比较,△P <0.05;△△P<0.01。
±36.4低剂量组(50 mg·kg-1) 55.8±11.0 81.9±4.4△ 82.5±4.4△ 68.9±5.3 289.1±14.7中剂量组(100 mg·kg-1) 60.2±8.4 78.4±16.4 92.5±5.4△ 71.5±7.7 302.6±20.7*高剂量组(200 mg·kg-1) 59.7±16.8 92.8±9.7**△△ 81.5±19.8△△ 71.8±8.9 305.8±20.1*阳性对照组(7.5 mL·kg-1) 63.2±3.7 71.2±8.5 106.1±7.8** 64.2±14.4 304.7±17.6/g空白组 58.7±6.4 72.8±8.6 86.4±19.7 63.2±14.6 281.1组别 摄食量/g第1周 第2周 第3周 期末 总摄食量*
2.1.3 党参多糖对食物利用率的影响 党参多糖具有一定程度的增加食物利用率作用。与空白组相比,党参多糖高剂量组食物总利用率较大,与阳性对照组相当(P<0.01);高剂量试验组显著高于空白组,见表3。
2.2 小肠运动试验 模型组小肠推进率明显低于空白组(P<0.01),表明便秘模型建立成功。各剂量组小鼠小肠炭末推进率明显高于模型组,其中中剂量组、高剂量组与阳性对照组相当,与模型组比较,有显著统计学差异(P<0.01)。说明党参多糖对复方地芬诺酯引起的小肠推进降低有改善作用,见表4。
2.3 大鼠消化酶测定结果 党参多糖可明显提高胃蛋白酶活力及胃蛋白酶排出量,其中高剂量组极为显著(P<0.01),见表5。
2.4 大鼠胃肠病理切片观察结果 党参多糖各剂量组,相对于空白组大鼠,大鼠的胃黏膜及胃壁均有不同程度的增厚,微绒毛增大;桔红色胃黏膜上下两侧分别被覆复层扁平上皮和单层柱状上皮,黏膜交界处的组织致密,深方的环层肌增厚。党参多糖各剂量组,十二指肠及空肠的肠绒毛平均面积均有不同程度增大。中、高剂量组与阳性对照组比较无明显差异,见图1~3。
表3 党参多糖对食物利用率的影响(±s,n=10)
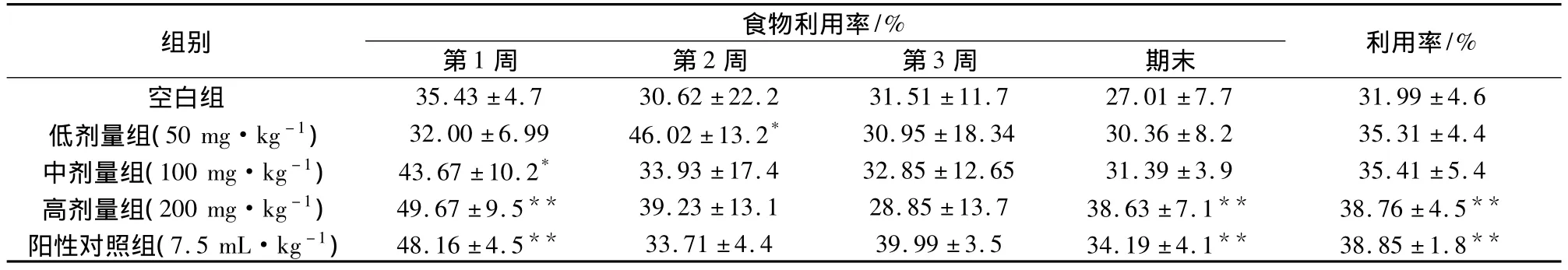
表3 党参多糖对食物利用率的影响(±s,n=10)
注:与空白组比较,*P <0.05,**P <0.01。
1.99±4.6低剂量组(50 mg·kg-1) 32.00±6.99 46.02±13.2* 30.95±18.34 30.36±8.2 35.31±4.4中剂量组(100 mg·kg-1) 43.67±10.2* 33.93±17.4 32.85±12.65 31.39±3.9 35.41±5.4高剂量组(200 mg·kg-1) 49.67±9.5** 39.23±13.1 28.85±13.7 38.63±7.1** 38.76±4.5**阳性对照组(7.5 mL·kg-1) 48.16±4.5** 33.71±4.4 39.99±3.5 34.19±4.1** 38.85±1.8/%空白组 35.43±4.7 30.62±22.2 31.51±11.7 27.01±7.7 3组别 食物利用率/%第1周 第2周 第3周 期末 利用率**
表4 党参多糖对小鼠炭末推进率的影响(±s,n=10)
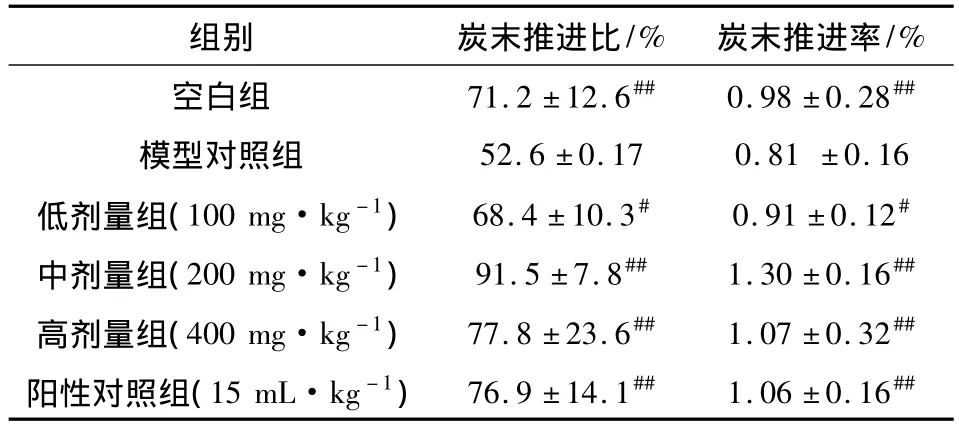
表4 党参多糖对小鼠炭末推进率的影响(±s,n=10)
注:与模型组比较,#P <0.05,##P <0.01。
/%空白组 71.2±12.6## 0.98±0.28组别 炭末推进比/% 炭末推进率##模型对照组 52.6±0.17 0.81±0.16低剂量组(100 mg·kg-1) 68.4±10.3# 0.91±0.12#中剂量组(200 mg·kg-1) 91.5±7.8## 1.30±0.16##高剂量组(400 mg·kg-1) 77.8±23.6## 1.07±0.32##阳性对照组(15 mL·kg-1) 76.9±14.1## 1.06±0.16##
表5 党参多糖对大鼠消化酶的影响(±s,n=10)
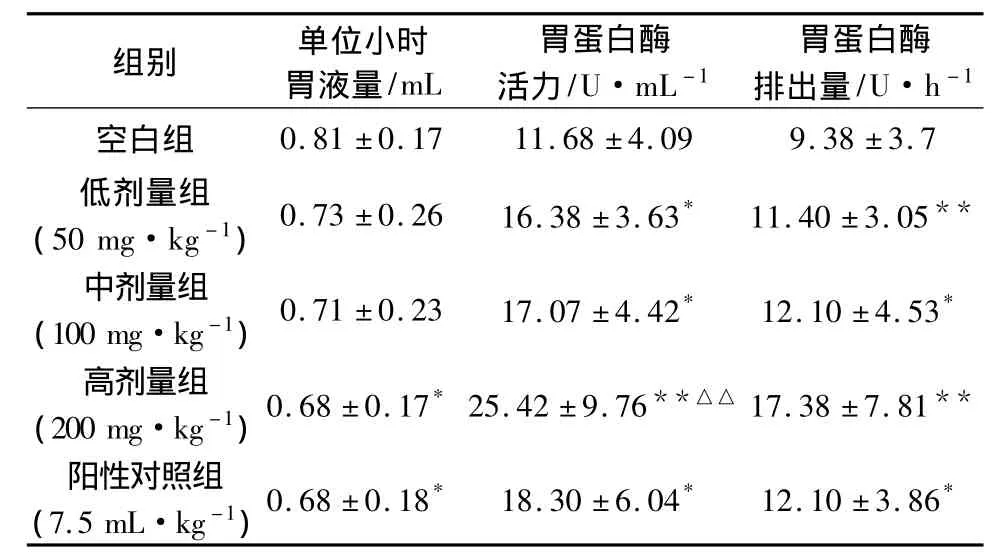
表5 党参多糖对大鼠消化酶的影响(±s,n=10)
注:与空白组比较,*P<0.05,**P<0.01;与阳性对照组比较,△△P <0.01。
白酶·h -1 3.7.05**(100 mg·kg-1)0.71±0.23 17.07±4.42* 12.10±4.53*高剂量组(200 mg·kg-1)0.68±0.17*25.42±9.76**△△ 17.38±7.81**阳性对照组(7.5 mL·kg-1)0.68±0.18* 18.30±6.04* 12.10±3.86*
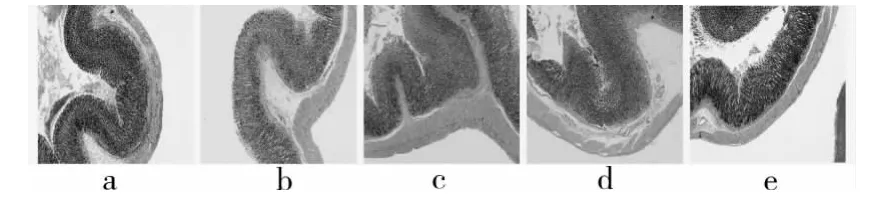
图1 大鼠胃黏膜病理切片(×40)
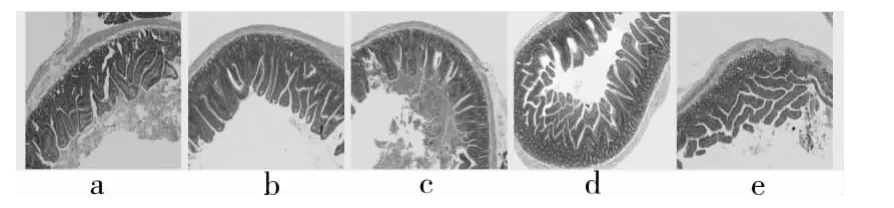
图2 大鼠十二指肠黏膜病理切片(×40)
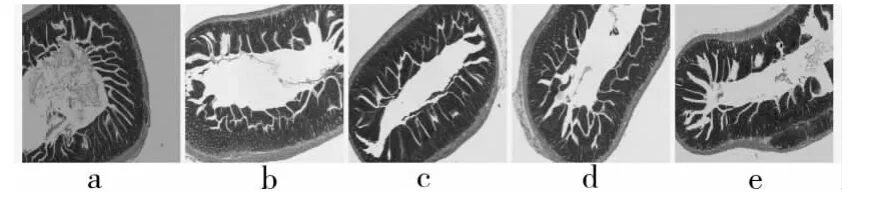
图3 大鼠空肠黏膜病理切片(×40)
3 讨论
消化不良是临床常见症状,在我国城市人口中发生率高达20% ~54%,其发病率随年龄的增长而增加,50~59岁年龄段达到高峰。消化不良主要表现为脾虚,而脾是一个以消化系统为主的多脏器多系统的综合功能单位,脾虚时大量器官会出现基因水平、分子水平、细胞水平的变化,从而引起组织结构和功能的改变,其中消化酶的变化更显突出[9]。
化学药物治疗消化不良,常利用增加胃动力制剂或消化酶制剂,起效迅速,但不能从根源上解决问题,往往引发如过敏反应、口干等不良反应,长期服用还会产生耐药性。一些补虚类中药具有健脾益胃功效,可以显著改善消化不良症状,服用安全、无副作用。党参中多糖含量高达10% ~20%,是党参药材健脾益胃的活性有效部位。动物功效试验表明,党参多糖具有促进消化功能,即增进动物食欲和进食量,提高胃蛋白酶活力及胃蛋白酶排出量,促进小肠蠕动。
20世纪90年代的研究认为,口服多糖类大分子不被肠道吸收,不具有药理活性[7]。但近年来的研究发现,口服多糖可以通过改变胃肠道菌群代谢,从而发挥改善胃肠吸收的作用,这可能与党参多糖含有高度分支结构的糖链、糖链间形成大小不同的环有关[8-9]。如麦冬多糖MDG-1在肠道内分解,主要代谢部位在大肠,肠道内环境及细菌共同作用引起多糖降解,发挥降血糖的活性[10]。
[1] 杨扶德,李成义.党参历代本草考证[J].中国中医药信息杂志,2007,14(2):100-102.
[2] 时 军,马方励,王小燕,等.党参药材中党参炔苷与总多糖、总皂苷含量的相关性研究[J].中华中医药学刊,2011,29(12):1245-1248.
[3] Silva RO,Santana AP,Carvalho NS,et al.A sulfated-polysaccharide fraction from seaweed Gracilaria birdiae prevents naproxen-inducedgastrointestinal damage in rats[J].Mar Drugs,2012,10(12):2618-2633.
[4] Meka VS,Nali SR,Songa AS,et al.Characterization and in vitro drug release studies of a natural polysaccharide Terminalia catappa gum(Badam gum)[J].AAPS Pharm Sci Tech,2012,13(4):1451-1464.
[5] 王叔桥,张丽宏,刘 莉,等.健胃喜食宝片促进消化功能动物试验研究[J].四川医学,2012,33(1):28-30.
[6] 吴经耀,吕圭源.川、浙厚朴缓解小鼠便秘作用的药效比较[J].安徽医药,2012,16(6):732-733.
[7] Song X,Yin Z,Zhao X,et al.Antiviral activity of sulfated Chuanmingshen violaceum polysaccharide against Newcastle disease virus[J].J Gen Virol,2013,94(10):2164-2174.
[8] 任丽靖,张 静,刘志存,等.党参多糖的分离纯化及其结构研究[J].中草药,2008,39(7):986-989.
[9] 宋克玉,江振友,严群超,等.党参及茯苓对小鼠肠道菌群调节作用实验研究[J].中国临床药理学杂志,2011,27(2):142-144.
[10]谢华通,王 硕,阮克峰,等.凝胶色谱法测定麦冬多糖MDG-1在大鼠胃肠道含量变化[J].中国实验方剂学杂志,2012,18(13):139-141.

