射干幼茎愈伤组织及试管苗培养的研究
王晓炜,宋波,姜云清,马晓凯
(1.大连医科大学基础医学院形态实验室,辽宁大连116044;2.大连市结核病医院检验科,辽宁大连116033)
射干(Belamcanda chinensis(L.)DC.)又叫蝴蝶花,为鸢尾科射干属多年生草本植物[1-2],生长于山坡或草地,在我国的吉林、辽宁、西藏、安徽、台湾和云南等地均有分布[3]。射干的根茎和根含鸢尾苷元及射干醛等药用成分[4],中医以射干的根茎作为药用部分,具有消瘀散结、祛痰利咽和清热解毒等功效,能治疗咽喉肿痛、咳嗽痰多、痈肿疮毒、痰壅咳喘以及乳腺炎等疾病[4-5]。射干不仅具有多种人用中药价值,而且其干粉添加在饲料中,定期喂食家畜和家禽,还能减少发病率,降低养殖费用。辽宁南部的部分地区,如长海、丹东、桓仁等地每年都要大量地采收射干根茎出售、药用或做饲料添加成分,使射干的野生资源遭到严重破坏。过去在辽宁南部有射干分布的地区,现已很难看到或采到射干。
目前已有鸢尾科植物组织培养研究的报道[6-7],以及射干幼嫩叶片、茎尖和假茎愈伤组织培养[8-9]和射干试管苗根茎诱导研究的[10]相关文献,但射干幼茎愈伤组织及试管苗培养研究的相关研究未见报道。为保护射干的野生资源,本文对其进行了幼茎愈伤组织及试管苗培养的研究。
1 材料及方法
1.1 材料
选取6月上旬大连英歌石山坡上生长高度为2~3 cm的射干幼茎为本研究材料。
1.2 处理方法
每天1次、连续4 d向植株的表面喷洒浓度为2.5 mg·L-1的庆大霉素溶液,同时也将根部浇透相同的溶液。在第5 d将包括叶片在内的植株地上部分采回实验室后剥掉叶片,将幼茎放到200~250 mL的磨口广口瓶中,在无菌环境中用70%乙醇与0.25 mg·L-1HgCl3的混合灭菌溶液摇晃灭菌10 min后,用无菌水洗涤7次,即可获得作为实验材料的射干无菌幼茎。处理方法参见李慧等的研究[11]。
1.3 实验方法
1.3.1 幼茎愈伤组织诱导培养
在超净台上,用手术刀将无菌幼茎切成长约0.4 cm的幼茎段,再用枪状镊子将幼茎段横半插入愈伤组织培养的固体培养基中。愈伤组织培养的固体培养基是附加琼脂5.3 g·L-1、蔗糖38 g·L-1的MS为基本培养基,并采用不同浓度的人工生长素2,4-D和人工细胞分裂素6-BA的正交试验模式,进行2,4-D和6-BA对幼茎段愈伤组织诱导培养的影响实验。重复2次,每种培养基接种45个形态与大小几乎一致的幼茎段。
1.3.2 幼茎段愈伤组织分化培养
把在 MS+琼脂5.3 g·L-1+蔗糖38 g·L-1+2,4-D 2.2 mg·L-1+ZT 0.8 mg·L-1培养基上培养63 d的嫩绿色愈伤组织,用接种铲分切成0.3 cm左右的块状,接种到以附加琼脂5.3 g·L-1、蔗糖42 g·L-1和NAA 0.05 mg·L-1的1/2MS 为基本培养基,再附加浓度分别为 0、0.7、1.4、2.1、2.8 mg·L-1的细胞分裂素KT、ZT、6-BA的培养基上,放到光照强度250 Lx(以下简称弱光照)和4 000 Lx(以下简称强光照)的不同光照条件下培养,进行不同光照条件、不同浓度细胞分裂素对愈伤组织分化生长的影响实验。实验重复3次,各种处理条件均接种40块愈伤组织。
1.3.3 无根苗生根培养
把在1/2MS+琼脂 5.3 g·L-1+蔗糖 42 g·L-1+NAA 0.05 mg·L-1+6-BA 1.4 mg·L-1培养基上培养生长的无根苗从愈伤组织块上剪下,把下部剪口插到以1/4MS+蔗糖10 g·L-1+琼脂5.3 g·L-1+IBA 0.05 mg·L-1为基本培养基、附加浓度分别为 0.25、0.50、0.75、1.0 mg·L-1的 ABT2 号、2,4-D、NAA 和 IAA 4种生根剂的培养基上,进行不同种类、不同浓度生根剂对试管苗培养的影响实验。实验重复了3次,每次实验每种培养基都以60个无根苗为材料。
1.3.4 炼苗、移栽与定植
把在1/4MS+蔗糖10 g·L-1+琼脂5.3 g·L-1+IBA 0.05 mg·L-1+IAA 0.25mg·L-1培养基上培养25~30 d、生长旺盛的试管苗培养瓶瓶口敞开,在光照强度4 500 Lx左右的温室中炼苗3~4 d,移栽到上层为5~8 cm厚河沙的营养钵中。共进行了3次移栽试验,移栽的试管苗分别为54、57和54株。
把在营养钵中移栽的149株成活苗,6月12日一次性定植到大连旅顺英歌石山坡上。
2 结果
2.1 不同浓度人工生长调节剂2,4-D和6-BA对幼茎段愈伤组织生长的影响
幼茎段培养至第63 d时的观察结果由表1显示。培养基中加入了浓度为2.4 和3.2 mg·L-1的6-BA 与浓度为1.1、2.2 和3.3 mg·L-1的2,4-D 配合使用时,愈伤组织均不能生长;而在浓度为0.8和1.6 mg·L-16-BA,分别与浓度为1.1、2.2和3.3 mg·L-1的2,4-D配合使用时,培养的幼茎段都能诱导生长出愈伤组织,其诱导生长率分别为37.8%、91.1%和71.1%。从诱导率和愈伤组织的长势这 2项指标上看,在 2,4-D的浓度为 2.2 mg·L-1、6-BA的浓度为0.8 mg·L-1组合的培养基上,不仅愈伤组织诱导率达到91.1%,而且外观长势较好。对整个培养过程中的观察还证明,在2,4-D的浓度为2.2 mg·L-1、6-BA的浓度为0.8 mg·L-1的人工生长调节剂组合的培养基上,愈伤组织的生长时间较早,在第9 d就能看到有的培养幼茎段切口处诱导生长出愈伤组织;在20~50 d期间愈伤组织生长速度最快;培养到60 d时,诱导生长出愈伤组织的幼茎段就会形成由很多直径为0.15~0.32 cm的颗粒组成、平均直径为2.1 cm的半球形绿色愈伤组织(见图1)。重复实验与初次实验的结果一致。以上培养结果说明,2,4-D的浓度为2.2 mg·L-1、6-BA的浓度为0.8 mg·L-1的生长调节剂组合适宜于射干幼茎段愈伤组织的培养,射干幼茎段培养愈伤组织的适宜培养基是 MS+琼脂5.3 g·L-1+蔗糖38 g·L-1+2,4-D 2.2 mg·L-1+6-BA 0.8 mg·L-1。
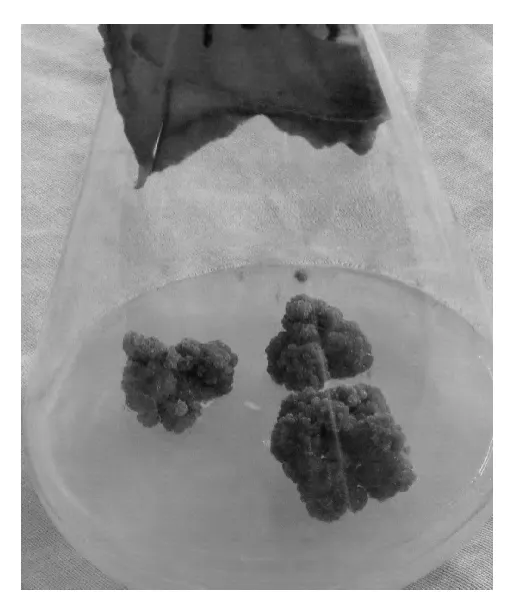
图1 由嫩茎诱导培养的愈伤组织Fig.1 The callus induced by tender stem culture
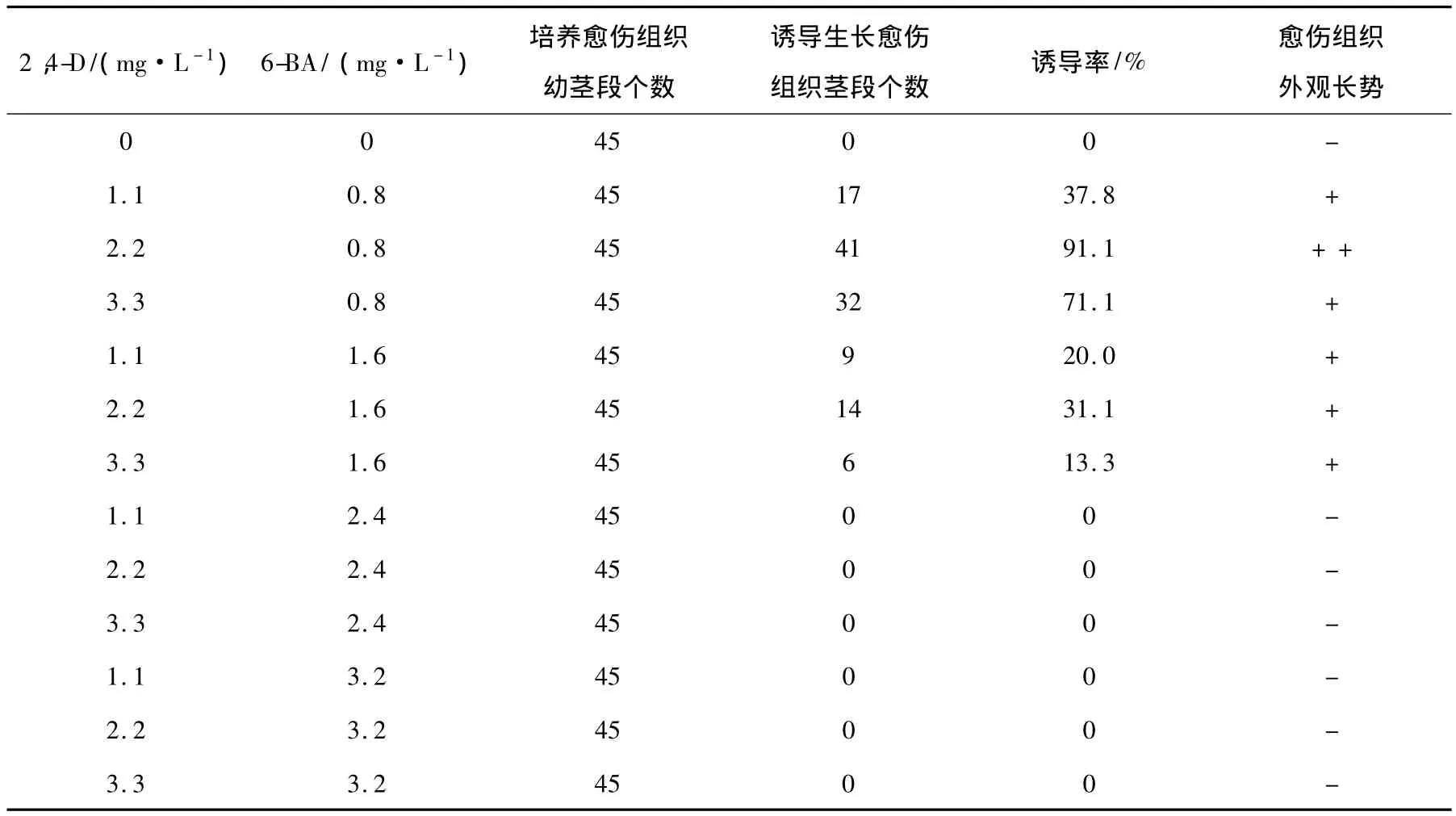
表1 不同浓度人工生长调节剂2,4-D和6-BA对幼茎段愈伤组织诱导培养的影响Table 1 Impacts of different concentrations artificial growth regulators,2,4-D and 6-BA,on callus culture of the younger stems
2.2 不同光照条件、不同浓度细胞分裂素对块状愈伤组织分化培养的影响
培养至56 d时统计结果证明,弱光条件下培养的愈伤组织不分化,而在强光条件下,培养基中加入了KT、ZT 2种不同浓度细胞分裂素,培养的愈伤组织也不分化。只有在强光条件下、培养基中加入了6-BA这一细胞分裂素的条件下,培养的愈伤组织才能分化。由表2可见,4种6-BA浓度条件下,培养的愈伤组织块都能分化。其中在浓度为1.4 mg·L-16-BA培养基上,愈伤组织块分化效果最好。不仅分化生长的无根苗长势旺盛,而且分化率最高(92.5%)、无根苗平均高度最高(1.6 cm)。观察还证明,在6-BA浓度为1.4 mg·L-1的培养基上,培养到11 d时在嫩绿色愈伤组织块的上部就分化生长出可见无根苗,并且随着培养期延长,分化的无根苗数不断地增加。培养到50~56 d时,每块培养的愈伤组织均会分化生长出多个无根苗,外观上出现每块愈伤组织上生长着一丛无根苗的状态。3次重复实验的结果几近一致。由此说明,浓度为1.4 mg·L-1的6-BA适于射干幼茎段愈伤组织的分化培养,射干幼茎段愈伤组织分化无根苗培养的适宜培养基是 1/2MS+琼脂5.3 g·L-1+蔗糖42 g·L-1+NAA 0.05 mg·L-1+6-BA 1.4 mg·L-1。
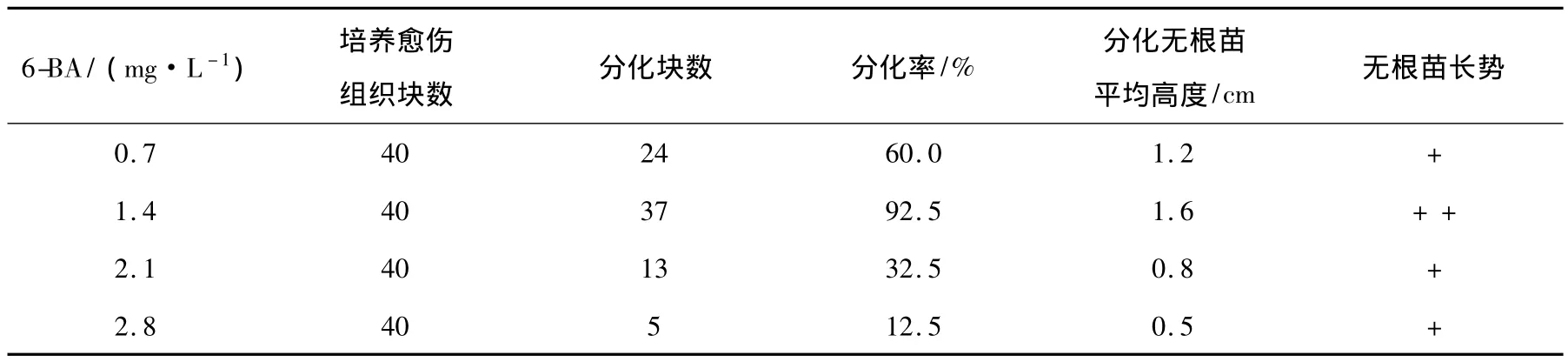
表2 不同浓度6-BA对块状愈伤组织分化无根苗培养的影响Table 2 Impacts of different concentrations 6-BA on rootless seedling culture of block callus differentiation
2.3 不同生根剂对试管苗培养的影响
3次无根苗的生根实验都培养至30 d时统计的结果显示,在附加不同浓度ABT2号、2,4-D、NAA 3种生根剂的培养基上,培养的无根苗均不生根。而在附加IAA这种生根剂的培养基上,4种浓度的处理均可不同程度地生根生长为试管苗(见表3)。由表3可见,在附加浓度为0.25 mg·L-1的培养基上生根效果最好。3次实验接种培养的180个无根苗,生根生长为试管苗的为165株,其生根率为91.7%,每株试管苗平均生根5.3条、株高3.6 cm。与其他3种浓度的培养基相比,在这种浓度的培养基上培养的试管苗的长势也是最旺盛的。以上结果证明,射干幼茎段愈伤组织分化无根苗生根培养的适宜培养基是1/4MS+蔗糖10 g·L-1+琼脂 5.3 g·L-1+IBA 0.05 mg·L-1+IAA 0.25 mg·L-1。
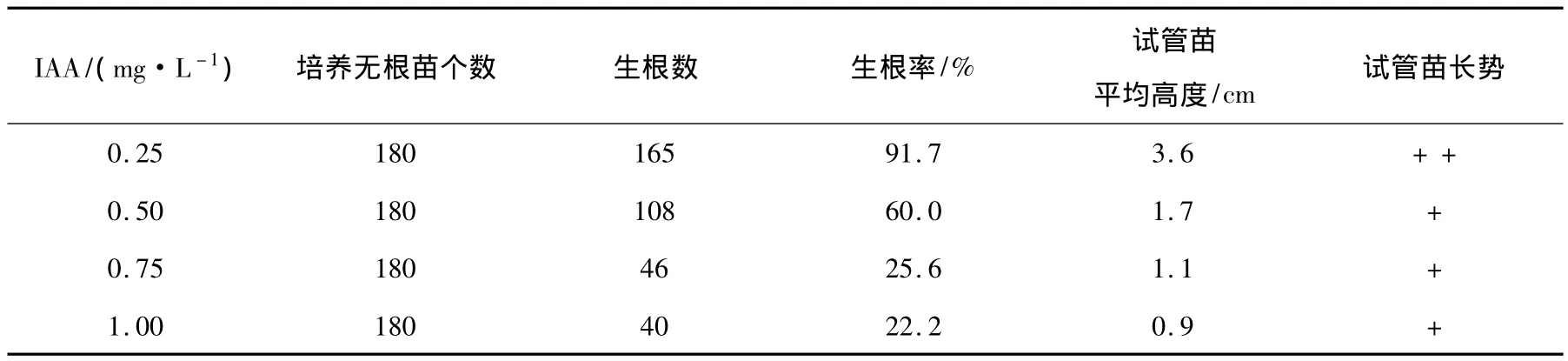
表3 不同浓度IAA对无根苗生根培养的影响实验(3次实验平均结果)Table 3 Impacts of different concentrations IAA on rootless growth and test-tube seedling culture
2.4 生根苗的移栽与定植
3次共移栽165株,成活149株,成活率为90.3%。
定植后48 d统计观察,成活了143株,定植成活率为96.0%。定植成活的试管苗与野生的射干植株相比,除了当年表现为植株整齐、叶色更绿外,其他植物学性状与野生植株无不同。第二年8月中旬开花,9月中旬结果。
3 讨论
目前已有的以植物幼茎为材料进行组织培养研究的报道[12-13],其研究结果大都限于诱导培养出愈伤组织。本研究以射干幼茎为材料,不仅成功地诱导并培养了嫩绿色的愈伤组织,而且分化培养出无根苗,并培养出射干试管苗。幼茎较易诱导培养出愈伤组织并生长出正常的试管苗,这不仅与本研究探索出较理想的培养基及培养技术有关,而且也与幼茎本身正处于分化状态,具有较多的分生细胞有关。
在本研究中,定植于大连旅顺英歌石山坡上的射干试管苗完全保持了野生射干的植物学性状也证明,由幼茎愈伤组织培养的试管苗,可作为射干野生资源保护的一条有效途径,也为射干的人工药用栽培的种苗提供了新来源。
本研究显示,在植物组织培养研究中,对愈伤诱导、分化和生根的影响因素,除了光照、温度等环境因素外,能否达到理想的研究结果,重要的影响因素是培养基,而其中最重要的是生长调节剂的种类及浓度配比。本文的研究结果与前人的研究基本一致[14]。
在本研究中,愈伤组织诱导培养基中的蔗糖含量为蔗糖38 g·L-1,愈伤组织分化培养基的蔗糖含量为42 g·L-1,而试管苗培养的蔗糖含量为10 g·L-1。诱导培养和分化培养的材料本身没有可以大量吸收营养的器官根系,只能依赖于从接触与材料的培养基上吸收一部分蔗糖,加之材料自身光合作用也较差,因此培养中必须加入较高浓度的蔗糖。相反,把无根苗培养成试管苗,不仅试管苗本身具有根系能吸收大量的蔗糖等营养,而且培养初期使无根苗处于饥饿状态更有利于使其生根生长为试管苗。
[1]中国科学院中国植物志编辑委员会.中国植物志第十六卷第一分册[M].北京:科学出版社,1985:131-133.
[2]中国科学院植物研究所.中国高等植物图鉴第五册[M].北京:科学技术出版社,1983:570-570.
[3]李书心.辽宁植物志下册[M].沈阳:辽宁科学技术出版社,1991:772-773.
[4]南京中医药大学.中药大辞典下册[M].上海:上海科学技术出版社,2006:2657-2660.
[5]冯景刚,颜廷林.辽宁常见中草药图说[M].沈阳:辽宁科学技术出版社,2013:208-209.
[6]廖林楠,孙萍,徐香玲.唐菖蒲组织培养初探[J].哈尔滨师范大学:自然科学学报,2005,21(2):84-86.
[7]刘孟颖,高洋,于世达,等.马蔺的组织培养及无性系建立研究[J].辽宁农业科学,2007(6):4-6.
[8]张慧英,薛延军,张耀华,等.射干叶片愈伤组织诱导及植株再生研究[J].中药材,2010,33(2):176-178.
[9]方绪凤.道地药材射干愈伤组织诱导及其分化的研究[D].武汉:华中科技大学,2007.
[10]张耀华,张慧英,薛艳霞.射干试管苗根茎诱导研究[J].中草药,2008,39(6):910-913.
[11]李慧,夏鸿飞,王晓旭,等.皱叶酸模愈伤组织培养及大黄素的分析[J].延边大学学报:自然科学版,2012,38(4):296-300.
[12]曹彬,孙占育,张德仓.大叶黄杨幼茎愈伤组织诱导的研究初报[J].中国农学通报,2008,24(8):131-135.
[13]李琰,张朝红,崔宏安.激素对杜仲幼茎愈伤组织诱导及生长的影响[J].西北农林科技大学学报:自然科学版,2004,32(1):57-60.
[14]安利佳,姜长阳.植物组织培养导论[M].大连:辽宁师范大学出版社,1996:43-52.

