龙葵果花色苷降解动力学
腾 飞, 刘召君, 郑洪亮, 王 萍
(东北林业大学 林学院,黑龙江 哈尔滨150040)
龙 葵 (Solanum nigrum L.) 为 茄 科 茄 属(Solanaceae)一年生草本植物[1],俗称黑星星、野葡萄、苦葵等,常见于路边、田间、荒地,植株高约30~60 cm。国内外大量研究表明,龙葵具有抗肿瘤、抗菌和抗病毒、调节神经和内分泌的作用[2],是很有开发潜力的植物资源。此外龙葵果实富含丰富的色素,易被提取,用龙葵色素代替合成色素添加到饮料或果酒中呈美丽鲜艳的玫瑰红色,并且安全性极高,是一种很有前途的天然食用色素,但作为食品添加剂的天然色素稳定性较差,主要是对热光等不稳定,因此如何提高天然色素的稳定性,成为食品着色工业急待解决的问题[3]。龙葵色素的研究起步较晚,目前已开展了一些该色素提取及稳定性方面的研究。木合塔尔·吐尔[4]等人研究了戈壁野生龙葵果紫红色素提取和理化性质,得出该色素在酸性条件下具有较好的稳定性,并且对光、热和常用食品添加剂都比较稳定,是一种价廉易得,安全可靠,使用方便的天然植物色素。刘良[5]等人研究了酸、二氧化碳、甜味剂、羧甲基纤维素等化学因素对龙葵色素稳定性影响,得出龙葵色素的水,乙醇溶液随酸度的增大颜色加深、稳定性增强,其水溶液对酸、二氧化碳、甜味剂、羧甲基纤维素等化学因素的影响有较好的稳定性。徐雅琴[6]等人对龙葵红色素的理化性质进行了研究,结果表明,pH值对该色素的影响非常显著,当pH<3.0时色素液为红色,且pH愈小,红色愈深;pH在3.0~10.0范围内色素液接近无色;pH大于10.0呈黄色,且pH愈大,黄色愈深。刘志明[7-8]等人研究了温度对龙葵红色素降解的影响以及空气、光照和金属离子对其稳定性的影响,结果表明,龙葵红色素热降解属于一级动力学反应,降解反应的半衰期随温度的升高指数性降低,反应速率常数则指数性增大,长时间的光照和接触氧气将对色素产生不利影响,Na+、Ca2+对其颜色有增强作用,而Fe3+则对色素结构有破坏作用。然而刘志明等人仅研究了温度对龙葵果红色素降解的影响,其他因素并未涉及,因此对龙葵果色素降解的研究还有待进一步探索。作者在已有研究的基础上,进一步探讨了pH和温度对龙葵果花色苷的降解动力学的影响,比较了相同条件下不同龙葵果花色苷提取物的稳定性,建立了龙葵果花色苷热降解动力学模型,为龙葵果的精深加工提供了理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 龙葵果:9月中旬采自哈尔滨双环苗圃。
1.1.2 试剂 盐酸、氢氧化钠、氯化钾、无水乙酸钠、冰乙酸、无水乙醇、正丁醇、柱层析硅胶(200-300目):均为国产分析纯试剂。
1.1.3 仪器 HR2004榨汁机:飞利浦电子香港有限公司;RE-53A旋转蒸发器:上海亚荣生化仪器厂;SHB-4循环水多用真空泵:宁波杜甫仪器厂;722S可见分光光度计:上海精密试验仪器有限公司;PHS-26数显pH计:上海精密试验仪器有限公司;HHS型电热恒温水浴锅:北京博迅实业有限公司医疗设备厂;TDL-5-H台式低速离心机:上海星科科学仪器有限公司;玻璃层析柱(40 cm×1.0 cm):上海精密仪器实业有限公司。
1.2 实验方法
1.2.1 龙葵果花色苷的提取 采用溶剂萃取法,详见文献[9],得到龙葵果花色苷粗提物。
1.2.2 龙葵果花色苷的纯化 以X-5为龙葵果花色苷纯化的吸附介质,纯化条件为:层析柱径长比为1∶25,上样质量浓度为0.4 mg/mL,最大上样量为0.6 BV,洗脱剂体积为 3.5 BV,用 pH 2.0、60%乙醇做洗脱剂,最适洗脱流速为2.0 BV/h。收集洗脱液40℃减压旋转蒸发将溶剂旋出,得到龙葵果花色苷一级精致物。
1.2.3 龙葵果花色苷的分离 称取50.0 g硅胶湿法装柱,湿法上样后用正丁醇∶冰乙酸∶水(体积比4∶1∶0.5)做洗脱剂,收集紫色洗脱液,40℃减压旋转蒸发后得到组分1。再用正丁醇∶乙醇∶盐酸(体积比1∶4∶1)进行二次洗脱,收集红色洗脱液,旋转蒸发后得到组分2。
1.2.4 花色苷相对质量浓度的测定 准确吸取不同样品液0.5 mL,用pH 1.0缓冲溶液 (0.2 mol/L HCl-KCl)和 4.5缓冲溶液(0.2 mol/L HCl-乙酸钠)定容至5.0 mL。达平衡后(pH 1.0为50 min,pH 4.5时为80 min)分别在510、700 nm处测定吸光值[10]。

式中,A 为吸光度,A=(A510nmpH1.0-A700nmpH1.0)-(A510nmpH4.5-A700nmpH4.5);ε 为矢车菊-3-葡萄糖苷的消光系数 (26 900);DF为稀释因子;MW为矢车菊-3-葡萄糖苷的相对分子质量(449.2);L 为光程(1.0cm)。
1.2.5 不同pH龙葵果花色苷提取物溶液的配制用2 mol/L HCl和2 mol/L NaOH溶液将不同龙葵果花色苷样品液的pH值分别调整为1.0、2.0、3.0、4.0、5.0、6.0,用蒸馏水调整为相同的体积后备用,各提取物花色苷初始质量浓度为0.1 mg/mL[11]。
1.2.6 pH和温度对龙葵果花色苷不同提取物降解动力学的解析 分别吸取调整pH值后的不同花色苷提取物溶液装入25.0 mL具塞试管中,旋紧试管盖子后分别放入60、70、80、90℃水浴中避光加热,热处理时间为6 h,期间每隔1小时取出试管放入冰水中急速冷却,测定花色苷的质量浓度和残留率[12]。

式中,C、C0为热处理后和处理前花色苷的质量浓度。根据花色苷残留率,按以下公式计算一级动力学反应的速率常数(k)。

式中,t为热处理时间。
花色苷降解的半衰期(t1/2)用下式计算:

式中,Q10为温度系数,表示温度每升高10℃,反应速率增大的比例数;k1和k2分别为温度t1和t2时的一级反应速率常数。

式中,Z为半衰期(t1/2)变化10倍所需的温度变化(℃)。以T对lg(t1/2)作线性回归,由直线的斜率可得到 Z值[11]。 花色苷热降解活化能 (Ea) 根据Arrhenius方程k=k0e-Ea/RT进行计算。当方程两边同时取对数时,得

式中,k为热降解速率常数;R为气体常数;k0为频率常数;T为温度(K)。可求出花色苷热降解的活化能 Ea(kJ/moL)[13]。
1.2.7 数据分析 试验均重复3次,取其平均值,采用Excel 2010和SPSS11.5进行数据分析。
2 结果与分析

2.1 温度和pH对龙葵果花色苷粗提物降解动力学的影响
2.1.1 温度对龙葵果花色苷粗提物降解动力学的影响 图1表示pH值为1.0~6.0和温度为60~90℃条件下龙葵果花色苷粗提物降解的动力学过程。由图1可知,不同温度条件下-ln(C/C0)与时间呈现良好的线性关系,说明龙葵果花色苷粗提物降解遵循一级反应动力学规律。因此,花色苷的降解应属于裂解反应,即花色苷被裂解为花色素基元及糖基两部分[14]。这与文献[10-13,15]报道的不同来源的花色苷热降解动力学过程研究结果相吻合。

图1 龙葵果花色苷粗提物的降解Fig.1 Degradation of anthocyanins crud extracts from Solanum nigrum L.berry at different pH values during heating
表1表示pH值为 1.0~6.0和温度为60~90℃条件下龙葵果花色苷粗提物降解的动力学参数,结果以(x±s)表示。数据经多因素方差分析,各条件下k值的两两比较采用Bonferroni法。结果表明,各条件除pH 3.0和pH 6.0之间不显著外,其余各条件下k值均达到显著差异(p<0.05)。结合图1和表1可以看出,在pH 1.0~4.0范围内,随着温度的升高,花色苷降解速率加快,残留率明显下降。高温对粗提物稳定性有不良影响,其吸光度值随时间延长而下降,且温度越高,吸光度值下降速率越快。尽管在实验温度范围内,粗提物始终保持澄清,但随着温度的升高及高温时间的延长,色素液的红颜色逐渐变淡。在pH 5.0和pH 6.0时,半衰期t1/2随着温度的升高变化不明显,尤其在80℃和90℃时变化及其微小,t1/2仅减小2%。温度系数Q10表示温度每升高10℃反应速率增大的比例数,Q10越大说明温度对降解的影响越大。Z值表示半衰期(t1/2)变化10倍所需的温度变化,Z值越小说明温度对降解的影响越大。由表1可以看出,pH 5.0和pH 6.0的Q10明显小于其他pH值,Z值明显大于其他pH值。这表明pH 5.0和pH 6.0时温度对花色苷的降解速率影响小于低pH(pH<4.0)对其降解的影响。这与文献[11]中对黑米花色苷降解的研究结果相吻合。

表1 不同pH下龙葵果花色苷粗提物的降解参数Table 1 Degradation parameters of anthocyanin crud extracts from Solanum nigrum L.berries at different pH values

续表1
图2~3分别表示温度与粗提物降解速率常数和半衰期的关系。由图2~3可知,反应速率常数随着温度的升高呈现指数型增大的趋势,半衰期t1/2则呈现指数型减小的趋势。其中pH 1.0~4.0时变化较明显,pH 5.0和pH 6.0时变化趋势不明显。这与文献[7]报道的龙葵红色素降解的研究结果趋势相同。

图2 温度与粗提物降解反应速率常数的关系Fig.2 Relationship between temperature and reaction rate constants of crud extracts

图3 温度与粗提物降解半衰期的关系Fig.3 Relationship between temperature and the half-lifeof crud extracts
2.1.2 pH对龙葵果花色苷粗提物降解动力学的影响 图4和图5分别表示pH与粗提物降解速率常数和半衰期的关系。由图4和图5可知,在60℃和70℃时,随着pH的增大,反应速率常数呈现对数型增大趋势,而半衰期则随着pH的增大呈现指数型减小的趋势。由表1可知,在80℃和90℃时,龙葵果花色苷粗提物的降解随着pH的变化并未呈现规律性的变化,这可能是因为随着温度的升高,花色苷的热降解机制更加复杂[7]。
综合温度和pH对龙葵果花色苷粗提物的影响可以得出,在pH 1.0、温度为60℃时,龙葵果花色苷粗提物的稳定性较好,半衰期为37.27 h,反应活化能为101.47 kJ/mol。将本研究中的龙葵果花色苷降解动力学参数与其他来源的花色苷降解动力学参数相比可知(见表2),龙葵果花色苷的稳定性强于树莓花色苷和蓝靛果花色苷,弱于黑米和草莓花色苷。与其他龙葵果花色苷降解研究的比较中可知,本研究的半衰期和活化能与参考文献[7]中的研究结果较为相似,且比参考文献[7]中的稳定性略强。

图4 pH与粗提物降解反应速率常数的关系Fig.4 Relationship between pH and reaction rateconstants of crud extracts

图5 pH与粗提物降解半衰期的关系Fig.5 Relationship between pH and the half-life of crud extracts

表2 不同来源花色苷降解的动力学参数(pH 1.0、60℃)Table 2 Degradation parameters of different anthocyanins extracts at pH 1.0、60 ℃
2.2 pH和温度对龙葵果花色苷一级精致物降解动力学的影响
2.2.1 温度对龙葵果花色苷一级精制物降解动力学的影响 图6表示pH为1.0~6.0和温度为60~90℃条件下龙葵果花色苷一级精制物降解的动力学过程。


图6 龙葵果花色苷一级精制物的降解Fig.6 Degradation of anthocyanins purified extracts from Solanum nigrum L.berry at different pH values during heating
由图6可知,龙葵果花色苷一级精制物降解同样遵循一级反应动力学方程。这与粗提物的研究结果相吻合。随着热处理时间的延长,龙葵果花色苷一级精制物花色苷质量浓度下降较明显。在pH 1.0~6.0范围内,温度对花色苷一级精制物降解的影响均较明显,这与温度对粗提物的影响略有差别。这说明在pH 1.0~6.0范围内,花色苷一级精制物的降解机制相似,而粗提物的降解机制可能不同。
表3表示pH为1.0~6.0和温度为60~90℃条件下龙葵果花色苷一级精制物降解的动力学参数。各条件下k值差异显著(p<0.05)。图7和图8分别表示温度与龙葵果花色苷一级精制物降解速率常数和半衰期的关系。结合表3、图7和图8可以得出,相同pH时反应速率常数随着温度的升高呈现指数增大的趋势,半衰期t1/2则呈指数型减小的趋势,这与温度对粗提物的降解影响趋势相似。

表3 不同pH下龙葵果花色苷一级精制物的降解参数Table 3 Degradation parameters of anthocyanin purified extracts from Solanum nigrum L.berries at different pH values
2.2.2 pH对龙葵果花色苷一级精制物降解动力学的影响 图9和图10分别表示pH与花色苷一级精制物降解的关系。由图9和图10可知,在60℃和70℃时,随着pH的增大,反应速率常数呈现对数型增大,而半衰期则随着pH值的增大呈现指数型减小的趋势。由表3可知,在80℃和90℃时,龙葵果花色苷一级精制物的降解随着pH的变化并未呈现规律性的变化,这一研究结果与粗提物的结果相同。

图7 温度与一级精制物降解速率常数的关系Fig.7 Relationship between temperature and reaction rate constants of purified extracts

图8 温度与一级精制物降解半衰期的关系Fig.8 Relationship between temperature and the half-life of purified extracts
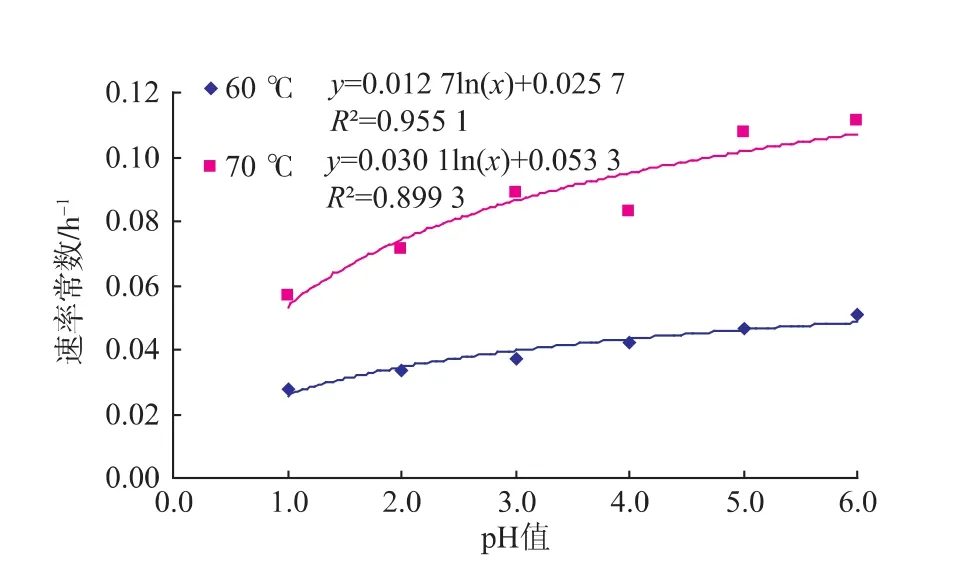
图9 pH与一级精制物降解速率常数的关系Fig.9 Relationship between pH and reaction rate constants of purified extracts

图10 pH与一级精制物降解半衰期的关系Fig.10 Relationship between pH and the half-life of purified extracts
综合温度和pH对龙葵果花色苷一级精制物降解的影响可以得出,在pH 1.0、60℃时,龙葵果花色苷一级精制物的稳定性较好,半衰期为25.30 h,与粗提物的半衰期37.27 h相比减少了32%,反应活化能为87.16 kJ/mol,比粗提物的反应的活化能101.47 kJ/mol减小了14%。说明在相同条件下,龙葵果花色苷粗提物的降解速率较慢,耐热性好,也说明可能是粗提物中其它成分,如糖、酸、酚类物质与色素发生了分子内(花色苷分子内各基团间的相互作用)或分子间(花色苷分子与其它分子间相互作用)的辅色效应(co-pigmentation),形成了更加稳定的结构,这与前人的研究结果一致[18]。
2.3 pH值和温度对龙葵果花色苷组分1和组分2降解动力学的影响
2.3.1 温度对龙葵果花色苷组分1和组分2降解动力学的影响 龙葵果花色苷组分1和组分2降解趋势相似。表4表示pH为1.0~6.0和温度为60~90℃条件下龙葵果花色苷组分1和组分2的降解动力学参数。由表4可知,各条件除pH 1.0和pH 3.0之间不显著外,其余各条件下组分1的k值均达到显著差异(p<0.05),组分2的k值在各条件下均达到显著差异(p<0.05)。龙葵果花色苷组分1和组分2的降解同样遵循一级反应动力学方程。这与粗提物和一级精制物的研究结果相吻合。随着热处理时间的延长,龙葵果花色苷组分1和组分2的花色苷质量浓度明显下降。在pH 1.0~6.0范围内,随着温度的升高,花色苷组分1和组分2的降解速率变化较大,残留率迅速下降,这与一级精制物降解的变化趋势相似。表5是温度与组分1和组分2降解速率常数和半衰期的关系。由表5可以看出,反应速率常数随着温度的升高呈现指数型增大的趋势,而半衰期t1/2则呈现指数型减小的趋势。

表4 不同pH下龙葵果花色苷组分1和组分2的降解参数Table 4 Degradation parameters of fraction 1 and fraction 2 from Solanum nigrum L.berries at different pH values

表5 温度与组分1和组分2降解速率常速和半衰期的关系Table 5 Relationship between temperature and reaction rate constants and half-life of fraction 1 and fraction 2
2.3.2 pH对龙葵果花色苷组分1和组分2降解动力学的影响 表6表示pH与组分1和组分2降解速率常数和半衰期的关系。由表6可知,在60℃和70℃时,随着pH的增大,反应速率常数呈现指数型增大的趋势,而半衰期则随着pH值的增大呈现指数型减小的趋势。这一研究结果与粗提物和一级精制物略有差别。粗提物和一级精制物随着pH的变化速率常数呈现对数型增长,而组分1和组分2则呈现指数型增长。由表4可知,在80℃和90℃时,龙葵果花色苷组分1和组分2的降解随着pH的变化并未呈现规律性的变化,这一研究结果与粗提物和一级精制物的结果相同。

表6 pH与组分1和组分2降解速率常数和半衰期的关系Table 6 Relationship between pH and reaction rate and half-life constants of fraction 1 and fraction 2
综合温度和pH对龙葵果花色苷组分1和组分2降解的影响可以得出,在pH 1.0温度为60℃时,龙葵果花色苷组分1和组分2稳定性较好,组分1半衰期为19.04 h,反应活化能为59.75 kJ/mol,组分2为半衰期为21.46 h,反应活化能为61.91 kJ/mol。由二者半衰期可知,组分2比组分1稳定性强,与粗提物相比,组分1的半衰期减小了48.91%,组分2减小了42.42%;与一级精制物相比,组分1半衰期减小了24.74%,组分2减小了15.18%,从而可知,组分1和组分2的稳定性比粗提物和一级精制物稳定性差。
3 讨论
3.1 pH对花色苷稳定性的影响
以上结果充分说明,pH值对龙葵果花色苷稳定性有较大影响,这是由于在不同pH值介质中,花色苷的分子结构呈现不同形式所致。当pH<2.0时,主要以2-苯基苯并吡喃阳离子(AH+)的形式存在而呈现红色;当pH在4~5时,,主要以醌型碱(B)形式存在,色泽逐渐由红向蓝色变化;而当pH>6.0时,体系的平衡向着无色的查耳酮(C)进行[15]。其降解机制可能有如下两种:在 pH 2.0~4.0的酸性水溶液中,花色苷的C3糖苷首先水解,然后苷元发生水合反应生成花色素的假碱形式,再异构化生成查耳酮及其同分异构体α-二酮[19]。但由于产物中仍然存在查耳酮糖苷,也可能是花色苷首先生成假碱葡萄糖苷,接着开环生成查耳酮糖苷,查耳酮糖苷继续脱去糖苷成为查耳酮和其同分异构体α-二酮,最后彻底降解生成酚酸和醛类[20]。
3.2 温度对花色苷稳定性的影响
在食品加工过程中,最常用的杀菌方式就是高温处理,温度的高低和加热时间的长短都会影响花色苷的降解,其机制为花色苷首先发生水解或去糖基开环反应,然后形成查耳酮或其同分异构体α-二酮,最后降解为酚酸和醛类[14]。Olivier等人认为在花色苷的结构互变中[21],花色苷的二苯基苯并吡喃阳离子(AH+)的失电子过程AH+→A是放热反应,水解反应AH+→B(甲醇假碱)和开环反应B→C(查尔酮)是吸热反应并且伴随着熵的增大。因此,温度升高时,平衡向着无色的甲醇假碱和查尔酮形式转化,并显著影响花色苷的热降解速率[22]。实验中发现,4种花色苷提取物中粗提物在相同pH和温度的条件下降解最慢,最稳定。这是因为在龙葵果花色苷粗提物中存在多酚、黄酮、氨基酸和有机酸等辅色剂。尤其是黄酮和多酚的含量丰富[9]。这些物质与色素发生了分子内或分子间的辅色效应,形成了更加稳定的结构。凌文华[23]等人研究认为在水果和浆果中花色苷更易发生分子间辅色作用,通过分子间上下叠加的π—π共轭作用及一些氢键作用影响原花色苷生色体系的能级跃迁,从而使得花色苷稳定性增强。此外,花色苷属于多酚类物质可作为自身的辅色剂。而黄酮类对花色苷的共色作用主要在于稳定了溶液中紫色的脱水碱阻止其转化成无色的查尔酮结构[24]。然而随着花色苷的不断精制,这些辅色素含量越来越少,辅色作用越来越弱,因此,粗提物的稳定性最强,降解最慢。
4 结语
龙葵果花色苷不同提取物的降解均遵循一级反应动力学规律。pH对粗提物降解的影响为:当pH 1.0~4.0时,温度对其降解的影响显著,而pH 5.0和pH 6.0时,温度对其降解的影响不显著。pH对一级精制物、组分1和组分2的降解影响为:pH 1.0~6.0时,温度对一级精制物、组分1和组分2的降解影响均显著。相同pH值时花色苷不同提取物的降解速率常数随着温度的升高呈现指数型增长的趋势,而半衰期呈现指数型下降的趋势。
60℃和70℃时,随着温度的升高粗提物和一级精制物降解的速率常数呈现对数型增长的趋势,而组分1和组分2的降解速率常数呈现指数型增长的趋势;半衰期则均呈现指数型下降的趋势。而80℃和90℃时,降解速率常数和半衰期随着pH值的变化均未呈现规律性的变化。
通过比较半衰期可知,4种花色苷提取物均在60℃pH、1.0时稳定性最强。4种提取物的稳定性顺序为粗提物>一级精制物>组分2>组分1。
[1]刘为为,刘延庆,戴小军.龙葵抗肿瘤作用的研究进展[J].中药材,2009(3):462-465.LIU Weiwei,LIU Yanqing,DAI Xiaojun.Study on progress of Solanum nigrum L.antitumor effect[J].Traditional Chinese Medicine,2009(3):462-465.(in Chinese)
[2]刘颖,张燕玲,王雁.从天然植物龙葵中提取生物碱的工艺研究[J].辽宁丝绸,2003(2):4-5,31.LIU Ying,ZHANG Yanling,WANG Yan.Process study extracted of alkaloids from Solanum nigrum L[J].Liaoning Silk,2003(2):4-5,31.(in Chinese)
[3]徐雅琴,李淑芹,崔艳丽.龙葵红色素热效应的研究[J].生物技术,1995,5(5):33-35.XU Yaqin,LI Shuqin,CUI Yanli.Study on the therm l effect of red pigment form black night shade[J].Biotechnology,1995,5(5):33-35.(in Chinese)
[4]木合塔尔·吐尔,洪木尼热·阿不都克力木.戈壁野生龙葵果紫红色素的提取及其理化性质研究[J].陕西师范大学学报:自然科学版,2004,32(4):120-121.Muhetaer T H,Munire A B L.Extraction and characteristic of purplish red pigment from Solanum nigrum[J].Journal of Shaanxi Normal University:Natural Science Edition,2004,32(4):120-121.(in Chinese)
[5]刘良,王文兰,王丽君.化学因素对龙葵色素稳定性影响的研究[J].吉林医学院学报,1998,18(1):27-28.LIU Liang,WANG Wenlan,WANG Lijun.The study on the influence of chemical factors on the stability of the pigment of Solanum nigrum[J].J Lin Med Col,1998,18(1):27-28.(in Chinese)
[6]徐雅琴,李桂芝.龙葵红色素理化性质的研究[J].东北农业大学学报,1996,27(4):401-405.XU Yaqin,LI Guizhi.Studies on physical and chemical properties of red pigment from black nightshade[J].Journal of Northeast Agricultural University,1996,27(4):401-405.(in Chinese)
[7]刘志明,李琦,孙清瑞,等.龙葵红色素热降解化学动力学的研究[J].食品工业科技,2006,30(6):308-311.LIU Zhiming,LI Qi,SUN Qingrui,et al.Research on chemical dynamics of the thermal degradation for red pigment of Solanum nigrum[J].Journal of Food Science and Technology,2006,30(6):308-311.(in Chinese)
[8]刘志明,张威威,韩小兰,等.从龙葵果中提取食用红色素及色素稳定性的研究[J].国土与自然资源研究,2006(3):89-90.LIU Zhiming,ZHANG Weiwei,HAN Xiaolan,et al.Extraction of edible red pigment from Solanum nigrum fruit and study on its stability[J].Territory&Natural Resources Study,2006(3):89-90.(in Chinese)
[9]郭庆启,张娜.树莓果汁中花色苷降解动力学的研究[J].中国林副特产,2011(5):35-37.GUO Qingqi,ZHANG Na.Degradation kinetics of anthocyanins in raspberry juice[J].Forest By-Product and Specialty in China,2011(5):35-37.(in Chinese)
[10]HOU Z H,QIN P Y,ZHANG Y.Identification of anthocyanins isolated from black rice (Oryza sativa L.) and their degradation kinetics[J].Food Research International,2013(50):691-697.
[11]Selale K,Emine A E.Thermal degradation kinetics of anthocyanins and visual colour of Urmu mulberry (Morus nigra L.)[J].Journal of Food Engineering,2013,11(6):541-547.
[12]樊金玲,朱文学,巩卫东,等.牡丹花色苷的热稳定性和降解动力学[J].应用化学,2011,27(2):231-236.FAN Jingling,ZHU Wenxue,GONG Weidong,et al.Thermal stability and degradation kinetics of anthocyanin in tree penoy extract[J].Chinese Journal of Applied Chemistry,2011,27(2):231-236.(in Chinese)
[13]宋会歌,刘美艳,董楠,等.食品中花色苷降解机制研究进展[J].食品科学,2011,13:355-359.SONG Huige,LIU Meiyan,DONG Nan,et al.Research progress on degradation mechanisms of anthocyanins in foods[J].Chinese Journal of Food Science,2011,13:355-359.(in Chinese)
[14]郭庆启,张娜,何娇.蓝靛果汁花色苷热降解动力学的研究[J].食品与发酵工业,2011,37(9):74-78.GUO Qingqi,ZHANG Na,HE Jiao.Thermal degradation dynamic of anthocyanins in Lonicera edulis turcz juice[J].Food and Fermentation Industries,2011,37(9):74-78.(in Chinese)
[15]蒋新龙.黑米花色苷降解特性研究[J].中国粮油学报,2013,4:27-31.JIANG Xinlong.Study on black rice anthocyanin degradation characteristics[J].Chinese Cereals and Oils Association,2013,4:27-31.(in Chinese)
[16]王梦泽,阎勤劳,薛少平,等.草莓浑浊汁花色苷热降解动力学[J].食品研究与开发,2010,6:50-53.WANG Mengze,YAN Qinlao,XUE Shaoping,et al.Thermal degradation kinetics of anthocyanin in cloudy strawberry juice[J].Food Research and Development,2010,6:50-53.(in Chinese)
[17]方忠祥,倪元颖,唐建成.紫肉甘薯中花色苷热降解动力学研究[J].食品工业科技,2004,3:111-113.FANG Zhongxiang,NI Yuanying,TANG Jiancheng.Thermal degradation kinetics of anthocyanins from purple-fleshed sweet potato[J].Chinese Journal of Food Science and Technology,2004,3:111-113.(in Chinese)
[18]张丽霞,周剑忠,顾振新.黑莓汁花色苷热降解动力学及降解机理[J].江苏农业学报,2011,27(5):1111-1116.ZHANG Lixia,ZHOU Jianzhong,GU Zhenxin.Degradation kinetics of anthocyanins in blackberry juice and its mechanisms[J].Jiangsu J of Agr Sci,2011,27(5):1111-1116.(in Chinese)
[19]Markakis P.Anthocyanins as food colors[M].San Diego:Academic Press,1982:163-207.
[20]O liver D.Polyphonel interactions the copigmentation case:thermodynamic data form temperature variation and relaxation kinetics[J].Can J Chem,1992,70:2174-2189.
[21]董楠,王强,雷丹丹,等.胭脂萝卜红色素热处理及贮藏过程中降解动力学[J].食品科学,2013,5:67-71.DONG Nan,WAHG Qiang,LEI Dandan,et al.Thermal degradation and kinetics of pigment from raddish red[J].Chinese Journal of Food Science,2013,5:67-71.(in Chinese)
[22]凌文华,郭红辉.植物花色苷[M].北京:科学出版社,2009:66.
[23]李云,赵昶灵,杨晓娜,等.花色苷分子结构与其稳定性以及呈色关系的研究进展[J].云南大学学报,2010,25(5):712-720.LI Yun,ZHAO Xuling,YANG Xiaona,et al.Research advances in the relationship between the molecular structures of anthocyanins and their stability and colorations[J].Journal of Yunnan Agricultural University,2010,25(5):712-720.(in Chinese)

