干热河谷乡土树种清香木幼苗生长对不同水分梯度的响应
王 妍 ,张 超 ,李 昆
(1. 西南林业大学 环境科学与工程学院,云南 昆明 650224;2. 中国林业科学研究院 资源昆虫研究所,云南 昆明 650224)
干热河谷乡土树种清香木幼苗生长对不同水分梯度的响应
王 妍1,张 超1,李 昆2
(1. 西南林业大学 环境科学与工程学院,云南 昆明 650224;2. 中国林业科学研究院 资源昆虫研究所,云南 昆明 650224)
根据土壤的田间持水量设置不同的土壤水分含量梯度,通过对不同梯度下清香木幼苗的株高、叶片性状、生物量以及幼苗生长状态的观测和分析,旨在探讨清香木幼苗在水分缺失及过量的情况下对水分的利用情况及清香木幼苗在不同水分条件下生长的性状,了解幼苗对水分过多或过少胁迫的响应,以期在云南干热河谷地区的植被恢复、清香木的培育种植中能提供一定的理论指导和技术参考。研究结果表明,清香木幼苗期需水量较多,在田间持水量充足的条件下,幼苗生长较好,在相对田间持水量较小的条件下,幼苗虽然较正常水分条件下生长减慢,但仍能生长。研究结果表明,清香木幼苗对极端干旱的耐受性要高于对极端降水,同时随植株的生长,清香木对水分需求的敏感度降低。研究还表明,在不构成胁迫的环境中,幼苗的地上部分生物量的增加明显高于地下部分的生物量的增加,而在水分过多或过少胁迫下幼苗的地下部分生物量的增加会高于地上部分,而且在胁迫强度和胁迫时间的推移下,表现的更为明显,此种适应对策可以帮助幼苗吸收更多的水分和养分,以及减少蒸腾等损耗,从而适应逆境。
清香木;幼苗生长;水分梯度;生物量;比叶面积
清香木Pistacia weinmannifolia是漆树科黄连木属灌木或小乔木,高1~8 m,少见10~20 m,叶片为革质羽状复叶,嫩枝及新叶深红带紫[1-2],耐寒耐旱抗贫瘠,是干热河谷地区独特的乡土树种,在当地环境恢复和改善中有着重要的作用和意义。据调查,目前干热河谷大部分清香木资源处于野生状态,由于乱砍乱伐、火烧以及开荒等人为因素的干扰,分布面积和数量明显减少,限制了其多种价值的发挥。水分胁迫是植物水分亏缺的一种表现,它是影响植物生长发育的主要限制因子,也是干旱、半干旱地区环境变化最主要、最直接的因素之一[3]。干热河谷气候炎热少雨,水土流失严重,生态十分脆弱,而乡土树种对环境的适应性取决于水分供应状况,因此干热河谷地区水分不足及供需时间与植物需求不一致的矛盾表现得尤为突出。水分不足不仅影响清香木的成活率和保存率,限制林木的生长,而且也是一种最普遍影响生态环境建设和作物生产力的环境胁迫[4-7]。本研究主要通过对清香木幼苗的叶片性状、生物量以及幼苗生长状态等的观测和研究,深入理解清香木幼苗在水分缺失及过量的情况下对水分的利用情况,以及认知清香木幼苗在不同水分条件下生长的性状,理解幼苗对水分过多或过少胁迫的响应,以期在云南干热河谷地区的植被恢复、清香木的培育种植中能提供一定的理论指导和技术参考。
1 数据来源与研究方法
1.1 研究区概况
研究区选择位于金沙江河谷的元谋县,地处滇 中 高 原 北 部(101°35′~ 102°06′E、25°23′~26°06′N),气候干燥炎热,光热资源充足,年平均气温21.9℃,极端最高温度42℃,年日照时数2 670.4 h,年平均日照时数7.3 h,日照百分率60%。研究区40%处于海拔1 350 m以下的干热河谷区,区内干旱少雨,年均降雨量仅为616 mm,年蒸发量高达3 627 mm,四季不分明,全年基本无霜,被誉为“天然温室”。
1.2 研究方法
1.2.1 实验材料
实验材料为2011、2012年6月播种的清香木一年生和两年生幼苗,均为当年生新鲜清香木种子营养袋育苗,土壤全部采用当地的红壤,粉碎块状土块,混合均匀,无其他处理。育种前期筛选营养袋内长势好的幼苗,保证每个营养袋保留2株。采用统一的水肥管理,保证幼苗生长健壮、无病虫害、长势基本一致。
1.2.2 实验处理的设置
实验开始于2012年8月初,选取健康、每个营养袋两苗、长势基本一致的清香木幼苗进行分组。随机分为6组,每组48棵幼苗,实验每30天采样一次,共采样6次,每次每组采样8棵,实验开始时进行了一次采样测量,作为生长量的基准。实验以研究区土壤的田间持水量为基准设置水分梯度,共设置如表1所示的6个梯度,实验过程中每2天浇水一次,保持土壤的田间持水量不变。

表 1 浇水量统计Table 1 Statistics of watering quantity
1.2.3 比叶面积的测定
采样时选取生长均匀的清香木幼苗叶片20片。叶片的选取原则是:每组共采20片、每株幼苗采2~3片、选取叶片时完全随机、大小适中。每次采样洗净后,利用游标卡尺测量单个叶片长度和叶中部宽度。由于清香木的叶片为椭圆形,可以近似视为椭圆来测定其表面积,继而可以得出20片叶片表面积之和,比叶面积(SLA)的计算如下式(1)-(2):

式中,S为20片叶片表面积总和,ai为第i片叶片长度,bi为第i片叶片宽度,i=1,2,3,··,20,π取3.14,W为20片叶片样品的干重。
2 结果与分析
2.1 水分胁迫对株高的影响
从图1中可以看出,水分胁迫下幼苗的根生长表现出明显的累积效应,从图中可以看出,在水分充足的状况下,根系的生长较快,要高于正常降水量条件;在降水量只有平时的80%和50%的条件下,根系生长略低于正常水平,但两者之间没有显著差别;在水分极其湿润和极其干燥的条件下,根系几乎无生长量。随着时间变化两年生幼苗的根长也呈现出有规律增长的趋势,在水分充足的条件下生长最为迅速,且随着时间的推移,生长速度较快,远高于其他实验设置组别,水分正常条件下,根系的生长也较为迅速。其他组为基本持平的状态,没有显著差异。

图1 一年生幼苗根长Fig.1 Root length of 1-year-old seedlings under water stress
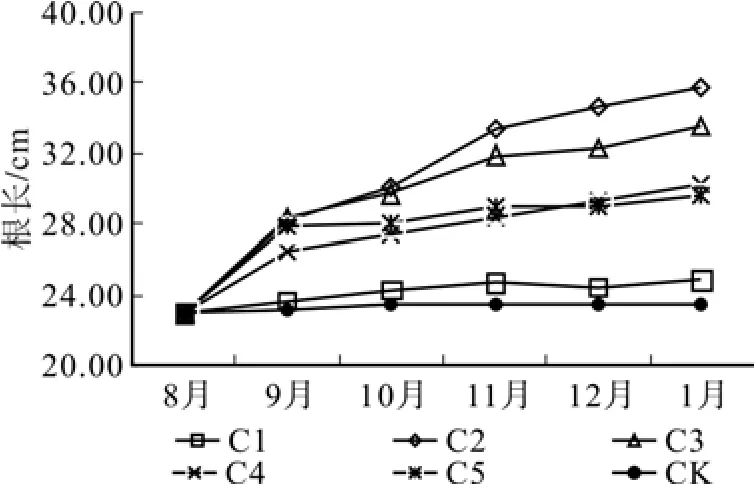
图2 两年生幼苗根长Fig.2 Root length of 2-year-old seedlings under water stress
实验结果表明,随着时间的推移株高也呈有规律的累积增长趋势,其增长趋势与根长变化趋势近似,一年生幼苗在实验结束时,在水分充足条件下地上部分的生长较为迅速,与其他组差异显著;在水分极充足及缺少的条件下没有显著差异。两年生幼苗的地上部分生长与一年生趋势一致,在水分充足的条件下,地上部分的生长较快;在降水量只有平时的80%的条件下,地上部分生长略低于正常水平;在水分极其湿润和极其干燥的条件下,地上部分无生长趋势。

图3 一年生幼苗株高生长率Fig.3 Height growth rate of 1-year-old seedlings under water stress

图4 两年生幼苗株高生长率Fig.4 Height growth rate of 2-year-old seedlings under water stress
图3 和图4为清香木幼苗在水分胁迫下株高(根长与茎高之和)的生长率。从图中可以看出,一年生幼苗在水分充足的条件下生长最快,在水分正常和80%降雨量的条件下差异不显著,但明显高于其余水分条件。两年生幼苗的生长率在水分充足和正常条件下无显著差异,但两组均明显高于其他组。
2.2 水分胁迫对生物量的影响
2.2.1 生物量变化
从地上生物量的实验结果来看,在实验结束时,一年生幼苗的生物量按从大到小为C2>C3>C1>C4>C5>Ck,其中水分充足条件下明显高于其他组,C3、C1、C4和C5差异不显著,Ck显著低于其他组。两年生幼苗生物量从大到小排序为C3>C2>C4>C1>C5>Ck,其中C2和C3没有显著差异,均明显高于其他组,C3、C1、C4和C5组表现出明显的降低趋势,且差异显著。
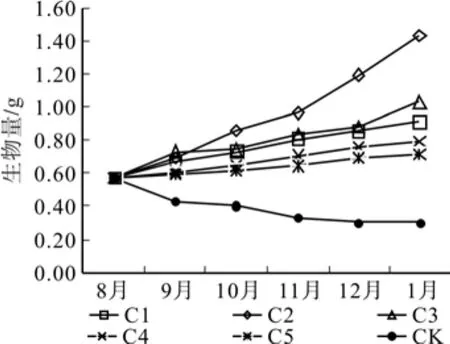
图5 一年生幼苗地上生物量Fig.5 Aboveground biomass of 1-year-old seedlings under water stress

图6 两年生幼苗地上生物量Fig.6 Aboveground biomass of 2-year-old seedlings under water stress

图7 一年生幼苗地下生物量Fig.7 Underground biomass of 1-year-old seedlings under water stress

图8 两年生幼苗地下生物量Fig.8 Underground biomass of 2-year-old seedlings under water stress
图7 和图8为幼苗地下生物量的生长情况,从图中可以看出,随时间推移,除CK组外,地下生物量呈有规律的增长趋势。一年生幼苗在C2条件下地下生物量高于其他组;C1、C3、C5和C4在实验初期差异不显著,在实验结束时,C3要高于其他组,Ck出现较少现象,主要是因为土壤含水量较低,土壤过于干燥,根系出现含水量减低现象。两年生幼苗的生物量明显分为3组,C2和C3一组,两者没有显著差别,明显高于其他组;C1、C4和C5一组,三者差异也不显著,均低于C2和C3,但要高于Ck;Ck组出现减少趋势,与一年生幼苗Ck组状况相同。
图9和图10为清香木幼苗生物量生长率的变化情况,从图中可以看出,实验开始1个月后,清香木幼苗出现明显的生长峰值,随实验时间的推移,清香木幼苗的生长略于降低,渐趋平缓。在图9中,一年生幼苗水分充足条件下的生长率在每次观测中均为最高,略高于正常条件,但显著高于其他组,C1、C4、C5生长率基本相同,没有显著区别,CK生长率为负值,说明基本没有生长,甚至出现落叶、枯萎等情况。图10为两年生幼苗的生长速率,从图中可以看出,两年生幼苗表现出与一年生幼苗相同的趋势,在9月份出现峰值,随后降低渐趋平缓,在实验的后期,C5组也出现了落叶萎缩的情况。与一年生幼苗不同的是,在实验末期,水分正常组的生长率要高于水分充足的条件。

图9 一年生清香木幼苗生长率Fig.9 Biomass growth rate of 1-year-old seedlings under water stress

图10 二年生清香木幼苗生长率Fig.10 Biomass growth rate of 2-year-old seedlings under water stress
2.2.2 茎根比
茎根比是幼苗地上部分鲜重与地下部分鲜重之比,表明幼苗的健壮程度,数值越小,表明幼苗越健壮。从图11和图12可以看出,一年生幼苗C1的茎根比值最大,其次为C5,说明这两种状态下幼苗的生长状况不太健康,地上部分生长过剩或者地下生物量生长缓慢,C2、C4和C3的生长较为健康;在两年生幼苗中,C2和C3的生长最为健壮。

图11 一年生幼苗茎根比Fig.11 Shoot to root ratio of 1-year-old seedlings under water stress

图12 二年生幼苗茎根比Fig.12 Shoot to root ratio of 2-year-old seedlings under water stress
2.3 水分胁迫对比叶面积的影响
比叶面积反映了叶片捕获光照资源的能力,一般与相对生长速率和净光合速率成正比,与叶寿命成反比,具高SLA的植物通常生长在资源较为丰富的环境中,而低SLA植物叶片投资较高,能够适应干旱和高光强环境。从图13和图14可知,从8月到次年1月,随时间推移清香木叶片的比叶面积呈减小的趋势。经过153天的生长,一年生清香木幼苗中水分充足条件下比叶面积最小,其次为正常组,C5、C4、CK、C1组的比叶面积依次增加;两年生水分正常条件下的比叶面积为最小,C2、C1、C5差异不显著,Ck为最大。

图13 一年生幼苗比叶面积Fig.13 Specif i c leaf area of 1-year-old seedlings under water stress

图14 两年生幼苗比叶面积Fig.14 Specif i c leaf area of 2-year-old seedlings under water stress
由于CK组在第三次采样测量之后就出现干枯死亡,因此比叶面积没有明显的变化趋势。实验过程中除CK组外,其它组的幼苗都有不同程度的生长,比叶面积减小,幼苗叶片的生产能力不断提高。图13中C2组一年生幼苗在12月和1月值达到最低,可以看出C2组的下降趋势明显,表明胁迫处理下C2组生长最好。对比C5可以发现,重度干旱胁迫下的C5组亦是明显的呈现下降趋势,表明清香木幼苗在重度干旱胁迫下也是可以生长的。
3 讨 论
多年来,关于茎、叶与根系之比在干旱胁迫下的变化研究较为详细,被认为是确定植物抗旱能力的重要指标[8]。研究认为在不构成胁迫的环境中,幼苗的地上部分生物量的增加明显高于地下部分的生物量的增加,而在水分胁迫下幼苗的地下部分生物量的增加会高于地上部分,而且在胁迫强度和胁迫时间的推移下,表现的更为明显。例如,研究发现在150%降雨量的条件下,随胁迫时间的推移,清香木幼苗将相对较多的养分投入到地下部分,用于促进根的生长,而地上叶片和茎的生长较小,此种适应对策可以帮助清香木幼苗吸收更多的水分和养分,以及减少蒸腾等损耗,从而适应逆境,这与生物量的“最优分配理论(the optimal partitioning theory)”模式相符合[12],但清香木的适应调节未能在过度胁迫的条件下实现,因此在水分过多(200%)或过少(50%)的环境中,清香木的茎根比仍较大。
生物量积累与植物的形态和生长有着密切关系。大量的研究结果表明,水分胁迫下植物的新生叶片、新生枝的数量、枝条的增长速率,以及根的延伸等受到不同程度的抑制,因此植物的总生物量呈减小趋势,甚至被完全抑制[9-10]。但胁迫强度、受试物种生物学特征和植物生长进程的不同,生物量与生产力衰退幅度存在较大的差异。结合本研究的测定结果可以发现清香木幼苗在各个水分条件下胁迫初期幼苗的苗高、基茎等方面都有不同程度的增加,随着胁迫的加重,生物量增加不明显。目前关于干旱胁迫下植物生物量降低可解释为,在干旱胁迫条件下,气孔关闭限制了外界二氧化碳向叶绿体的供应,或者叶肉细胞光合作用下降,引起了植物光合能力降低[11-12],光合产物的产生受阻,因而干物质积累也随之急剧减少。
水分胁迫对植物的影响是多方面的,对大多数植物而言,短期或轻度的干旱胁迫会引起叶片水势和气孔关闭,从而限制CO2的吸收和降低光合作用的速率,而长期的严重干旱将显著限制植物生长、发育和生产力,甚至导致植物死亡[13-14]。本研究结果表明在环境条件一致的情况下,不同生长阶段的幼苗对水分胁迫的反映不同。在幼苗初期,对水分的需求很大,水分充足条件下,更能促进幼苗地上部分的生长,而随着幼苗的生长,其对水分干旱胁迫的能力增强,最明显的表现为水分充足和正常水分条件下生长没有表现出明显的差异,进一步说明清香木的耐旱特性。一年生幼苗CK组在不浇水的条件下基本没有生长,而两年生幼苗CK组在生长一个月之后,第三个月后全部死亡,出现嫩芽枯萎、叶片脱落等表现,故生物量均呈现减少趋势,结果可以说明大龄幼苗对干旱胁迫的能力要高于生长初期的幼苗。另外,从结果可以看出,清香木的耐旱性较强,一旦水分条件有所增加,其生长速度明显加快,但如果水分增加较多,根系则无法正常生长,而在干旱条件下,生长速度减慢,但仍能保证正常生长。
4 结 论
(1)清香木幼苗在一定程度上能够通过调整不同器官生物量的分配规律、将更多的物质分配给根系来适应干旱胁迫,将逆境的伤害降低到最小,这也是清香木在胁迫环境下的生存对策之一。在环境较优越的条件下,清香木幼苗的生长偏向于地上部分的增长,而在土壤水分胁迫下,幼苗的生长偏向于地下部分的增长,以获得更多的水分、养分,从而适应胁迫环境,在胁迫程度和时间的增加下,此种差异愈发明显。这些变化有利于清香木保持体内水分的平衡,是植物对干旱环境的一种适应机制,可使植物能在干旱胁迫下吸收更多的水分和营养,提高其在干热河谷生存的竞争能力。
(2)清香木叶片生长对干旱胁迫最为敏感,在水分胁迫环境中幼苗的地上生物量、苗高、叶片、基茎等生长性状增长停滞,叶片面积和总数减少,甚至后期出现新芽、新叶枯萎的症状。这些变化能够减少蒸腾面积,以抵御和适应胁迫环境,这在水分缺乏的环境中表现更为突出,是植物适应干旱的一种生存方式。
(3)清香木幼苗期需水量较多,对水分的敏感度比较强,而一年生幼苗比两年生苗对水分的反应更为突出。在适度的干旱情况下,幼苗生长缓慢,但仍能正常生长,但持续大强度的干旱,则对种群的更新和生长产生致命的影响。据统计,自2009年~2013年以来,金沙江河谷元谋段连续5年持续干旱,2013年更是有将近130天没有降雨,境内6条河流断流,2012年的年降雨量只有历年平均降雨量的64%。在这种情况下,在小河口水电附件的清香木典型种群调查结果表明,在0.02 km2的典型群落中,分布着能够开花结果的基茎>15 cm的清香木264株,平均8.8株/亩,但是没有发现苗龄在3龄以下的幼苗,可见持续大强度的连续干旱对乡土树种产生了巨大的生存压力,清香木如无法完成自我繁殖,这一种群将面临严峻的生存考验,因此,对其种质资源的保护刻不容缓。
[1] 吴征镒. 云南植被[M]. 北京:科学出版社, 1987.
[2] 周葆华. 清香木叶挥发油成分及其抑菌作用[J]. 应用化学,2008, 25(3): 305-308.
[3] 欧晓昆. 金沙江干热河谷的资源植物及其生态特征[J]. 植物资源与环境, 1994, 3(1): 42-46.
[4] Xie Y H, Wen M Z, Yu D. Growth and resource allocation of water hyacinth as affected by gradually increasing nutrient concentrations [J]. Aquatic Botany, 2004, 79: 257-266.
[5] 王玉魁, 阎艳霞, 余新晓, 等. 干旱胁迫下灰白滨藜保护酶活性及抗旱生理特性研究[J]. 干旱区资源与环境, 2010,24(10):122-126
[6] 王克勤. 集水造林与水分生态[M]. 北京: 中国林业出版社,2002.
[7] 李 昆, 孙永玉, 张春华, 等. 金沙江干热河谷区8个造林树种的生态适应性变化[J]. 林业科学研究, 2011, 24(4): 488-494.
[8] Jos A R, Hans B, Francisco A C. Interactive effects of N and P on growth ,nutrient allocation and NH4 uptake kinetics by Phragmites australis [J]. Aquatic Botany, 1999,64: 369-380.
[9] Margaret G, Anne W. Constructed wetlands in Queensland:Performance eff i ciency and nutrient bioaecumulation [J]. Journal of Applation Ecology, 1999,33 : 1441-1450.
[10] Urban G, Hakan R, Hugo S. Diversity and pH changes after 50 years on the boreal mire Skattlosbergs Stormosse, Central Sweden [J]. Journal of Vegetation Science, 2000,11:277-286.
[11] Woodward F L, Emanuel W R. Agloball and primary productivity and phytogeography model. Global Biogeochem Cy, 1995, 9(4):471-490.
[12] 张鹏翀, 应求实,莫亚鹰. 阴生型地被植物耗水性与最大光化学效率对干旱胁迫的响应[J]. 浙江农林大学学报,2013,30(4):499-504.
[13] 赵 琳, 郎南军, 温绍龙, 等. 云南干热河谷4种植物抗旱机理的研究[J]. 西部林业科学, 2006, 35(2): 9-16.
[14] 陈 闻, 赵 颖, 叶正钱. 干旱胁迫对5个海岛树种生长及生理特性的影响[J]. 浙江农林大学学报, 2013, 30(4): 490-498.
[15] 潘 昕, 谢德新, 邱 权, 等. 干旱胁迫对两种速生树种苗木生理指标的影响[J]. 中南林业科技大学学报, 2013, 33(10):84-88.
[16] 韩文萍, 丁贵杰, 鲍 斌. 不同种源马尾松对干旱胁迫的生理生态响应[J]. 中南林业科技大学学报, 2012, 32(5): 25-29.
Responses of Pistacia weinmannifolia seedling to different water gradient in dry-hot valley
WANG Yan1,2, ZHANG Chao1, LI Kun2
(1. College of Environment Science and Engineering, Southwest Forestry University, Kunming 650224, Yunnan, China;2. Research Institute of Resource Insect, Chinese Academy of Forestry, Kunming, 650224, Yunnan, China)
Seedling plant height, leaf traits, biomass, and seedling growth state ofPistacia weinmannifoliaunder different precipitation gradients were observed and analyzed in order to explore the seedling water use eff i ciency traits in the case of water loss or excessive condition and response to the water stress in dry and hot valley in Yunnan province, and which can provide some theoretical guidance and technical reference to region vegetation restoration. The results show that in the early stage,P. weinmannifoliaseedling requires high water condition and better seedling growth in conditions of adequate moisture, but in drought conditions, seedling growth is slower than normal moisture conditions, the tolerance ofP. weinmannifoliaseedling to extreme drought was higher than that to extreme precipitation, at the same time, with the growth of plants, the water requirement sensitivity ofP. weinmannifoliadecreased;the increase of aboveground biomass of the seedlings was signif i cantly higher than the increase on the underground of the biomass in the environment without stress, while in the water too much or too little condition, the increase of the underground biomass of the seedlings will be higher than the above-ground biomass, which is more obvious with the cumulative time. These adaptive responses can help the seedlings to absorb more water and nutrients, as well as to reduce transpiration loss, and to adapt to adversity.
Pistacia weinmannifolia; seedling growth; water gradient; biomass; leaf area
S719.253
A
1673-923X(2014)10-0019-07
2013-10-15
国家自然科学基金项目(31100520)
王 妍(1980-),女,河北承德人,博士,副教授,主要从事荒漠化防治和恢复生态学研究;E-mail:wycaf@126.com
张 超(1980-),男,河北丰南人,副教授,主要从事森林可持续经营研究;E-mail:zhchgis@126.com
[本文编校:吴 彬]

