HBx和c-Src对肝癌细胞HepG2上皮间质转化的介导作用及其分子机制
吕高波,赵 阳(宝鸡市中心医院肛肠外科,宝鸡 7000;西安交通大学第二附属医院肿瘤科;通讯作者,E-mail:bluejackie@stu.xjtu.edu.cn)
最近几年,越来越多的研究结果表明乙肝病毒的感染与肝细胞癌(hepatocellular carcinoma,HCC)的复发和转移密切相关[1],但是乙肝病毒促进HCC的复发和转移机制目前研究尚不清楚。乙肝病毒基因组有四种不同的开放阅读框架,X基因所编码的蛋白HBx与HCC发生和发展关系最为密切,HBx蛋白在HCC组织中的阳性率高达71.8%[2]。HBx本身是一种多功能蛋白,它具有促进正常肝细胞恶性转化的作用,探明HBx对HCC侵袭转移功能的影响机制具有十分重要的临床及科学价值。伴随着研究的深入,越来越多的HBx相关信号分子被发现,癌基因c-Src也被证明能够被HBx所活化,而c-Src是重要的上皮间质转化(epithelial-mesenchymal transition,EMT)调控因子[3]。针对 HBx的促侵袭转移的分子机制,本研究通过干预HBx的表达以及应用c-Src抑制剂观察其对肝癌细胞EMT的影响。
1 材料与方法
1.1 抗体和试剂
小鼠抗HBx单克隆抗体购自US Biological Biotechnology,小鼠抗 Vimentin,E-cadherin 和 β-catenin单克隆抗体均购自Santa Cruz Biotechnology,小鼠抗N-cadherin单克隆抗体购自Sigma公司,兔抗c-Src多克隆抗体购自 Calbiochem Biotechnology。C-Src特异性抑制剂PP2及其阴性对照PP3购自Calbiochem Biotechnology。
1.2 细胞系和细胞培养
HepG2—人类HCC细胞系(人乙肝病毒基因阴性)购自北京细胞中心(北京大学生物医学中心),HepG2细胞培养于DMEM培养基中,培养基包含100 ml/L的胎牛血清(Sigma)、100 U/ml青霉素和100 μg/ml链霉素,培养箱内温度维持在37℃,CO2含量为50 ml/L。
1.3 腺病毒载体的构建
腺病毒包装试剂盒购自Bioscience公司,依据试剂盒操作指南,我们构建了表达HBx的腺病毒载体。HBx基因首先被插入到腺病毒包装质粒pAdTrack-CMV上,从而构建了重组腺病毒质粒pAdTrack-CMVHBx,PmeI公司对 pAdTrack-CMV-HBx质粒进行测序,证实质粒重组成功。pAdTrack-CMV-HBx转染进入BJ5183细胞,在BJ5183细胞中,pAdTrack-CMVHBx与pAdEasy-1进行同源重组,重组后再次测序,证实重组成功。将重组的质粒转染进入293N细胞,包装成腺病毒,腺病毒经过纯化后,收集并保存于-80℃待用。对照腺病毒载体(Mock)的合成方式与HBx腺病毒载体合成方式相同。
1.4 转染及细胞处理
HepG2细胞置于6孔板中培养,孵育24 h,使用无血清培养基稀释纯化的腺病毒,将不同稀释浓度的腺病毒与细胞共孵育2 h,使用含血清培养基替换无血清培养基继续培养HepG2细胞。转染后的HepG2细胞在37℃,50 ml/L CO2的培养箱中培养7 d,检测细胞内目标蛋白的表达。为了探索c-Src对EMT的影响,我们选择 c-Src特异性抑制剂PP210 μg/ml处理 HepG2细胞24 h,观察细胞内EMT相关信号分子的表达变化,应用PP3 10 μg/ml作为阴性对照。
1.5 免疫组化
将HepG2细胞置于盖玻片上,爬片生长24 h,用100%丙酮或者100%乙醇和100%丙酮1:1混合液20 ℃固定细胞 20 min,应用抗 HBx(1∶100),E-cadherin(1∶100)、β-catenin(1∶100)、N-cadherin(1∶100)和vimentin(1∶100)一抗,于4℃孵育细胞过夜,PBS冲洗盖玻片5 min×3次,应用生物素标记的二抗于37℃孵育30 min,PBS冲洗盖玻片5 min×3次,显色剂DAB显色20 min,自来水冲洗终止反应,之后,苏木素复染1 min,自来水冲洗30 s,封片保存并拍照。

图1 HBx对HepG2细胞形态的影响Figure 1 Effect of HBx on the morphology of HepG2 cells
1.6 Western blot检测
HepG2细胞应用含100 ml/L胎牛血清的DMEM培养基培养至90%融合,细胞裂解液裂解细胞,收集细胞裂解液,应用BCA试剂盒(购自Pierce Chemical公司)检测蛋白浓度,记录不同蛋白浓度,蛋白样本煮沸15 min,使其变性,于-20℃保存。根据蛋白浓度调整上样量,保证上样蛋白量一致,经过SDS-PAGE电泳,蛋白印迹转至NC膜(Millipore公司)上。NC膜于50 g/L脱脂牛奶中4℃孵育过夜,特异性一抗(anti-E-cadherin 1∶1 000,124 kD;anti-βcatenin 1∶1 000,92 kD;anti-N-cadherin 1∶1 000,130 kD;anti-vimentin 1∶1 000 58 kD;1∶1 000;anti-HBx 1∶1 000,17 kD)室温孵育 NC 膜 2 h,TBST 洗膜 5 min×3次,室温孵育辣根过氧化物酶标记的二抗2 h,TBST洗膜 5 min×3次,显色液(购自 Pierce Chemical公司)显色,压片定影后拍照,计算灰度值。
1.7 统计学分析
2 结果
2.1 HBx可以改变HepG2细胞的形态
HBx腺病毒载体的转染提高了HepG2细胞中的HBx表达水平,相比较转染对照腺病毒的HepG2细胞,外源性HBx转染的HepG2细胞形态发生了明显的改变,细胞展现出了成纤维细胞样形态变化,细胞呈梭形,轴向伸展延长,与周围细胞松散分布(见图1)。
2.2 HBx对HepG2细胞EMT标志物的影响
为了探索HBx与EMT之间的相关性,我们观察了上皮细胞标志E-cadherin和β-catenin,间质细胞标志N-cadherin和Vimentin的表达。外源性HBx蛋白表达上调,显著上调了上皮细胞标志E-cadherin的表达,下调了间质细胞标志N-cadherin和Vimentin的表达(图2),这些结果符合EMT改变。
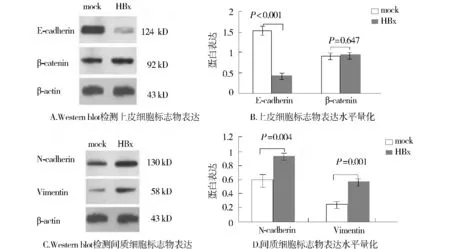
图2 HBx介导HepG2细胞EMT标志物的表达Figure 2 HBx induces epithelial and mesenchymal markers expression in HepG2 cells
我们进一步应用免疫组织化学方法观察了上皮细胞及间质细胞标志物在HepG2细胞中的表达特点,E-cadherin呈现为近膜分布,N-cadherin和Vimentin为细胞质分布,β-catenin在HBx转染的细胞胞质和胞核中均有分布,在对照细胞中β-catenin集中分布在细胞质中。HBx显著改变了HepG2细胞的形态,呈现出了松散分布和梭形改变的特点,下调了上皮细胞标志E-cadherin表达,上调了间质细胞标志物N-cadherin和Vimentin(见图3)。
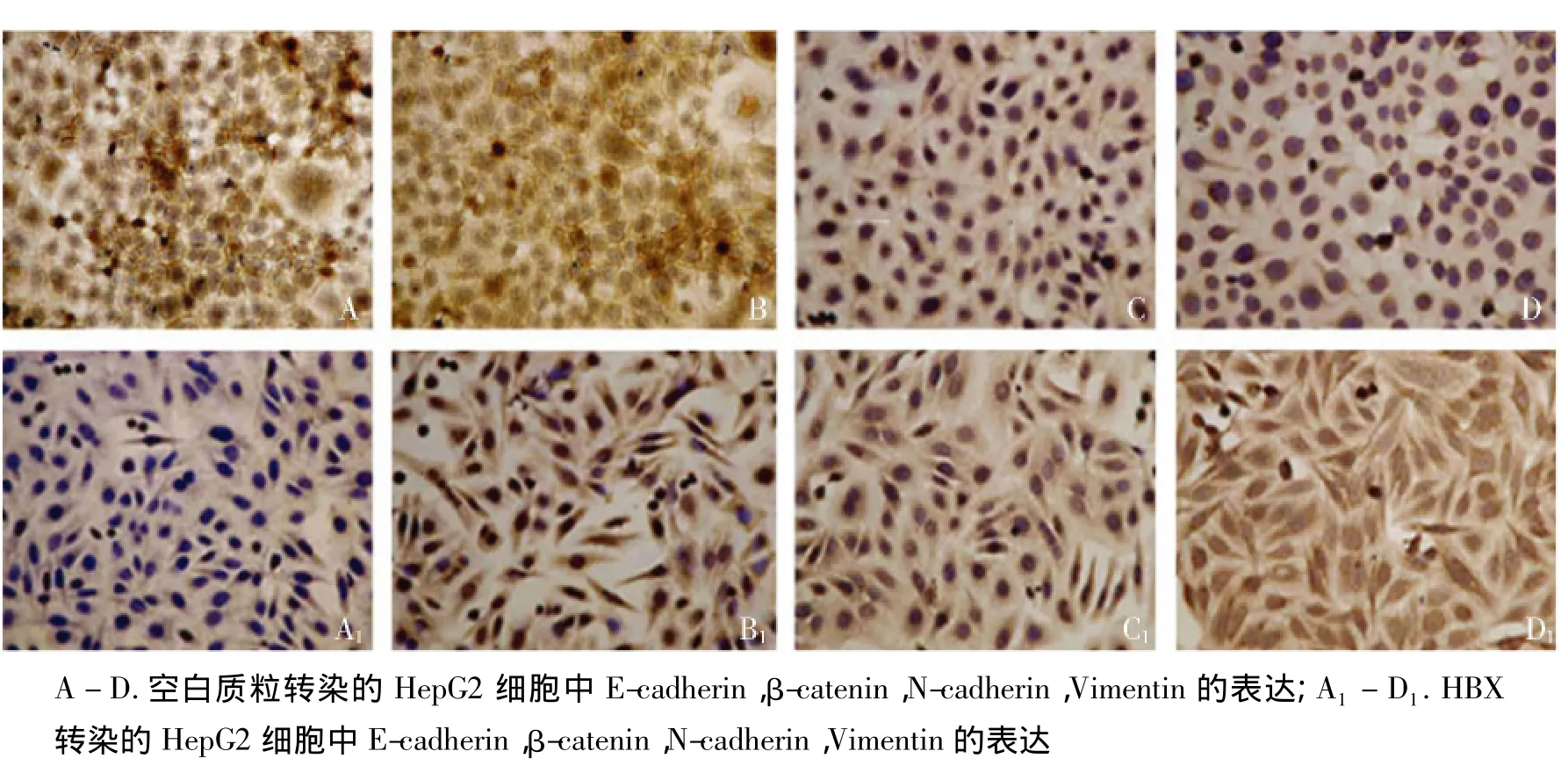
图3 免疫组化检测HBx对HepG2细胞EMT标志物的表达Figure 3 EMT markers expression in HepG2 cells by immunohistochemistry
2.3 c-Src抑制剂阻断HBx介导的HepG2细胞形态改变
为进一步探索c-Src活性对HBx介导的EMT改变的影响,我们应用c-Src特异性抑制剂PP2处理HBx转染的HepG2细胞,应用PP3作为PP2的阴性对照。PP2处理的HBx转染的HepG2细胞失去了梭形形态,细胞间的连接紧密,而PP3处理的HBx转染的HepG2细胞未见明显的细胞形态改变(见图4),c-Src特异性抑制剂逆转了HBx介导的HepG2细胞的EMT改变。

图4 PP2抑制HBx介导的HepG2细胞形态改变Figure 4 PP2 inhibits the HBx-induced morphologic changes of HepG2 cells
2.4 c-Src抑制剂阻断 HBx介导的 HepG2细胞EMT标志分子表达改变
基于以上的形态观察,我们更进一步探索了PP2对HBx转染的HepG2细胞中EMT标志物的表达情况。与之前的观察结果类似,在HBx转染的HepG2细胞中,PP2恢复了上皮细胞标志E-cadherin的表达,下调了间质细胞标志N-cadherin和Vimentin的表达,而PP3并未对E-cadherin,N-cadherin和Vimentin的表达产生影响(见图5)。免疫组化的观察也支持PP2对HBx介导的EMT信号通路的阻断作用,同时PP2的应用显著破坏了β-catenin的胞核分布(见图6)。

图5 PP2抑制HBx转染的HepG2细胞EMTFigure 5 PP2 inhibits HBx-induced EMT in HepG2 cells
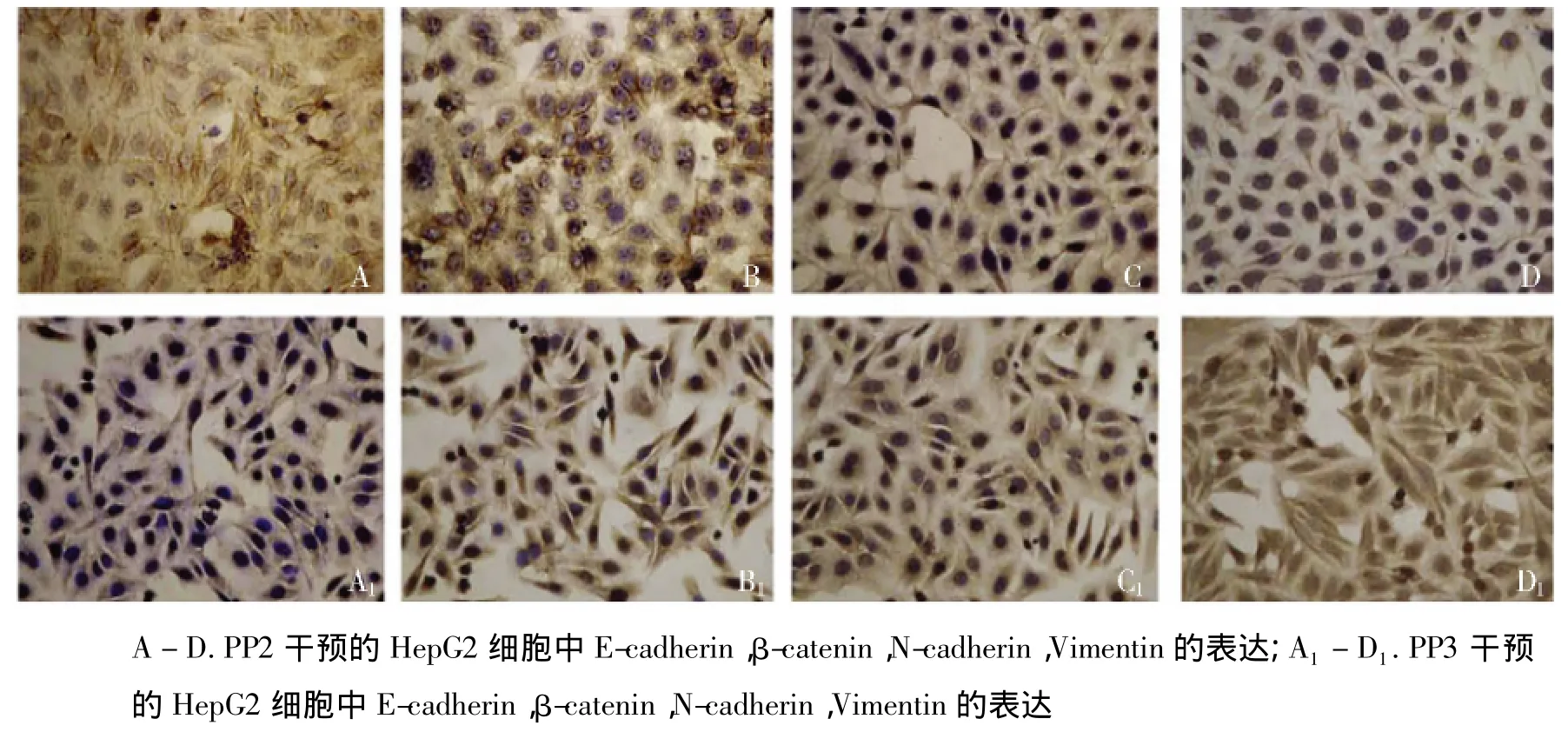
图6 免疫组化检测PP2和PP3对HBx转染的HepG2细胞EMT标志物表达Figure 6 EMT markers expression in HepG2 cells treated by PP2 or PP3 by immunohistochemistry
3 讨论
在众多恶性肿瘤促侵袭转移的机制当中,EMT是近期的研究热点。EMT主要的功能特点是使恶性肿瘤细胞失去上皮细胞功能,而展现间质细胞的功能,功能改变导致恶性肿瘤细胞的细胞间连接趋于松散,细胞骨架进行重组,细胞形态呈现出成纤维细胞样改变,这一系列改变导致恶性肿瘤细胞侵袭转移能力增强[3,4]。在分子水平上,EMT的主要特征是上皮细胞标志物—E-cadherin等表达下调,而间质细胞标志物—N-cadherin,Vimentin等表达上调[3,4]。
在我们的研究当中,肝细胞癌HepG2细胞展现出了典型的上皮细胞形态特点,稳定转染HBx基因的HepG2细胞形态发生了明显的改变,呈现出了梭形改变,类似成纤维细胞,细胞与细胞之间的连接松散,这些观察表明外源性HBx基因转染介导HepG2细胞发生EMT形态改变。进一步Western blot和免疫组化结果表明:HBx基因转染导致上皮细胞标志E-cadherin表达下调,而间质细胞标志N-cadherin和Vimentin表达上调,这些结果进一步支持了HBx具有介导HepG2细胞EMT改变的重要作用。EMT标志物表达的改变也被称为“cadherin开关效应”,这种cadherin开关效应最初被Tomita等在前列腺癌中观察到,E-cadherin下调是EMT的标志改变[5]。
E-cadherin在维持上皮细胞表型和同源细胞间的黏附功能至关重要,在多种恶性肿瘤细胞系中,E-cadherin表达下调有效地上调了细胞侵袭转移能力[6],另一方面,E-cadherin表达下调间接促进了其他类型 cadherin表达,如 N-cadherin,N-cadherin表达上调增加了细胞的迁移能力,促进了细胞与内皮细胞、细胞与细胞外基质间的新黏附结构形成,从E-cadherin到N-cadherin改变有效促进了恶性肿瘤细胞的侵袭转移和血管侵犯[7,8]。
我们的免疫组化结果表明,HBx基因转染的HepG2细胞呈现了EMT改变,同时,β-catenin在其胞质和胞核中均有较高水平的表达,对照细胞中,βcatenin主要分布在近细胞膜处。这些结果与之前的报道类似[9],说明β-catenin在EMT中发挥了转录因子作用。在Wnt信号通路中,已经证实伴随E-cadherin表达下调,β-catenin发生细胞质到细胞核的定位改变,在细胞核中,β-catenin发挥了转录因子的作用,上调了N-cadherin和vimentin表达,导致EMT 的发生[9,10]。
c-Src是细胞内具有重要功能的一个非受体酪氨酸激酶,c-Src活性升高能够显著增强多种恶性肿瘤细胞的侵袭转移,其促侵袭转移的分子机制十分复杂[11]。c-Src能够通过活化 Ras/Raf-1/MAPK信号通路减弱细胞间的黏附作用,促进恶性肿瘤细胞的侵袭转移[12],另一方面,c-Src可以在近细胞膜处活化小分子GTP酶,导致细胞骨架重组,增强了恶性肿瘤细胞的迁移能力[13]。近期的研究结果表明,c-Src可以磷酸化E-cadherin,导致 E-cadherin泛素化降解,介导EMT改变发生[14]。我们的研究结果进一步支持了c-Src对肝癌HepG2细胞EMT具有重要的促进作用。
本研究结果表明,HBx基因转染显著提高了HepG2细胞的c-Src活性,在应用c-Src特异性抑制剂PP2作用于转染HBx基因的HepG2细胞后,EMT改变被有效的逆转,细胞形态恢复上皮样改变,E-cadherin表达恢复,N-cadherin和Vimentin表达下调,β-catenin细胞核表达显著减少,这些结果表明c-Src在恶性肿瘤细胞EMT中发挥了重要的作用。由于c-Src相关信号分子十分复杂,由此推测不同信号分子间可能存在cross-talk,最终介导恶性肿瘤细胞的EMT发生。
4 结论
HBx基因的转染导致肝细胞癌HepG2细胞发生EMT改变,c-Src分子在HBx介导的EMT改变中发挥了至关重要的作用,更进一步的分子机制的探索对于揭示更深层的EMT改变是必要的,EMT分子机制的明确将为控制恶性肿瘤细胞的侵袭转移提供新的思考。
[1]Kubo S,Takemura S,Tanaka S,et al.Management of hepatitis B virus infection during treatment for hepatitis B virus-related hepatocellular carcinoma[J].World J Gastroenterol,2015,21(27):8249-8255.
[2]Chan CF,Yau TO,Jin DY,et al.Hepatitis B virus X protein(HBx)is responsible for resistance to targeted therapies in hepatocellular carcinoma:ex vivo culture evidence[J].Clin Cancer Res,2015,21(5):8140-8149.
[3]Zheng H,Kang Y.Multilayer control of the EMT master regulators[J].Oncogene,2014,33(14):1755-1763.
[4]Puisieux A,Brabletz T,Caramel J.Oncogenic roles of EMT-inducing transcription factors[J].Nat Cell Biol,2014,16(8):488-494.
[5]van Roy F.Beyond E-cadherin:roles of other cadherin superfamily members in cancer[J].Nat Rev Cancer,2014,14(2):121-134.
[6]Lecuit T,Yap AS.E-cadherin junctions as active mechanical integrators in tissue dynamics[J].Nat Cell Biol,2015,17(5):533-539.
[7]Radice GL.N-cadherin-mediated adhesion and signaling from development to disease:lessons from mice[J].Prog Mol Biol Transl Sci,2013,116:263-289.
[8]Wang F,Li XK,Xu HY,et al.N-cadherin participated in invasion and metastasis of human esophageal squamous cell carcinoma via taking part in the formation of vasculogenic mimicry[J].Med Oncol,2015,32(2):480.
[9]Liu J,Lian Z,Han S,et al.Downregulation of E-cadherin by hepatitis B virus X antigen in hepatocellular carcinoma[J].Oncogene,2006,25(7)1008-1017.
[10]Fernandez-Sanchez ME,Barbier S,Whitehead J,et al.Mechanical induction of the tumorigenic beta-catenin pathway by tumour growth pressure[J].Nature,2015,523(7558):92-95.
[11]Bordoli MR,Yum J,Breitkopf SB,et al.A secreted tyrosine kinase acts in the extracellular environment[J].Cell,2014,158(5):1033-1044.
[12]McLachlan RW,Kraemer A,Helwani FM,et al.E-cadherin adhesion activates c-Src signaling at cell-cell contacts[J].Mol Biol Cell,2007,18(8):3214-3223.
[13]Frame MC.V-SRC informs integrin signaling[J].Nat Rev Mol Cell Biol,2013,14(9):548.
[14]Wilson C,Nicholes K,Bustos D,et al.Overcoming EMT-associated resistance to anti-cancer drugs via Src/FAK pathway inhibition[J].Oncotarget,2015,5(17):7328-7341.

