化学修饰杏鲍菇多糖对K562细胞的抑制作用
陈 琳, 郝长春*, 梁 涛, 南 征, 孙润广
(1 陕西师范大学 物理学与信息技术学院;
2 食品工程与营养科学学院,陕西 西安 710119)
化学修饰杏鲍菇多糖对K562细胞的抑制作用
陈琳1,郝长春1*,梁涛2,南征1,孙润广1
(1陕西师范大学物理学与信息技术学院;
2食品工程与营养科学学院,陕西西安710119)
摘要:对碱提杏鲍菇粗多糖进行了硫酸化、磷酸化、乙酰化修饰,并对其体外抗肿瘤活性进行了研究。利用红外光谱技术对化学修饰前后的碱提杏鲍菇粗多糖(PEAP)结构进行检测,并采用MTT法研究未修饰多糖与修饰后多糖对人白血病细胞K562体外增殖抑制作用。结果显示:化学修饰后的PEAP分别具有硫酸基团、磷酸基团、乙酰基团的特征吸收峰。化学修饰后的PEAP均对白血病细胞K562的抑制作用有一定提高,其中乙酰化杏鲍菇粗多糖(Ac-PEAP)对白血病细胞K562的抑制作用最强。
关键词:杏鲍菇;多糖;化学修饰;抗肿瘤活性
肿瘤是当今世界直接危及人类生命的一种最常见、最严重的疾病,如何有效地预防和治疗肿瘤已成为医学和药学领域研究的一个热点[1]。研究表明,部分真菌多糖一方面能够有效提高机体免疫力,同时对癌变细胞还表现出显著抑制作用[2],优选具一定抗癌作用的天然多糖,并了解该类多糖的抗癌机理已成为现在肿瘤研究的热门问题。因此,多糖有望成为协同抗癌药物,缓解甚至治疗肿瘤的有效来源。
多糖(Polysaccharide)是由10个以上的单糖通过糖苷键连接形成的含醛基或酮基的天然高分子聚合物,广泛存在于动物、植物、微生物中[3]。大量研究证实部分真菌类多糖不但具有能够抑制肿瘤细胞生长的特点,同时其相对机体毒性较低[4-5]。多糖的生物活性直接或间接受分子结构的影响,因此对多糖的分子结构进行修饰可以增强多糖的活性[6],降低其毒副作用[7-11]。
杏鲍菇又名刺芹侧耳,属于真菌门,侧耳属植物,营养丰富,风味独特,并且具有多糖、酚类、海藻糖等多种活性成分,已成为一种食疗一体的两用食用菌新品种。杏鲍菇具有抗氧化[12]、抗病毒[13-14]、抗肿瘤[14-15]、降血脂[16]及润肠胃[17]等多种功效,其中杏鲍菇多糖成分的结构和生物活性等诸多方面都受到了研究者的关注。
本文对三种化学修饰的杏鲍菇多糖体外抑制K562细胞增殖的活性进行了研究,为杏鲍菇多糖的生物活性研究及开发抗肿瘤药物市场提供理论依据。
1材料与方法
1.1 材料与试剂
杏鲍菇粗多糖(PEAP)由陕西师范大学食品工程与营养科学学院提供;K562细胞由陕西师范大学生命科学学院提供。
胎牛血清购于杭州四季青生物有限公司;DMSO购于美国Sigma公司;MTT购于美国Amresco公司;RPMIMedium1640培养基购于美国GIBCO公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DG5032型酶联免疫检测仪(南京华东电子集团意料设备有限公司);XDS-2B倒置生物显微镜(重庆光电仪器有限公司);Avatar360E.S.P.FTIR傅里叶变换红外光谱仪(尼高力);HH·CP-01W型细胞培养箱(上海博讯实业有限公司医疗设备厂);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);H-H-4型恒温水浴锅(上海浦东物理光学仪器公司);SZ-97自动三重纯水蒸馏器(上海亚荣生化仪器厂);RE-52AA型旋转蒸发器(上海亚荣生化仪器有限公司)。
1.3 实验方法
1.3.1碱提杏鲍菇粗多糖的化学修饰硫酸酯化碱提杏鲍菇粗多糖(S-PEAP)的制备:量筒量取无水吡啶10mL加入到三颈瓶中,并持续搅拌装置及其冷凝管,待到三颈瓶中量取的无水吡啶经过冰水浴使其充分冷却后,此时快速搅拌,并用滴液漏斗缓缓加入4mL氯磺酸,滴加完毕后继续搅拌30min。量取7mL二甲基甲酰胺用来溶解酯化试剂,再加入碱提杏鲍菇粗多糖样品100mg,80℃搅拌,待反应3h后,用氢氧化钠来中和反应液,此时离心,移取上清液分别用自来水和蒸馏水各透析2d,并收集透析液浓缩,醇淀12h后,再离心,称取沉淀溶于定量蒸馏水中,之后分别用自来水和蒸馏水透析2d,离心后取上清液,经冷冻干燥即得硫酸酯化碱提杏鲍菇粗多糖样品(S-PEAP)[18]。
磷酸酯化碱提杏鲍菇粗多糖(P-PEAP)的制备[19]:精确称取碱提杏鲍菇粗多糖100mg溶解于100mL蒸馏水中,并在室温下调节pH=8.0,之后分别加入三氯氧磷(POCl3),在60℃恒温水浴锅中使其反应40min。当反应结束后,冷却至室温并调节pH=6.5,后用无水乙醇沉淀,离心,再醇沉,经冷冻干燥即得磷酸酯化碱提杏鲍菇粗多糖样品(P-PEAP)。
乙酰化碱提杏鲍菇粗多糖(Ac-PEAP)的制备[20]:精确称取碱提杏鲍菇粗多糖100mg溶解于10mL蒸馏水中,并用0.5mmol/LNaOH调节到pH=9,之后30℃保温反应4h。在此期间分为6次加入乙酸酐,每次加入量为2.5mL,同时不断逐滴加入0.5mol/LNaOH以保持pH=8.0。待反应结束后,用5mol/LHCL调节pH=7.0,混合溶液经透析,浓缩,冷冻干燥后即得乙酰化碱提杏鲍菇粗多糖样品(Ac-PEAP)。
1.3.2修饰前后多糖的红外光谱(IR)分析称取适量杏鲍菇多糖与干燥后的溴化钾粉末混合研磨,待至细末状,称取适量杏鲍菇多糖和溴化钾混合物压片,进行IR扫描,扫描范围从4000至400cm-1,以溴化钾压片为扫描背景[21]。
1.3.3白血病细胞K562的培养人白血病细胞K562经复苏后,常规培养于灭菌后的RPMI1640培养基中(含10%的胎牛血清和青霉素、链霉素各100IU/mL),置于温度37℃、二氧化碳浓度为5%的二氧化碳培养箱中培养[22]。
1.3.4MTT法检测细胞增殖实验[23-24]取对数生长期白血病细胞K562,经台盼蓝染色后计数并以1×105的密度接种于96孔板中,设置6个重复孔,每孔加入100μL细胞悬液。待培养24h后,调零组及其对照组每孔加入100μL灭菌后RPMI1640培养基溶液,而处理组分别加入体积为100μL不同浓度的杏鲍菇粗多糖溶液,设置多糖溶液的浓度梯度为25、50、100、200、400和800μg/mL。多糖溶液与细胞接触24、48、72h后,每孔中加入20μLMTT(5mg/mL)溶液,置于培养箱孵育4h,1000r/min的条件下离心5min,移除上清液,每孔加入180μLDMSO溶液,轻微振荡96孔板10min,使用酶标仪在492nm波长处测定每孔吸光度。重复实验3次,计算细胞抑制率:
细胞相对生长抑制率=

1.4 数据处理
利用OriginPro8.5作图,SPSS软件进行数据分析。
2结果与分析
2.1 红外结果分析


图1 PEAP和S-PEAP的红外光谱Fig.1 IR spectrum of PEAP and S-PEAP

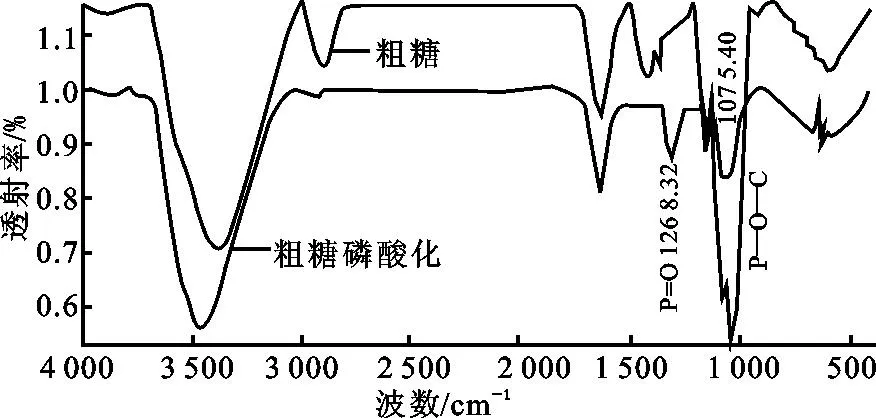
图2 PEAP和P-PEAP的红外光谱Fig.2 IR spectrum of PEAP and P-PEAP


图3 PEAP和Ac-PEAP的红外光谱Fig.3 IR spectrum of PEAP and Ac-PEAP
2.2 抗肿瘤实验分析
PEAP对人白血病K562细胞作用24、48、72h后,结果显示出一定的抑制作用。PEAP对细胞的抑制效果表现为72h最明显,其次是48h,多糖作用于细胞24h呈现最弱抑制效果(P<0.05,P<0.01)。多糖浓度在0~400μg/mL范围内,对K562细胞的生长呈现时间及计量依赖方式(P<0.05,P<0.01);在400~800μg/mL范围内,多糖对细胞生长抑制程度未保持原有变化趋势,而是随多糖浓度的增大而逐渐减小,结果如图4所示。
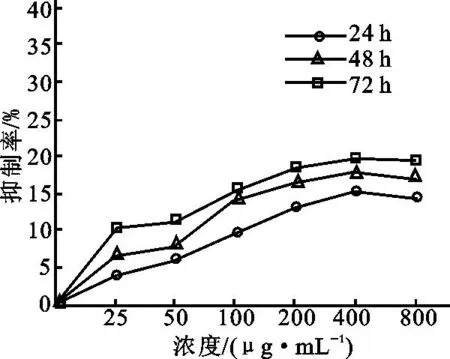
图4 PEAP对K562细胞的抑制效果Fig.4 Inhibition effects of PEAP against K562 cells
S-PEAP在实验作用时间内对白血病K562细胞的抑制作用较PEAP有所增强,抑制效果在48h达到最大,24h次之,72h抑制作用较弱。在S-PEAP浓度为200μg/mL时,对白血病K562细胞的抑制率最大,抑制率可达到33.82%;随着多糖浓度的持续增加,抑制率开始有所下降,结果见图5。研究表明正因为食用菌多糖的生物活性与其结构和理化性质有着密切联系,所以多糖经硫酸化修饰后,引入的硫酸根基团改变了多糖支链的空间结构,在一定程度上提高了其水溶性与糖链的屈伸程度,这可能是引起生物活性改变的重要原因[28]。
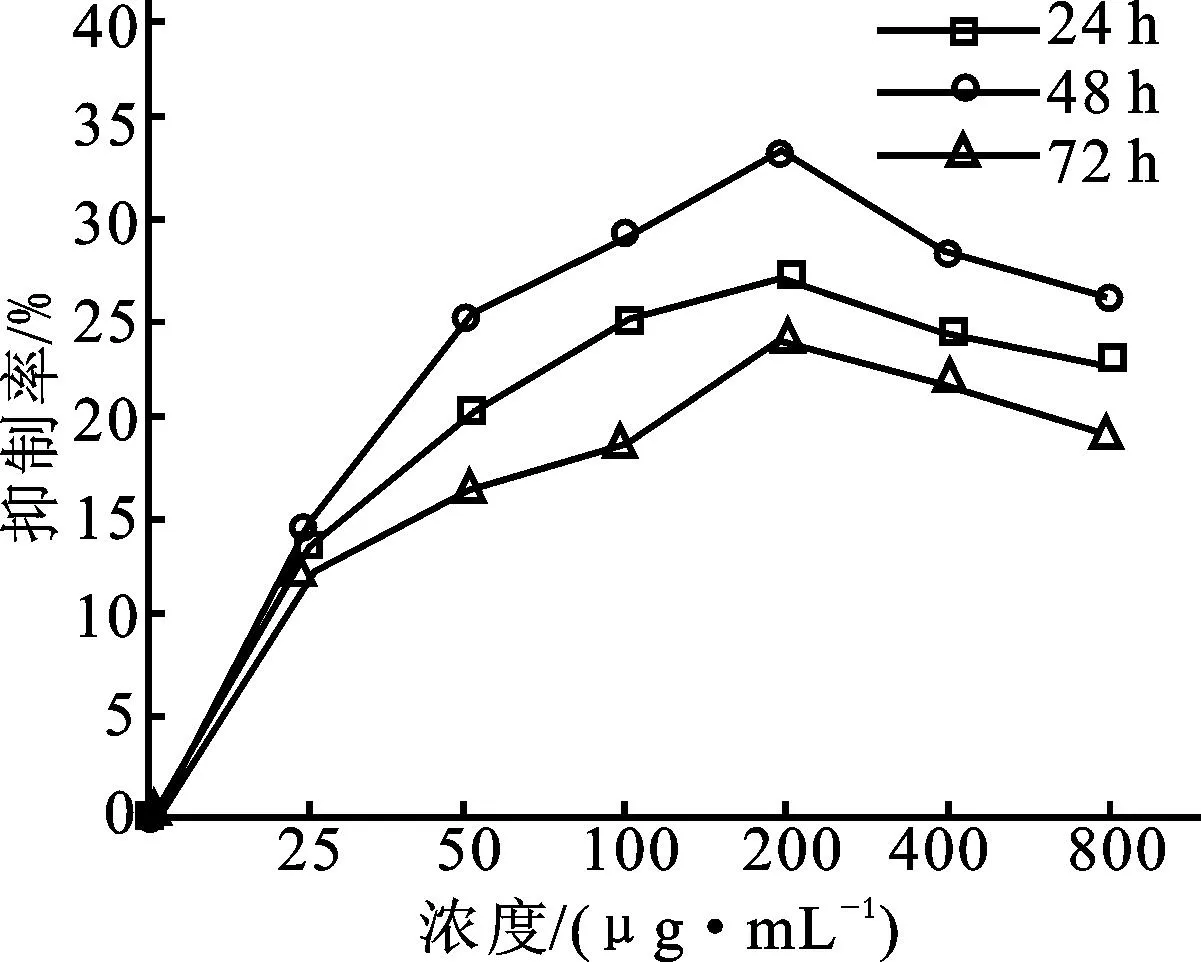
图5 S-PEAP对K562细胞的抑制效果Fig.5 Inhibition effects of S-PEAP against K562 cells
P-PEAP对人白血病K562细胞的体外抑制作用较为显著(如图6所示)。多糖浓度在25~400μg/mL范围内,多糖对细胞的抑制程度随浓度的递增而逐渐增大,当浓度为400μg/mL时,P-PEAP对人白血病K562细胞的抑制率达到最大,其中72h抑制率最大约为30.11%。在400~800μg/mL范围内,细胞生长抑制程度随着浓度增大反而逐渐减小,故P-PEAP多糖浓度为400μg/mL,作用时间为72h时,P-PEAP对白血病细胞K562显示出最大的抑制率。研究表明化学基团的引入也可能会增强多糖的活性,使多糖产生新的活性,磷酸化修饰是将磷酸基团引入多糖的残基上,但其具体的作用机制研究较少,有待得到进一步的研究。
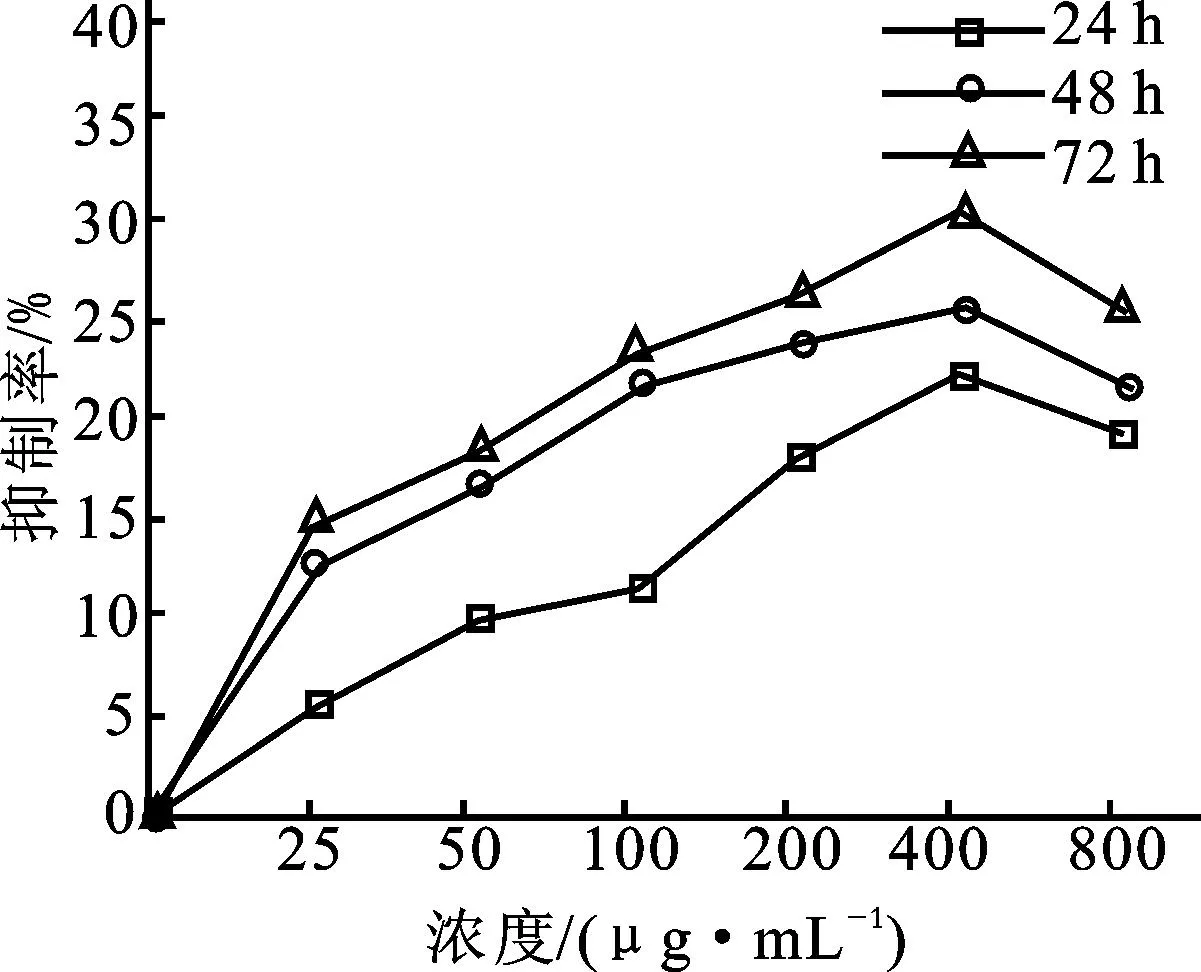
图6 P-PEAP对K562细胞的抑制效果Fig.6 Inhibition effects of P-PEAP against K562 cells
Ac-PEAP对白血病K562细胞的体外抑制作用最为显著。多糖溶液浓度在0~200μg/mL之间,Ac-PEAP对K562细胞的抑制活性与多糖浓度呈正相关,当浓度持续增大,Ac-PEAP对K562细胞的抑制作用逐渐减弱。Ac-PEAP对细胞的抑制作用在48h表现最为显著,结果见图7。魏文青等[29]的研究证明,肿瘤药物通常存在一个最佳的作用时间,肿瘤细胞的生长处于该时间时,抑制作用最强,先于或超过这个最佳作用时间点,抑制作用效果并不理想。Ac-PEAP作用时间48h时,浓度在200μg/mL抑制作用最强,达到35.32%。研究表明对多糖进行化学修饰后,引入不同类型的基团,有助于提高多糖的生物学活性,乙酰基的引入可以改变多糖的横次序和定向性,使活性基团暴露,最终影响多糖在水中的溶解性[30]。

图7 Ac-PEAP对K562细胞的抑制效果Fig.7 Inhibition effects of Ac-PEAP against K562 cells
3结论
多糖的生物活性与其结构和理化性质密切相关,杏鲍菇多糖经过化学修饰后,引入不同类型的基团后,原多糖结构发生变化,从而影响了多糖的抗肿瘤活性。本实验通过对杏鲍菇粗多糖进行结构修饰后研究其体外抗肿瘤活性,PEAP对人白血病细胞K562具有一定的抑制效果,特别是经化学修饰后对白血病细胞的抑制作用增强,其中Ac-PEAP浓度为200μg/mL和作用时间为48h时的抗肿瘤活性最强;硫酸化修饰与磷酸化修饰多糖的抗癌活性与对多糖C—H伸缩振动的取代度有关,硫酸化修饰完全取代抗癌活性最高,磷酸化修饰部分取代,抗癌活性次之。
参考文献:
[1]谢好贵,陈美珍,张玉强.多糖抗肿瘤构效关系及其机制研究进展[J].食品科学,2011,32(11):329-333.
[2]李循,孔繁智,朱婉萍.中药多糖抗肿瘤作用研究进展[J].中医杂志,2006,41(2):113-116.
[3]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1121.
[4]王超,康立源.中药多糖的药理学研究进展[J].世界科学技术:中医药现代化,2008,10(3):82-86.
[5]王万能,刘丹,杨颖,等.香菇多糖抗肿瘤活性的研究进展[J].重庆工学院学报,2008,22(1):161-163.
[6]刘占峰,孙汉文.多糖的化学修饰研究发展[J].河北大学学报:自然科学版,2005,25(1):104-108.
[7]王兆梅,李琳,胡松.多糖结构修饰研究进展[J].中国医药工业杂志,2002,33(12):616-620.
[8]WangYifeng,ZhangLina,LiYunqiao,etal.Correlationofstructuretoantitumoractivitiesoffivederivativesofaβ-glucanfromPoriacocossclerotium[J].CarbohydrateResearch,2004,339(15):2567-2574.
[9]ChenXiaoming,ZhangJian,TianGengyuan.StudiesonsynthesisandantitumoractivityofphosphorylatedAchyranthesbidentatapolysaccharide(P-AbPS)[J].ChineseJournalofChemistry,2002,20(11):1406-1410.
[10]AmandaLLewis,NizerVictor,AjitVarki.DiscoveryandcharacterizationofsilicaacidO-acetylationingroupBStreptococcus[J].ProceedingofNationalAcademyofSciencesoftheUnitedStatesofAmerica,2004,101(30):11123-11128.
[11]迟桂荣,徐琳,吴继卫,等.杏鲍菇多糖的抗病毒抗肿瘤研究[J].莱阳农学院学报,2006,23(3):174-176.
[12]姚自齐,兰进.杏鲍菇研究进展[J].食用菌学报,2004,11(1):52-58.
[13]阮家耀,王星离,瞿亮,等.杏鲍菇子实体的分离纯化及结构研究[J].食品与发酵工业,2014,40(4):77-81.
[14]章灵华,肖培根.药用真菌中生物活性多糖的研究进展[J].中草药,1992,23(2):95.
[15]盛伟,方晓阳.杏鲍菇菌丝体胞内与胞外多糖体外抗氧化活性研究[J].中国林副特产,2009,98(1):6-10.
[16]王凤芳.杏鲍菇中营养成分的分析测定[J].食品科学,2002,23(4):132-135.
[17]LiuXiaonan,ZhouBo,LinRongshan,etal.ExtractionandantioxidantactivitiesofintracellularpolysaccharidefromPleurotussp.Mycelium[J].InternationalJournalofBiologicalMacromolecules,2010,47(2):116-119.
[18]燕航,钟耀广,王淑琴,等.硫酸酯化香菇多糖衍生物制备的研究[J].化学与生物工程,2006,23(3):44-45.
[19]吴琼,代永刚.磷酸酯化修饰碱溶性银耳多糖的研究[J].食品科技,2010,35(3):75-77.
[20]曲瑾郁,任大明.蛹虫草多糖的化学修饰及体外抗氧化能力[J].食品科学,2011,32(15):58-61.
[21]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1998:200-240.
[22]司徒镇强.细胞培养[M].北京:世界图书出版公司,2007:1-362.
[23]李哲涛,张静,谢佳,等.两种苦瓜多糖对人白血病细胞体外增殖的影响[J].陕西师范大学学报:自然科学版,2013,41(2):76-81.
[24]马秀梓,李佳媚,李哲涛,等.3种中药多糖抗肿瘤作用的研究[J].陕西师范大学学报:自然科学版,2012,40(6):77-80.
[25]叶宪曾,张新祥.仪器分析教程[M].北京:北京大学出版社,2007:53-77.
[26]葛青,张安强,孙培龙.真菌多糖结构修饰及鉴定研究进展[J].中国食用菌,2008,27(1):5-8.
[27]周林,郭祀远,郑必胜,等.裂褶多糖的乙酰化及光谱分析[J].华南理工大学学报:自然科学版,2006,34(12):88-91.
[28]盛玉清,尹鸿萍,李海涛,等.螺旋藻多糖硫酸酯化修饰前后抗肿瘤及免疫活性的研究[J].药物生物技术,2006,13(2):107-111.
[29]魏文青,赵满仓,刘晶,等.肿瘤药物敏感试验的方法学研究[J].临床肿瘤学杂志,2008,13(10):871-874.
[30]郭晓强,何钢,姚倩.乙酰化银耳多糖的制备及取代度测定[J].食品工业科技,2013,34(12):225-227.
〔责任编辑李博〕
第一作者:苏玉波,男,硕士研究生,研究方向为资源环境遥感与GIS应用。E-mail:398444617@qq.com
StudiesoninhibitioneffectonK562cellsofchemical
modifiedpolysaccharideofPleurotuseryngii
CHENLin1,HAOChangchun1*,LIANGTao2,NANZheng1,SUNRunguang1
(1SchoolofPhysicsandInformationTechnology;
2SchoolofFoodEngineeringandNutritionalScience,ShaanxiNormalUniversity,
Xi′an710119,Shaanxi,China)
Abstract:ThepolysaccharideswereextractedfromPleurotuseryngiibyalkalisolution,thenweremodifiedbysulfation,phosphorylation,andacetylation.Thecorrespondingantitumoractivitieshavebeenstudied.ThestructureofmodifiedandunmodifiedPleurotuseryngiialkalipolysaccharide(PEAP)wastestedbytheinfraredspectroscopy.ThentheantitumorabilityweretestedbyMTTassayinvitro.Theresultsshowthatthecharacteristicabsorptionpeaksofsulfuricgroup,phosphategroupandacetylgroupwereobservedrespectively.Theabilityoftheanti-tumorHumanLeukemiaCellK562activityofthechemicalmodifiedPEAPwereallimprovedandtheacetylatedmodifiedPEAP(Ac-PEAP)hasthebestinhibitoryability.
Keywords:Pleurotuseryngii;polysaccharide;chemicalmodification;antitumoractivity
通信作者:*张福平,男,副教授。E-mail:zhangfuping@163.com
基金项目:陕西省“百人计划”项目;国家科技支撑计划(2012BAC08B07);中国博士后科学基金资助项目(2011M501496);中央高校基本科研业务费专项资金项目(GK201101002)
收稿日期:2014-07-15
doi:10.15983/j.cnki.jsnu.2015.02.421
文章编号:1672-4291(2015)02-0079-06
中图分类号:R273
文献标志码:A

