基于线粒体COⅠ~COⅡ序列的黑带食蚜蝇(Episyrphus balteatus)遗传多样性初探
张 卓, 胡建楠, 王晓昕, 周 婵, 刘广纯
(1. 沈阳大学 城市有害生物治理与生态安全重点实验室, 辽宁 沈阳 110044;
2. 辽宁大学 生命科学院, 辽宁 沈阳 110036)
基于线粒体COⅠ~COⅡ序列的黑带食蚜蝇(Episyrphusbalteatus)遗传多样性初探
张卓1, 胡建楠1, 王晓昕1, 周婵2, 刘广纯1
(1. 沈阳大学 城市有害生物治理与生态安全重点实验室, 辽宁 沈阳110044;
2. 辽宁大学 生命科学院, 辽宁 沈阳110036)
摘要:利用COⅠ的通用引物,采用PCR法对黑带食蚜蝇(Episyrphus balteatus)线粒体DNA序列进行扩增、测序及比对;4个不同地区的种群分析结果表明:①共获得1041个bp的DNA序列,A、T、G、C的比例分别为40.2%、30.1%、13.1%、16.6%,表现出明显的A+T偏倚性;②经过与GENEBANK已知序列比对,该片断位于线粒体的COⅠ~tRNALEU~COⅡ区域;③共检测到8处(N=20)碱基变异,已经产生了遗传差异,形成1个共有单倍型、7个特有单倍型;④NETWORK分析表明,已经产生明显的遗传分化.
关键词:黑带食蚜蝇; 遗传多样性; COⅠ~COⅡ; 种群; 生物地理
黑带食蚜蝇(Episyrphusbalteatus)隶属于双翅目(Diptera)、环裂亚目(Cyclorrhapha)、无缝组(Aschiza),蚜蝇科(Syrphidae).蚜蝇科又称为食蚜蝇科,是双翅目中较大的一个类群,全世界约230属,6 000余种[1].
黑带食蚜蝇是蚜蝇中较为常见的一个种类,其对蚜虫的捕食力极强,研究表明黑带食蚜蝇整个幼虫期可捕食棉蚜(AphisgossypiiGlover) 840~1 500头,是蚜虫的重要天敌[2];其次,黑带食蚜蝇成虫是仅次于蜜蜂的重要授粉昆虫,具有访花的习性,对个别植物而言,其作用大于蜜蜂.国外曾报道在欧芹(Petroselinumcrispum)传粉研究中,食蚜蝇传粉种子产量是蜜蜂的近3倍(蜜蜂传粉地块的种子产量为617 kg/hm2,蚜蝇传粉地块的种子产量为1 620 kg/hm2)[3].
线粒体是动物细胞核外唯一具有DNA的细胞器,并与细胞核进行一定的遗传物质交换,又保持相对独立的遗传体系,具有结构简单、进化速度快、母系遗传、基因重组率小等特点,其复制、转录和翻译在线粒体内,受自身和核基因的双重控制等特点[4-6].线粒体DNA被广泛用于种群遗传多样性的检测和研究当中去[7-10].
国内外对于黑带食蚜蝇的研究仅停留在野外识别[11-12]、新种描述[13]、新记录种分布[14]和物种修订[15]等方面,对于部分种类基于形态和分子数据进行了少量研究[16],而对于黑带食蚜蝇的遗传多样性研究还未见涉及.
本研究以黑色食蚜蝇线粒体DNA中的COⅠ~COⅡ片断为目的片断,进行遗传变异检测,探讨该片断在黑带食蚜蝇种群遗传差异检测的可行性和有效性,为黑带食蚜蝇的遗传多样性分析、生物地理演化和分子钟假设检验等相关问题奠定前期实验基础.本实验有利于对黑带食蚜蝇的认知,并为今后进行生物利用和生物防治做好准备.
1材料与方法
1.1 样品采集
样品采集地点(见表1).采用网捕法进行食蚜蝇的采集.收集到的样本放在无水乙醇中,-20 ℃冷冻保存至DNA提取前.
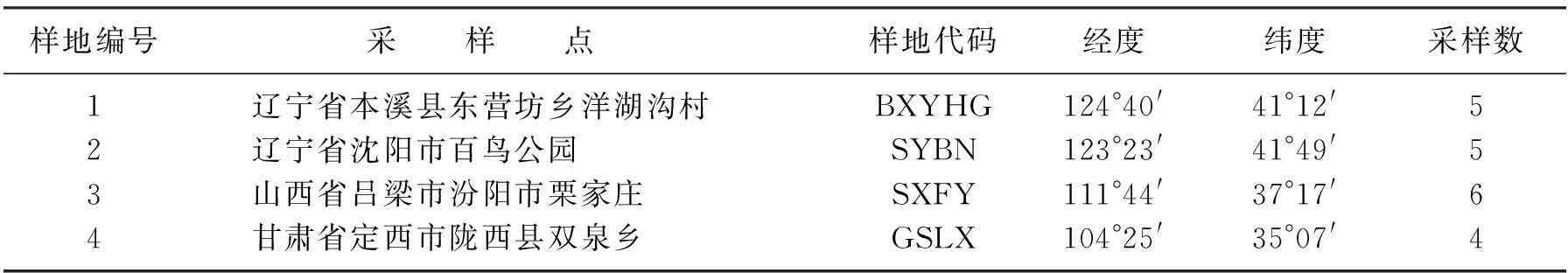
表1 采样点及经纬度
1.2 主要仪器
Agilent 8800梯度PCR扩增仪,STR16R小型台式高速冷冻离心机,海尔冰箱、KD-S24恒温水浴锅、BIO-RAD水平电泳仪、BIO-RAD GelDoc 2000凝胶成像系统、FA2004N电子分析天平、北京六一高压灭菌锅.
1.3 试剂和缓冲液
TaqDNA聚合酶、dNTPs,10×Reaction buffer缓冲液,Mg2+、6×Loading buffer均购于鼎国科技有限公司;1000 bp DNA Mark和蛋白酶K购于上海生工;0.5×TBE电泳缓冲液、琼脂糖、EB, SDS,NaCl、Tris-饱和酚、氯仿、异戊醇、异丙醇和无水乙醇均为国产分析纯.
引物由上海生工合成,DNA序列测定由鼎国科技有限公司北京总部测试完成.
1.4 方 法
1.4.1全基因组提取
剪取黑带食蚜蝇的3条腿,置于灭菌的2.0 mL离心管中;总量DNA采用常规酚—氯仿法进行,无水乙醇脱水晾干后,溶于100 μL的TE缓冲液中,抽取5 μL进行电泳检测,其余基因组样品放入-20 ℃冰箱保存到PCR前.
1.4.2引物选择及目标片段PCR扩增
根据双翅目COI的通用引物[17]选择LCO1490~HCO2198及LCO1490~HCO3014形成两对嵌套的引物对,引物序列如下:LCO1490(5′-GGTCAACAAATCATAAAGAT
ATTGG-3′)、HCO2198(5′-TAAACTTCAGG GTGACCAAAAAATCA-3′)和HCO3014(5′-TCCAATGCACTAATCTGCCATATTA-3′).
PCR(聚合酶链式反应)体系如下:10×buffer—5 μL,Mg2+(25 mmol)—1.8 μL,dNTP(2.5 mmol)—1 μL,上游引物(LCO1490,15 mmol)—1 μL,下游引物(HCO2198或HCO3014,15 mmol)—1 μL,Taq DNA聚合酶1 μL(2U/μL)—1 μL,模板DNA—3 μL,灭菌双蒸水补足至50 μL.
PCR扩增反应程序分为如下三个阶段:①预变性阶段,94 ℃,7 min;②扩增阶段,94 ℃变性60 s,55~59 ℃复性30 s,72 ℃延伸60 s,共运行35~40个循环;③后延伸阶段,72 ℃延伸7 min.PCR产物用1.5%琼脂糖凝胶进行电泳检测(见图1).PCR产物送鼎国科技有限公司北京总部进行测定.

图1 PCR产物电泳图
1.4.3DNA序列测定与比对
采用SEQUENCE 4.0.5软件对序列测定结果进行人工较对;利用GENEBANK中的BLAST功能进行序列比对与分析;采用Clastal W 1.83软件进行DNA序列对齐;采用NETWORK 4.6.1.2软件进行网络进化分析;采用MEGA 6.06软件进行系统发育进化树的构建.
2结果与分析
2.1 核苷酸组成及分析
(1) PCR产物经ABI377进行序列测定后,经SEQUENCE 4.0.5软件进行两端DNA序列拼接及人工较对,共获得1 041个bp的基因片断,经过与GENEBANK已经序列比对,该片断位于线粒体的COⅠ~tRNALEU~COⅡ区域;
(2) 对1 041个bp DNA碱基序列分析表明: A,T,G,C比例分别为40.2%,30.1%,13.1%,16.6%,A+T=70.3%,表现出明显的A+T偏倚性;
(3) 定义了8个单倍型(N=20), 包括7个特有单倍型和1个共有单倍型[包括13个个体(其中SYBN 3个、SXFY 5个、GSLX 2个、BXYHG 3个)];
(4) 与共有单倍型相比较,检测到8处碱基变异(n=20),分别处于第4 bp、26 bp、65 bp、148 bp、166 bp、290 bp、899 bp和1 008 bp处;
(5) 在COⅠ~tRNALEU~COⅡ基因片断上,黑带食蚜蝇20个个体中有7个产生了突变,其比例达到35%(7/20),已经产生了明显的分化.因此,这一区段的突变比例达到检测种群内遗传多样性的要求.
2.2 单倍型网络关系分析
在NETWORK 4.6.1.2软件中,以Median Joining法进行网络进化分析,结果表明,7个特有单倍型通过1到2步突变与共有单倍型聚在一起(见图2).已经形成明显的网格状分化.但并没有形成明显的地理分化.

图2 黑带食蚜蝇(Episyrphus balteatus)
2.3 单倍型系统进化树构建
利用MAGE 6.06软件进行UPGMA、NJ、ME、ML和MP树的构建,获得类似的拓扑结构树(以UPGMA树为例),如图3所示.
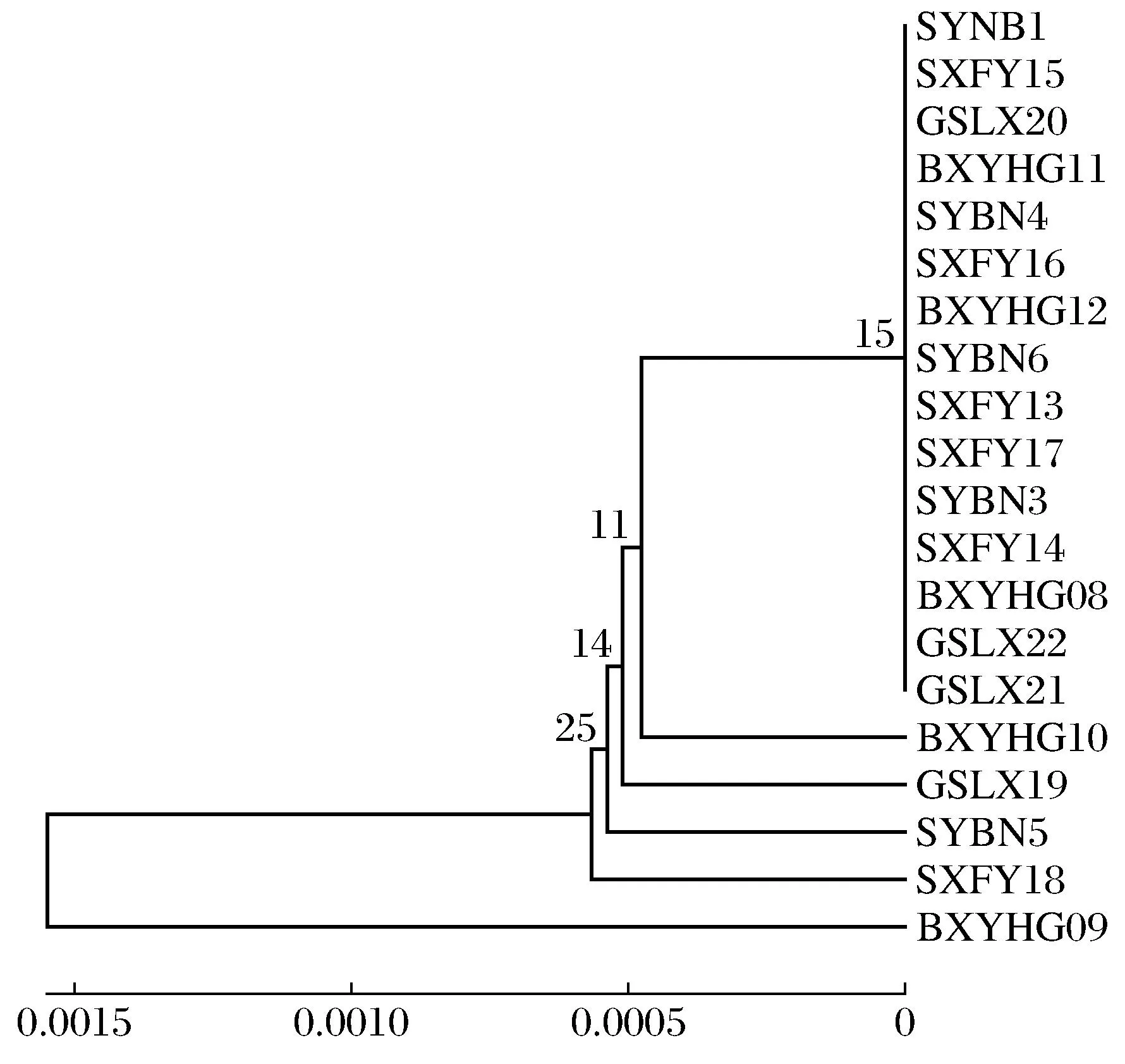
图3 黑带食蚜蝇(Episyrphus balteatus)
结果表明,本研究的4个样点,20个个体的样本库并没有形成明显的地理结构,这与取样个体过少有关,当增大取样量后有可能会形成一个明显的地理谱系.
3结论
分析的片断位于线粒体的COⅠ~tRNALEU~COⅡ区域,A+T达70.3%,表现出明显的A+T偏倚性,符合昆虫纲线粒体DNA的总体规律;网络进化分析表明,已经产生明显的地理分化.
因此,以本研究中的两对嵌套引物,对黑带食蚜蝇线粒体COⅠ~tRNALEU~COⅡ区域进行PCR扩增并进行DNA序列的测定、比对,适于进行黑带食蚜蝇的种群遗传多样性研究.本研究为黑带食蚜蝇的种群线粒体DNA遗传多样性研究奠定了前期理论基础.
参考文献:
[ 1 ] 霍科科,任国栋,郑哲民. 秦巴山区蚜蝇区系分类[M]. 北京:中国农业科学技术出版社, 2007:146-150.
(Huo Keke, Ren Guodong, Zheng Zhemin. Fauna of Syrphidae from Mt. Qinline-Bashan in China (Insecta: Diptera)[M]. Beijing: China’s Agricultural Science and Technology Press, 2007:146-150.)
[ 2 ] 曾强,陈乾锦,何榕宾,等. 黑带食蚜蝇对烟蚜的捕食功能反应及寻找效应[J]. 武夷科学, 2003,19(1):274-278.
(Zeng Qiang,Chen Qianjin,He Rongbin,et al. The Predatory Functional Response and Searching Efficiency ofEpisyrphusbalteatus(Degeer) onMyzuspersicae(Sulzer)[J]. Wuyi Science Journal, 2003,19(1):274-278.)
[ 3 ] 浦子钢,迟莉. 食蚜蝇(Syrphidae)生物学特性及人工室内饲养技术的研究进展[J]. 黑龙江农业科学, 2006(5):120-123.
(Pu Zigang,Chi Li. Study on Biological Characters ofSyrphidaeand the Advances of Manpower Rearing Technique Indoor[J]. Heilongjiang Agricultural Sciences, 2006(5):120-123.)
[ 4 ] 殷玲,吉挺,陈晶,等. 蜜蜂线粒体DNA在遗传分析中的应用[J]. 昆虫知识, 2008,45(5):708-712.
(Yin Ling,Ji Ting,Chen Jing, et al. Applications of mtDNA in Honeybee Genetic Analysis[J]. Chinese Bulletin of Entomology, 2008,45(5):708-712.)
[ 5 ] Capps G J,Samuels D C,Chinnery P F.A Model of the Nuclear Control of Mitochondrial DNA Replication[J]. Journal of Theoretical Biology, 2003,221(4):565-583.
[ 6 ] 郭松长,祁得林,陈桂华,等. 家牦牛线粒体DNA(mtDNA)遗传多样性及其分类[J]. 生态学报, 2008,28(9):4286-4294.
(Guo Songchang, Qi Delin, Chen Guihua, et al. Genetic Diversity and Classification of Domestic Yaks Inferred from Mitochondrial DNA Sequences[J]. Acta Ecologica Sinica, 2008,28(9):4286-4294.)
[ 7 ] 徐国威,周丹银,刘意秋,等. 基于线粒体DNA(mtDNA)COⅠ~COⅡ分析四川省东方蜜蜂遗传多样性[J]. 云南农业大学学报, 2014,29(1):63-70.
(Xu Guowei,Zhou Danyin,Liu Yiqiu,et al. Genetic Diversity ofApisceranain Sichuan Province Based on Mitochondrial DNA Sequence COI~COⅡ[J]. Journal of Yunnan Agricultural University, 2014,29(1):63-70.)
[ 8 ] 管成林,李继姬,郭宝英,等. 基于线粒体COⅠ基因比较分析野生与养殖厚壳贻贝种群的遗传多样性[J]. 安徽农业科学, 2012(13):7660-7662.
(Guan Chenglin, Li Jiji, Guo Baoying, et al. Genetic Diversity Evaluation by the Comparative Analysis on Mitochondrial COⅠ Gene between Wild and Cultured Populations ofMytiluscoruscus[J]. Journal of Anhui Agricultural University, 2012(13):7660-662.)
[ 9 ] 屠云洁,高玉时,周新民,等.我国6个地方鸡品种线粒体COⅠ基因遗传多样性分析[J]. 扬州大学学报:农业与生命科学版, 2007,28(3):31-33.
(Tu Yunjie,Gao Yushi,Zhou Xinmin,et al. The Genetic Diversity Analysis of mtDNA COⅠ Genes in Six Indigenous Chicken Breeds in China[J]. Journal of Yangzhou University: Agricultural and Life Science Edition, 2007,28(3):31-33.)
[10] 姜石生. 基于线粒体DNA的16S rRNA、COⅠ和COⅡ基因的黄脊竹蝗5地理种群遗传多样性研究[D]. 长沙:中南林业科技大学, 2011:1-75.
(Jiang Shisheng. Study on Genetic Diversity ofRammeacriskiangsuof 5 Geographical Populations Based on Partial Sequences of 1 6S rRNA Gene,COⅠ Gene,and COⅡ Gene[D]. Changsha: Central South University of Forestry and Technology, 2011:1-75.)
[11] 霍科科,任国栋. 陕西秦岭太白山北坡食蚜蝇科昆虫区系调查[J]. 昆虫知识, 2006,43(5):700-705.
(Huo Keke,Ren Guodong. Faunal Study on Syrphids of the North Slope of Taibai,Qinling Mountains of Shaanxi[J]. Chinese Bulletin of Entomology, 2006,43(5):700-705.)
[12] 高欣,张春田. 辽宁食蚜蝇科昆虫名录(双翅目:食蚜蝇科)[J]. 四川动物, 2006,25(1):114-115,127.
(Gao Xin, Zhang Chuntian. Note on Ayrphidae from Liaonin Province (Diptera:Syrphidae)[J]. Sichuan Journal of Zoology, 2006,25(1):114-115,127.)
[13] 白素芬,张国威,李欣,等. 河南省食蚜蝇科3个新记录属和12个新记录种[J]. 河南农业科学, 2011,40(7):86-89.
(Bai Sufen,Zhang Guowei,Li Xin,et al. Three Genera and Twelve Species of Syrphid F1ies (Diptera:Syrphidae) Newly Recorded from Henan Province[J]. Journal of Henan Agricultural Sciences, 2011,40(7):86-89.)
[14] 陈玉宝,高文韬,张义涛,等. 食蚜蝇科中国一新纪录种(双翅目:食蚜蝇科)[J]. 北华大学学报:自然科学版, 2014,15(2):238-239.
(Chen Yubao, Gao Wentao, Zhang Yitao, et al. A New Record Species of Hoverfly in China (Diptera:Syrphidae)[J]. Journal of Beihua University (Natural Science), 2014,15(2):238-239.)
[15] 张宏杰,霍科科. 食蚜蝇科的分类系统及其研究进展[J]. 昆虫知识, 2005,42(2):132-138.
(Zhang Hongjie, Huo Keke. The Classification Systems ofSyrphidaeand Advance in the Related Researches[J]. Chinese Bulletin of Entomology, 2005,42(2):132-138.)
[16] 成新跃,吕静,黄春梅,等. 基于形态和分子数据确定缩颜蚜蝇族的系统分类地位[J]. 中国科学:C辑, 1999,29(6):645-654.
(Cheng Xinyue, Lyu Jing, Huang Chunmei. System Classification Status of Pipizini Family Based on Morphological and Molecular Data[J]. Science in China:Series C, 1999,29(6):645-654.)
[17] Folmer O, Black M, Hoen W, et al. DNA Primers for a Mplification of Mitochondrial Cytochrome c Oxidase Subunit I from Diverse Metazoan Invertebrates[J]. Molecular Marine Biology and Biotechnology, 1994,3(5):294-299.
【责任编辑: 曹一萍】
Genetic Diversity ofEpisyrphusbalteatusBased on Mitochondrial DNA Sequence COⅠ~COⅡ
ZhangZhuo1,HuJiannan1,WangXiaoxin1,ZhouChan2,LiuGuangchun1
(1. Liaoning Key Laboratory of Urban Integrated Pest Management and Eco-Security, Shenyang University, Shenyang 110044, China; 2. College of Life Science, Liaoning University, Shenyang 110034, China)
Abstract:Mitochondrial DNA of Episyrphus balteatus population from four areas were amplified, sequenced and compared with COⅠ universal primer. The results show that there was 1041bp in DNA sequences of four populations. The percentage of A, T, G, C were 40.2%, 30.1%, 13.1%, and 16.6%, respectively. And DNA sequences showed obvious bias on A+T. Sequence alignment in GENEBANK showed that DNA sequences was located in the mitochondrial COⅠ~tRNALEU~COⅡ region. Eight bases had variations, which indicated that population had genetic differences with one common haplotype and seven special haplotypes. NETWORK analysis showed that four populations had significant genetic differentiation.
Key words:Episyrphus balteatus; genetic diversity; COⅠ~COⅡ; population; biogeography
收稿日期:2014-12-20
中图分类号:Q 95
文献标志码:A
作者简介:张卓(1976-),男,吉林通化人,沈阳大学讲师,博士; 刘广纯(1959-),男,辽宁绥中人,沈阳大学教授.
基金项目:国家自然科学基金资助项目(31071965,81102296); 2014年辽宁省创新创业项目(201411035000030); 沈阳大学博士启动基金资助项目(1120212341).
文章编号:2095-5456(2015)02-0116-04

