绿色木霉、红芝、酵母三菌混合发酵稻草秸秆生产蛋白饲料条件的研究
孟顺利,张力,史兆国,韩大勇,刘海霞,赵连娣,王美娟
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.江苏农牧科技职业学院,江苏 泰州 225300)
绿色木霉、红芝、酵母三菌混合发酵稻草秸秆生产蛋白饲料条件的研究
孟顺利1,张力2,史兆国1,韩大勇2,刘海霞2,赵连娣1,王美娟2
(1.甘肃农业大学动物科学技术学院,甘肃 兰州730070;2.江苏农牧科技职业学院,江苏 泰州225300)
摘要:试验首先研究了绿色木霉、红芝共同发酵对秸秆中的纤维素、半纤维素、木质素降解的影响,然后进行了二次发酵接种酵母生产蛋白饲料条件的研究.结果表明:绿色木霉、红芝接种比例为1∶4、接种量为35%、共同发酵时间8 d、二次发酵时,酵母接种量7%、发酵时间为24 h时培养基的真蛋白含量最高.
关键词:绿色木霉;红芝;酵母;降解率;蛋白饲料
第一作者:孟顺利(1988-),男,硕士研究生,研究方向为动物营养与饲料科学.E-mail:719957159@qq.com
Study on conditions for protein feed production by mixed
我国作为一个农业大国,农作物的秸秆资源非常丰富,在饲料中的应用前景极为广阔[1],但是因为秸秆中含有大量的纤维素、半纤维素、木质素导致其直接利用价值很有限,据统计全世界每年产生大约20亿t各种秸秆[2],而其中只有一小部分被用于饲喂家畜,大约2/3被焚烧和浪费,造成了严重的环境污染.所以能否充分地对秸秆中的纤维素、半纤维素、木质素进行降解是提升其利用价值的关键.目前减少秸秆中的纤维素、半纤维素、木质素的主要方法就是通过微生物发酵方法,绿色木霉是降解秸秆中的纤维素效果比较好的菌种之一.而秸秆中木质素与半纤维素以共价键的形式结合,把纤维素分子包埋在其中,形成一种屏障,使纤维素酶不容易与纤维素分子接触,木质素的化学结构的复杂性、非水溶性导致了秸秆的难降解性[3].所以要想彻底降解纤维素,首先要解决木质素的降解问题.白腐真菌能够很好地降解木质素[4],红芝属于白腐真菌,对木质素也有很强的降解能力,因此选择绿色木霉和红芝二菌共同培养能够提高秸秆的降解率.韦丽敏[5]研究发现绿色木霉和白腐真菌在琼脂培养基上能够共生,没有拮抗作用,而绿色木霉的生长速度快于白腐真菌,在采用二次发酵方法发酵秸秆时发现秸秆中的木质素降解率达到49.06%,纤维素的降解率提高了11.24%.何桂霞[6]研究发现绿色木霉和白腐真菌共同发酵秸秆其纤维素、半纤维素、木质素的降解率分别达到41.6%、36.35%和51.9%.
绿色木霉在降解纤维素的过程中会产生纤维二糖,纤维二糖可以产生竞争性反馈抑制作用,即纤维二糖与能分解长链纤维的外切葡聚糖酶的活性中心结合,从而使长链纤维很难再与外切葡聚糖酶结合,最终影响了秸秆中纤维素的降解率,不过这种抑制是可逆的.如果加入足够量的β-葡萄糖苷酶或者引入可以利用纤维二糖的微生物消耗掉纤维二糖,则秸秆的纤维素降解率可以提高[7].产朊假丝酵母则可以快速地吸收和利用掉纤维二糖,酵母本身也可以进行快速地繁殖生长,从而转化成单细胞蛋白.李亚蕾等[8]利用绿色木霉和酵母发酵玉米秸秆生产单细胞蛋白饲料,秸秆中纤维素的降解率和蛋白含量都有所提高.廖雪义等[9]利用木霉和酵母混合发酵秸秆生产蛋白饲料中,其发酵终产物中粗蛋白含量从4.2%提高到19.7%,粗纤维含量从36.2%下降到24.1%.陶蕾等[10]利用复合菌剂发酵玉米秸秆发现秸秆中的纤维素下降了9.31%、粗蛋白含量增加了3.64%,奶牛头均产量提高了48.6 kg.所以利用微生物的环境适应能力强、操作简单、成本低、发酵效率高等特点[11],首先用绿色木霉和白腐真菌对秸秆进行发酵,降解其中的纤维素、半纤维素、木质素,然后对秸秆进行二次发酵生产蛋白饲料,不仅可以降低处理秸秆的成本,还可以增加秸秆的利用价值,具有很大的可行性.
目前研究较多的是霉菌和酵母对秸秆进行发酵生产蛋白饲料[12-13],而白腐真菌和酵母的研究较少[14].鉴于此,本研究先对绿色木霉、红芝降解稻草秸秆中的纤维素、半纤维素、木质素的条件进行初步研究,然后进行正交试验得出能够降解秸秆中纤维素、半纤维素、木质素的最优方案,再进行二次发酵接种酵母的单因素试验及正交试验,最终得出适合于发酵生产蛋白饲料的最终方案.
1材料和方法
1.1试验材料
1.1.1菌种绿色木霉X-57、红芝(江苏农牧科技职业实验室保存),热带产朊假丝酵母(广东微生物菌种中心提供,江苏农牧科技职业实验室保存).
1.1.2培养基PDA培养基:称取去皮新鲜土豆200 g,切成小块,加水至1 L,煮沸30 min.用纱布过滤后加20 g葡萄糖、20 g琼脂粉,在电炉上加热至琼脂溶化,加水补足1 L[15].分装至已空消过的试管中,置灭菌锅中121 ℃灭菌20 min.倾斜静置,待凝固后备用.
绿色木霉液体种子培养基:葡萄糖15 g,蛋白胨10 g,酵母膏10 g,硫酸铵2.5 g,磷酸二氢钾6 g,氯化钙1 g,七水硫酸镁0.8 g,碳酸钙0.4 g,加水溶解定容至1 L,调节pH至4.8.分装入250 mL三角瓶中,装液量为50 mL/瓶.121 ℃灭菌30 min.
红芝液体种子液培养基:去皮马铃薯200 g,煮沸30 min,纱布过滤,加入20 g蔗糖,融化后补水至1 000 mL,自然pH值,加入10 g秸秆粉,100 mL分装250 mL三角瓶,121 ℃间歇灭菌[5].
YPD酵母菌种子液培养基:蛋白胨2%,葡萄糖2%,酵母膏1%,水95%.115 ℃灭菌30 min[16].
固体发酵培养基:稻草粉400 g:麸皮100 g,溶于1 L水,自然pH值,硫酸铵10 g,磷酸二氢钾2.5 g,碳酸钙2.5 g,七水硫酸镁1.25 g,氯化钴0.5 g,充分搅拌,分装到250 mL三角瓶中,每瓶装25 g,121 ℃灭菌60 min.
1.1.3溶液配制中性洗涤剂:称取18.6 g乙二胺四乙酸二钠和6.8 g四硼酸钠,放入烧杯加少量水加热溶解后,再加入30 g十二烷基硫酸钠和10 mL乙二醇乙醚,再称取4.56 g无水磷酸氢二钠,放入另一个烧杯,加入少量的蒸馏水,加热溶解后倒入上一个烧杯,定容到1 000 mL.
酸性洗涤剂:将20 g十六烷基三甲基溴化铵溶于标定过的1 000 mL 0.5 mol/L硫酸溶液中充分搅拌[17].
1.1.4主要仪器和设备高压灭菌器(上海博迅实业有限公司,YXQ-LS-50SⅡ);生化培养箱(上海三发科学仪器有限公司,SHP-160);数显恒温振荡器(上海梅香仪器有限公司,THZ-82A).
1.2试验方法
1.2.1菌种的活化将保存的菌种接种到PDA斜面培养基上,在28 ℃培养7 d,再转接,一般转接活化2~3次,于4 ℃保存备用[15].
1.2.2种子液的制备用接种环接种一环绿色木霉和红芝分别接种在绿色木霉和红芝液体种子培养基里面,在28 ℃分别培养3 d和5 d.
接种一环假丝酵母与YPD酵母菌种子液培养基里并与28 ℃培养20 h.
1.2.3固体发酵将发酵好的种子液分别接种到固体发酵培养基在28 ℃进行培养.
1.2.4单因素接种绿色木霉和红芝的试验
1.2.4.1绿色木霉和红芝接种比例对稻草纤维素、半纤维素、木质素降解率的影响其他条件不变,按照绿色木霉∶红芝为1∶2、1∶3、1∶4、1∶5、1∶6分别接种到固体发酵培养基,接种量为20%,在28 ℃下培养6 d时测定其纤维素、半纤维素、木质素的降解率.本试验共有5个处理,每个处理有3个重复.
1.2.4.2绿色木霉和红芝接种量对稻草纤维素、半纤维素、木质素降解率的影响其他条件不变,按照绿色木霉∶红芝为1∶4的比例,总接种量分别为15%、20%、25%、30%、35%的比例接种到固体发酵培养基,在28 ℃下培养6 d时测定其纤维素、半纤维素、木质素的降解率.本试验共5个处理,每个处理3个重复.
1.2.4.3绿色木霉和红芝共同培养时间对稻草纤维素、半纤维素、木质素降解率的影响其他条件不变,按照绿色木霉∶红芝为1∶4的比例,总接种量为20%的比例接种到固体发酵培养基,28 ℃下培养,在培养2、4、6、8、10 d时测定其纤维素、半纤维素、木质素的降解率.本试验共有5个处理,每个处理有3个重复.
1.2.5多因素正交试验结合单因素影响试验结果,选取其中对纤维素、半纤维素、木质素降解率影响较大的因素,即接种比例为1∶3、1∶4、1∶5,发酵时间为4、6、8 d,接种量为20%、25%、30%,进行多因素共同作用下的L9(33)优化组合正交试验,对不同因素水平组合条件下的纤维素、半纤维素、木质素降解率进行测定.试验共9个处理,每处理3个重复.
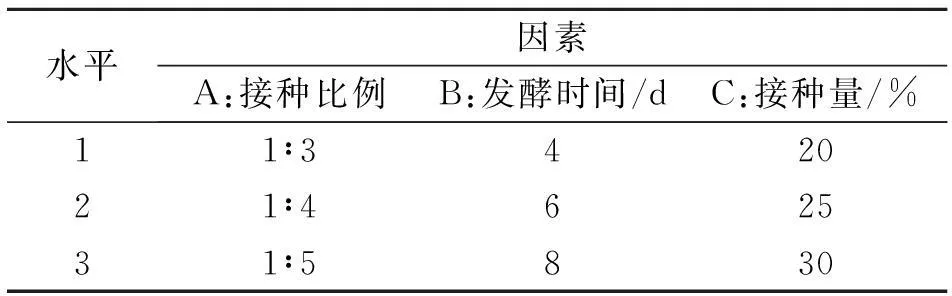
表1 共同培养正交试验水平设计
1.2.6单因素接种酵母试验
1.2.6.1酵母接种时间对固体发酵培养基中真蛋白含量的影响在绿色木霉和红芝发酵最优组合的基础上,其他条件不变,在发酵2、4 、6、8、10 d时分别接种假丝酵母,酵母接种量(培养基:酵母的质量体积比)为3%,在发酵24 h时测定培养基的真蛋白含量.本试验共5个处理,每个处理3个重复.
1.2.6.2酵母接种量对固体发酵培养基中真蛋白含量的影响在绿色木霉和红芝发酵最优组合的基础上,其他条件不变,在固体培养基发酵6 d的时候以酵母接种量为1%、3%、5%、7%、9%的比例分别接种到培养基,在发酵24 h时测定培养基的真蛋白含量.本试验共5个处理,每个处理3个重复.
1.2.6.3酵母接种后发酵时间对固体发酵培养基中真蛋白含量的影响在绿色木霉和红芝发酵最优组合的基础上,其他条件不变,在固体培养基发酵6 d的时候接种3%的假丝酵母,在发酵12、24、36、48、60 h时测定培养基的真蛋白含量.本试验共5个处理,每个处理3个重复.
1.2.7多因素正交试验结合单因素影响的试验结果,选取其中对发酵培养基中真蛋白含量影响较大的因素,接种时间为4、6、8 d,接种量为3%、5%、7%,发酵时间为24、36、48 h,进行多因素共同作用下的L9(33)优化组合正交试验,对不同因素水平组合条件下的真蛋白含量分别测定.本试验共9个处理,每个处理3个重复.

表2 接种酵母发酵正交试验设计
1.2.8纤维素、半纤维素、木质素、真蛋白含量的测定将培养好的固体培养基进行80 ℃烘干,测定其纤维素、半纤维素、木质素、真蛋白含量的含量,测定方法见张丽英主编[16]的《饲料分析及饲料质量检测技术》.
1.3数据处理
采用软件SPSS 19.0对单因素试验的数据进行方差分析,对正交试验的数据进行极差分析.
2结果与分析
2.1单因素接种绿色木霉、红芝试验结果
2.1.1绿色木霉和红芝接种比例对稻草纤维素、半纤维素、木质素降解率的影响如表3所示,绿色木霉、红芝在接种比例为1∶4时稻草秸秆的纤维素、半纤维素、木质素降解率最高,分别为29.01%、27.70%、39.23%.纤维素降解率随着绿色木霉、红芝接种比例的升高呈现先升高后降低的趋势,在接种比例为1∶4时与1∶2、1∶6差异显著(P<0.05).半纤维素降解率在接种比例为1∶4时与1∶3、1∶5差异显著(P<0.05),与其他比例差异不显著.木质素降解率在接种比例为1∶4时与1∶5、1∶6差异显著(P<0.05),因此,绿色木霉、红芝最适的接种比例为1∶4.
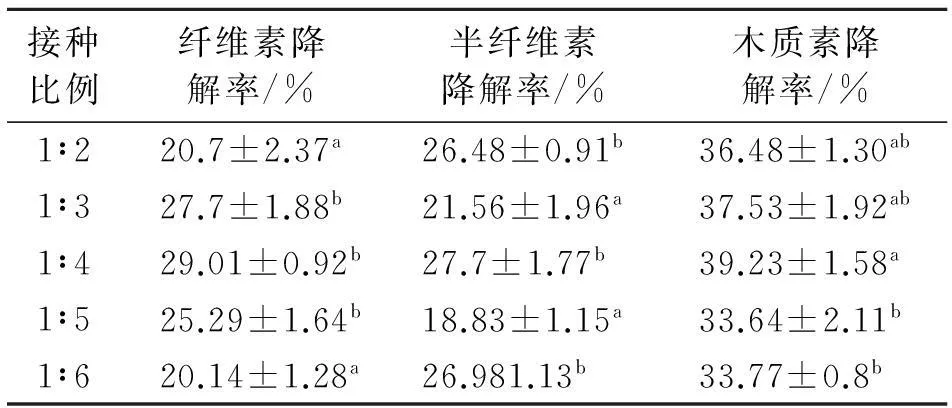
表3 不同接种比例对稻草纤维素、半纤维素和
同列数据肩标不同字母表示差异显著(P<0.05).
2.1.2绿色木霉、红芝接种量对稻草纤维素、半纤维素和木质素降解率的影响结果如表4所示,纤维素降解率在接种量为25%时与其他接种量差异显著(P<0.05),纤维素的降解率最高是22.95%.半纤维素降解率在接种量为25%时与其他接种量差异显著(P<0.05),半纤维素的降解率最高是42.48%.木质素的降解率在接种量为25%时与15%、30%、35%的接种量对秸秆的降解率差异显著(P<0.05),木质素降解率最高为30.32%.因此在接种量为25%时秸秆的纤维素、半纤维素、木质素的降解率都是最高的.
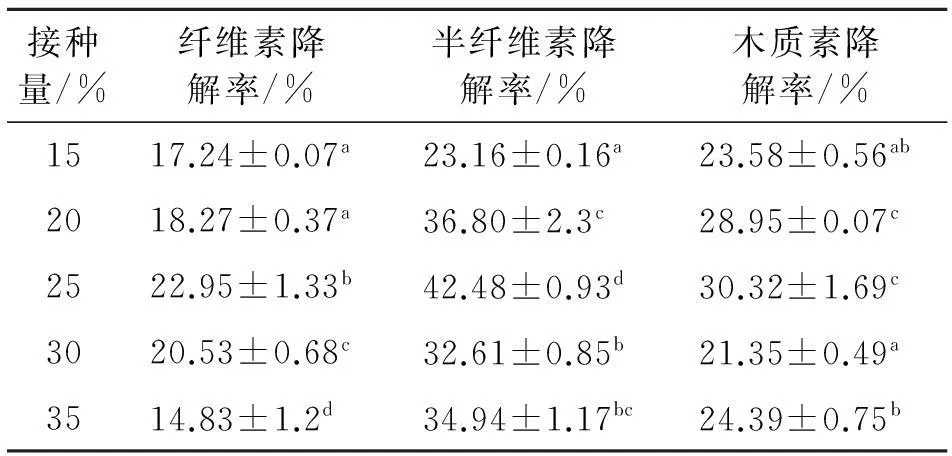
表4 不同接种量对稻草纤维素、半纤维素和
同列数据肩标不同字母表示差异显著(P<0.05).
2.1.3绿色木霉、红芝共同培养时间对稻草纤维素、半纤维素和木质素降解率的影响如表5所示,随着培养时间的增加,秸秆的纤维素、半纤维素、木质素的降解率都逐渐的升高,当培养6 d后纤维素和半纤维素的降解率组内差异都不显著(P>0.05),降解率增长的速度也越来越慢.木质素降解率在培养10 d时是最高,与其他培养时间差异显著(P<0.05).但是升高速度减慢,考虑的培养时间的成本,选择培养6 d为最合适.
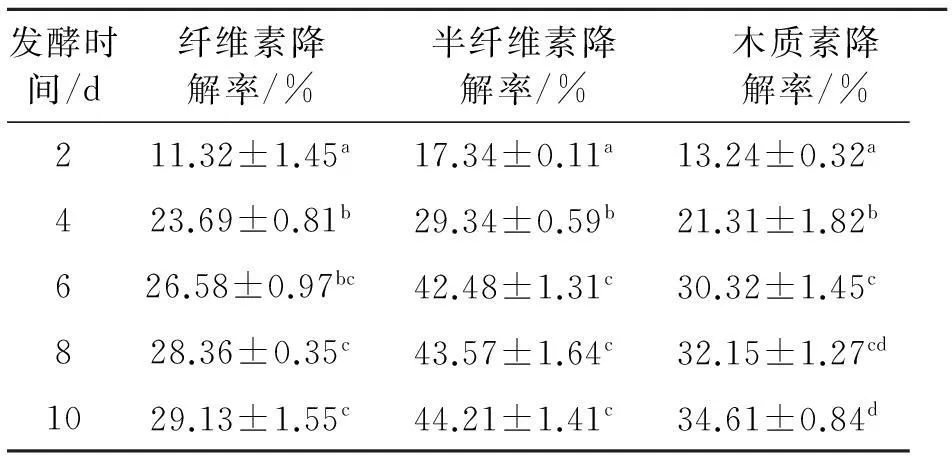
表5 不同培养时间对稻草纤维素、半纤维素和
同列数据肩标不同字母表示差异显著(P<0.05).
2.1.4多因素正交试验结果比较各个因素水平均值,求出每个因素的最大平均值,可以得出培养基的最优方案(表6).其最优方案为A2B2C3,即接种比例1∶4,发酵时间6 d,接种量35%.通过分析,列出各个因素对指标影响的大小.从表6中可以看出,对纤维素降解率的影响是RC>RA>RB,可以得出接种量对纤维素的降解率影响最大,然后是接种比例、培养时间;对半纤维素降解率影响是RB>RA>RC,即发酵时间影响最大,然后是接种比例、接种量;对木质素降解率影响是RB>RC>RA,即培养时间影响最大,然后是接种量、接种比例.
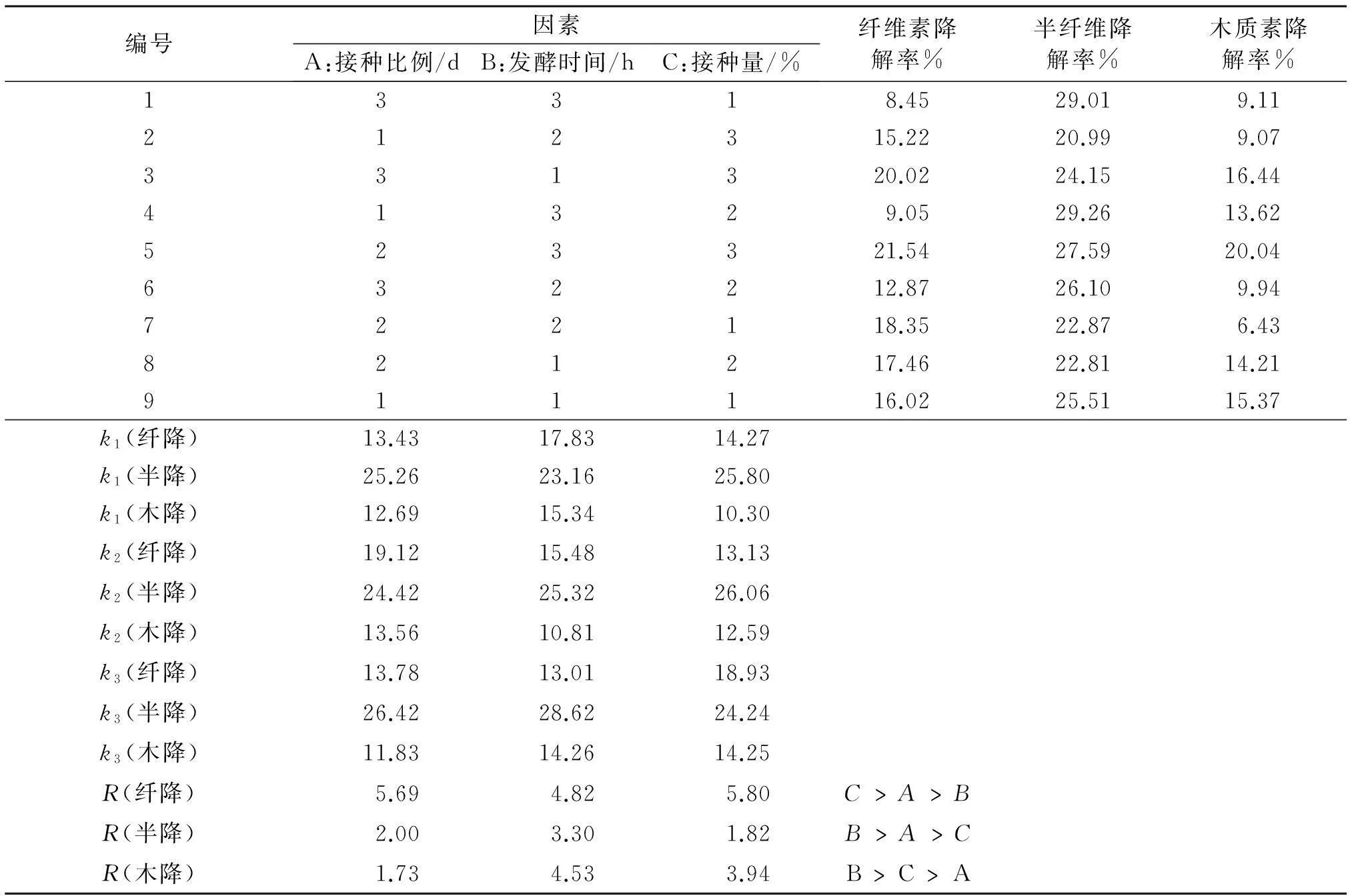
表6 共同培养正交试验结果
半降为半纤维素降解率,纤降为纤维素降解率,木降为木质素降解率.
2.2单因素接种酵母试验结果
2.2.1酵母接种时间对固体发酵培养基中真蛋白含量的影响由表7可知,随着绿色木霉、红芝培养时间的增加,分别在第2、4、6、8、10天接种酵母其真蛋白含量呈现逐渐增加的趋势,最高是在第8天达到10.14%,而第10天出现降低,第2天最少与其他接种时间差异显著(P<0.05),其他接种时间之间差异不显著(P>0.05).
2.2.2酵母接种量对固体发酵培养基中真蛋白含量的影响由表8可知,随着接种量的增加,真蛋白含量也增加,而在接种量为5%以后再增加接种量时其真蛋白含量基本持平差异不显著(P>0.05),所以以节约为准则,应选5%的接种量.
2.2.3酵母接种后发酵时间对固体发酵培养基中真蛋白含量的影响从表9可知,随着发酵时间的延长,在前36 h内其真蛋白含量和发酵时间成正相关,之后基本处于稳定状态,在48 h时达到最高.发酵12 h时与其他发酵时间差异显著(P<0.05),而在发酵24、36、48、60 h之间差异不显著(P>0.05).
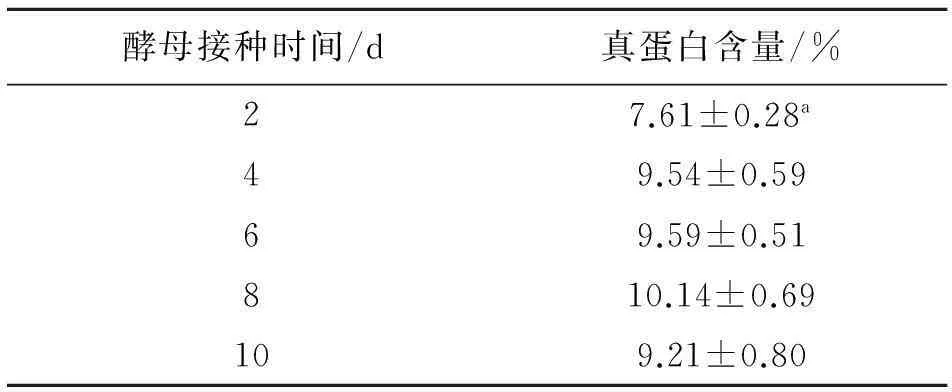
表7 不同接种时间对培养基中真蛋白含量的影响
同列数据肩标不同字母表示差异显著(P<0.05).
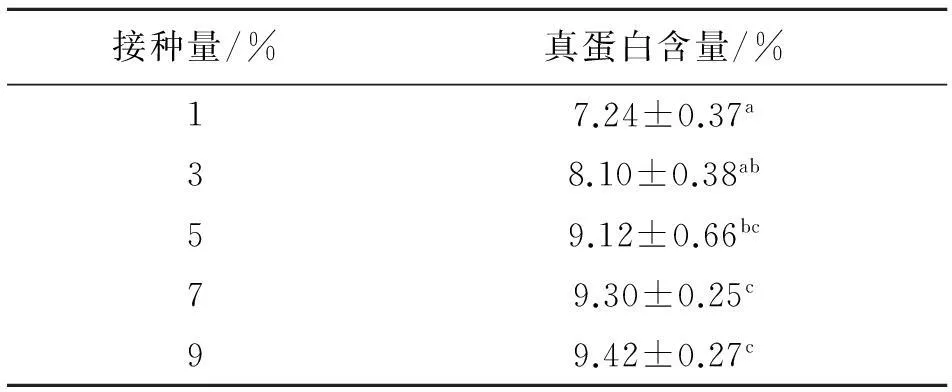
表8 不同接种量对真蛋白含量的影响
同列数据肩标不同字母表示差异显著(P<0.05).
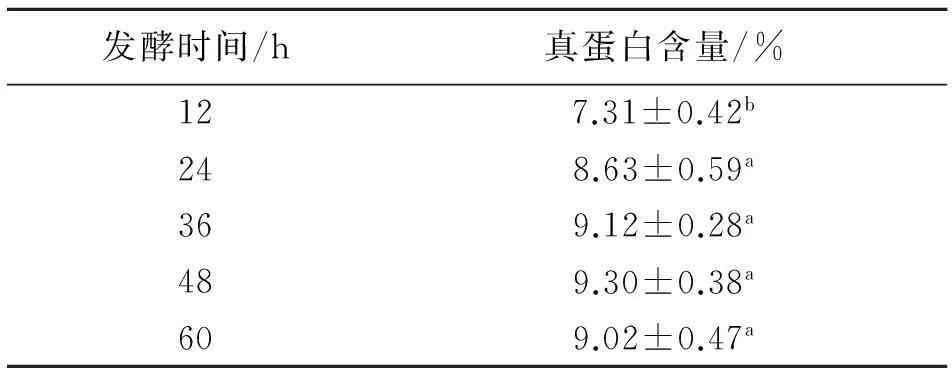
表9 不同发酵时间对真蛋白含量的影响
同列数据肩标不同字母的表示差异显著(P<0.05).
2.2.4多因素正交试验结果从表10中可以看出,培养基的最优方案为A3B3C1,即接种时间8 d,接种量7%,发酵时间24 h.通过分析,对真蛋白含量影响最大的是接种量,然后是接种时间、发酵时间.
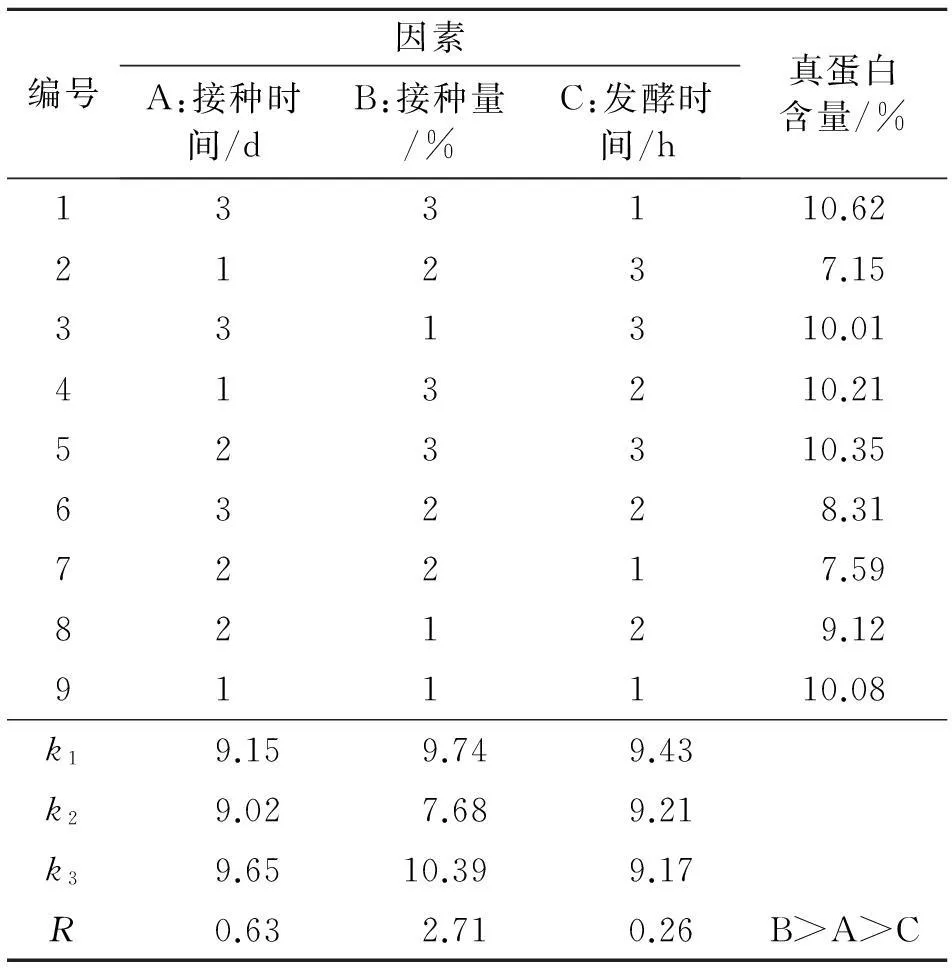
表10 接种酵母正交试验结果
3结论
本试验通过对绿色木霉、红芝、酵母共同发酵培养条件的研究,进行了单因素试验和多因素的正交试验,综合了规模化培养及实际生产过程中的成本考虑,最终得出最优方案为绿色木霉、红芝接种比例为1∶4、接种量为35%、共同发酵时间8 d、二次发酵时酵母接种量7%、发酵时间为24 h时,培养基中纤维素、半纤维素、木质素降解率最好,培养基中真蛋白含量最高,可以达到10%左右.由于试验所用菌种是从外购买,其各种产酶活性及各种生理生化指标试验都需要进一步进行,这些工作有待于今后逐步研究.
参考文献
[1]关艳丽,李莉,陈飞,等.1株产漆酶白腐真菌的筛选和鉴定[J].微生物学杂志,2010(3):74-77
[2]李彩霞,李鹏,王晓琴,等.微生态高蛋白玉米秸秆饲料开发研究[J].甘肃农业科技,2000(5):39-42
[3]Babitskaya V G.Fungi the Producers of Physiologically Active Can pounds in Lignocellulose Biology and Cultivntion[D].Doctoral Sc(Boil)Dissertation,Minsk,In-tmikrobiologii AN BSSR,1991,372-416
[4]Stepanova E V,Koroleva O V.Fungal decom position of oat straw during liquid and solid-state fermentation[J].Applied Biochemistry and Microbiology,2003,39(1):65-74
[5]韦丽敏.降解秸秆的白腐真菌的筛选、优化及混菌发酵研究[D].兰州:甘肃农业大学,2013
[6]何桂霞.绿色木霉的筛选及秸秆的二次组合发酵[D].兰州:甘肃农业大学,2013
[7]Y.P.Lu,B.Yang,D.Gregg,J.N.Saddler,S.D.Mansfield.Cellulase adsorption and an evalution of enzyme recycle during hydrolysis of steam exploded softwood residues[J].Applied Biochemistry and Biotechnology,2002,98:641-654
[8]李亚蕾,杨波,罗瑞明.以绿色木霉TrichodermavirideNUA-051及产朊假丝酵母Candidautilis发酵酸解玉米秸秆生产单细胞蛋白的工艺研究[J].食品科技,2006(7):261-264
[9]廖雪义,冯桦林,吴传兵,等.木霉与酵母混合发酵秸秆生产蛋白饲料的研究[J].粮食与饲料工业,2010(10):44-46
[10]陶蕾,王曙阳,曹广益,等.复合菌剂发酵秸秆的作用及应用[J].甘肃农业大学学报,2011,46(),37-40
[11]刘忠元.热带假丝酵母和黑曲霉发酵玉米秸秆条件优化[D].长春:吉林大学,2007
[12]潘峰,史晓丽,杨树林,等.多菌种混合发酵稻草生产蛋白饲料的研究[J].粮食与饲料工业,2001(8):25-26
[13]Bhalla T C,Joshi M.Protein enrichment of apple by co-culture of cellulolytic moulds and yeasts[J].World Journal of Microbiology & Biotechnology,1994(10):116-117
[14]KE L X,WU Q,ZHANG D Q.Bioconversion of rape into a nutritionally enriched substrate by Ganoderma Lucidum and yeas[J].African Journal of Biotechnology,2011,10(29):5648-5653
[15]邵喜霞,张力,韩大勇,等.新型秸秆分解菌的筛选和酶活性研究[J].中兽医医药杂志,2008(3):15-17
[16]何东东.产朊假丝酵母的发酵及功能性质研究[D].天津:天津商业大学,2010
[17]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2002:49-63
(责任编辑赵晓倩)
fermentation ofTrichodermaviride,ganoderma
and yeast for rice straw
MENG Shun-li1,ZHANG Li2,SHI Zhao-guo1,HAN Da-yong2,LIU Hai-xia2,
ZHAO Lian-di1,WANG Mei-juan2
(1.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;
2.Jiangsu Agri-animal Husbandry Vocational College,Taizhou 225300,China)
Abstract:The aim of the study was to optimize the conditions of fermentation by common fermentation ofTrichodermaviride,ganoderma and yeast.A combined fermentation was conducted firstly withT.virideand ganoderma to degrade cellulose,hemicellulose and lignose of straw. Then,the conditions of protein feed production was studied by inoculating yeast with secondary fermentation.When the inoculation proportion ofT.virideand ganoderma was 1∶4,inoculation 35%,fermentation 192 h,the inoculation of yeast 7%,fermentation 24 h .Under this condition,the content of real protein in culture medium reached the highest.
Key words:Trichodermaviride;ganoderma;yeast;degradation rate;protein feed
收稿日期:2014-10-17;修回日期:2014-11-18
通信作者:史兆国,男,教授,硕士生导师,从事家禽生产与家禽营养的研究.E-mail:shizhaoguo@gsau.edu.cn
中图分类号:S 816
文献标志码:A
文章编号:1003-4315(2015)06-0006-06

