饲料中添加胆汁酸对牛蛙生长性能、体组成和营养物质表观消化率的影响
胡田恩王 玲张春晓宋 凯李金宝
(1. 集美大学水产学院, 厦门市饲料检测与安全评价重点实验室, 厦门 361021; 2. 山东龙昌动物保健品有限公司,济南 250062)
饲料中添加胆汁酸对牛蛙生长性能、体组成和营养物质表观消化率的影响
胡田恩1王 玲1张春晓1宋 凯1李金宝2
(1. 集美大学水产学院, 厦门市饲料检测与安全评价重点实验室, 厦门 361021; 2. 山东龙昌动物保健品有限公司,济南 250062)
试验研究了饲料中添加胆汁酸对牛蛙[Rana (Lithobates) catesbeiana]生长性能、体成分和营养物质表观消化率的影响。基础饲料以鱼粉、豆粕为主要蛋白源, 棕榈油为主要脂肪源, 在基础饲料中分别添加0、100、200和 300 mg/kg的胆汁酸(含量 99.1%)制作 4种等氮等能的试验饲料。试验将 144只牛蛙[初始体重(75.01±4.23) g]随机分为4组, 每组3个重复, 每个重复12只牛蛙, 进行为期8周的生长试验。结果显示: 各试验组牛蛙成活率和摄食率差异不显著(P>0.05)。200 mg/kg胆汁酸添加组牛蛙的增重率、特定生长率、饲料效率、蛋白质效率和氮保留率显著高于对照组(P<0.05)。在饲料中添加胆汁酸显著降低了牛蛙脏体指数和全体的脂肪含量(P<0.05), 但不影响肌肉粗脂肪以及全体和肌肉水分、粗蛋白、粗灰分含量(P>0.05)。各处理组间血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇浓度均无显著变化(P>0.05), 血清尿素氮含量随着饲料中胆汁酸添加量的增加而降低, 添加300 mg/kg胆汁酸组牛蛙血清尿素氮含量显著低于对照组(P<0.05)。血糖水平则随着胆汁酸添加量的增加而先降低后升高, 其中100 mg/kg胆汁酸添加组牛蛙血糖水平最低(P<0.05)。100 mg/kg胆汁酸添加组牛蛙肠道脂肪酶活力显著高于对照组和300 mg/kg胆汁酸添加组(P<0.05), 与200 mg/kg胆汁酸添加组之间差异不显著(P>0.05), 蛋白酶活力与脂肪酶活力有相似的变化趋势, 而淀粉酶活力未受胆汁酸添加水平影响。各处理组饲料营养物质的表观消化率随饲料中胆汁酸添加量的增加而先升高后降低, 其中饲料添加200 mg/kg胆汁酸显著增加了牛蛙对饲料营养物质的表观消化率(P<0.05)。结果表明: 在饲料中添加适量的胆汁酸能提高牛蛙对饲料的消化率, 提高饲料效率, 从而促进牛蛙的生长, 同时可促进蛙体脂肪代谢, 降低机体脂肪沉积, 提高牛蛙可食部分比例。根据本试验结果, 建议牛蛙饲料中胆汁酸添加水平为200 mg/kg。
牛蛙; 胆汁酸; 体组成; 消化酶; 表观消化率
牛蛙[Rana (Lithobates) catesbeiana]具有生长快、肉味鲜美、营养丰富等优点, 深受消费者喜爱, 是一种经济潜力巨大的养殖品种。近年来, 国内牛蛙养殖业发展迅猛, 养殖产量逐年增加, 然而在集约化养殖条件下, 牛蛙大量摄食配合饲料, 缺少运动, 体脂肪偏高, 这不仅降低了牛蛙的肉质品质和可食部分比例, 也导致饲料营养物质的浪费, 提高了养殖成本。因此, 促进牛蛙脂肪分解代谢, 提高体蛋白质沉积,已成为高效环保牛蛙配合饲料亟待解决的问题。
胆汁酸是胆汁的主要成分, 是动物体内胆固醇代谢过程中产生的一系列固醇类物质。其分子结构一端具有亲油的烷基, 一端具有亲水的羟基和羧基,这种结构使得胆汁酸具有较强的表面活力, 可降低油水两相间的表面张力, 促进脂肪乳化, 形成可以悬浮在水中的脂肪酸乳糜微粒, 扩大脂肪与脂肪酶的接触面积, 加速脂肪的消化吸收, 提高脂肪的消化率。乳化作用能不同程度地改善动物对其他营养素, 特别是脂溶性维生素、类胡萝卜素及其他微量元素的吸收利用[1], 有提高动物的生长性能, 杀菌消炎提高机体免疫力[2]等作用。对水产动物的研究表明, 胆汁酸具有促进鱼类的生长, 提高饲料转化率, 降低饲料系数的作用[3—5]。对禽类的研究也发现胆汁酸有利于肉鸡对脂肪的消化吸收[6]。然而目前尚没有关于胆汁酸对牛蛙营养生理影响的研究报道。本试验旨在探讨牛蛙饲料中添加不同水平的胆汁酸对其生长性能、体成分和饲料营养物质表观消化率的影响, 以期为胆汁酸在牛蛙配合饲料中的应用提供科学依据。
1 材料与方法
1.1 试验饲料
以鱼粉和豆粕为主要蛋白源, 棕榈油为主要脂肪源, 面粉为主要糖源配制基础饲料, 分别在每千克基础饲料中添加0、100、200和300 mg胆汁酸(胆汁酸总量 99.1%, 其中猪胆酸和猪去氧胆酸总和78.9%, 鹅去氧胆酸 20.2%; 由山东龙昌动物保健品有限公司提供)配制出4种等氮等能的试验饲料, 同时向每种饲料中添加0.5%的 Cr2O3作标记物, 饲料粗蛋白为 40%, 粗脂肪为 7%。饲料原料经粉碎过60目筛, 各原料按配比定量后混合均匀, 加棕榈油,然后加入适量的水搅拌均匀, 经水产饲料膨化机制成直径为4.0 mm的饲料颗粒, 室内17℃风干后储存在-20℃的冰箱中备用。
1.2 动物饲养与管理
试验用蛙购于厦门市同安区一养殖场, 为同一批培育的牛蛙。在正式试验前, 牛蛙放于室内暂养缸中暂养, 以基础饲料饱食投喂, 使之逐渐适应试验饲料及养殖环境。暂养 15d后, 将牛蛙饥饿 24h,挑选个体大小均匀的健康牛蛙随机分配到室内 12个水族箱(68 cm×38 cm×36 cm)中进行养殖试验。试验牛蛙初始体重为(75±4.23) g, 随机分为4组, 每组3个重复, 每个重复放养12只牛蛙。养殖试验持续8周。试验期间, 水族箱水位 4 cm, 水温(28±2) , ℃每天投喂 2次(8:00, 18:00), 达饱食状态, 投喂前30min对各缸进行换水和清洗。养殖期间记录牛蛙的摄食和死亡情况。

表1 基础饲料组成与营养成分(%干物质)Tab. 1 Ingredients and proximate composition of basal diet (% dry matter basis)
1.3 样品采集及分析测定方法
在 8周养殖试验结束后, 对试验牛蛙饥饿 24h,然后对每个重复组进行计数、称重。分别从每个缸中随机抽取5只牛蛙, 用双毁髓法处理, 其中2只牛蛙用于测全体成分; 从另外3只牛蛙心脏动脉采血,血样静置20min, 3000 r/min离心10min, 取上清液制得血清, 置–80℃冰箱以备分析。将采完血后的 3只牛蛙解剖称肝脏重、内脏重, 迅速截取部分肠道(胃幽门后方 2—7 cm 处), 置-80℃冰箱中保存待测。各缸剩余牛蛙用于饲料表观消化率测定试验。
粗酶液的制备: 每只牛蛙取1.0 g肠道样品加入9倍体积, 浓度为 0.7%的 4℃生理盐水, 冰浴匀浆(10000 r/min, 10秒/次, 连续4次), 3000 r/min离心10min, 取上清液用于测肠道蛋白酶、脂肪酶和淀粉酶活力。肠道蛋白酶活力采用福林-酚试剂法[7], 以1 mL 1%的酪蛋白溶液为底物, 在37℃水浴锅预热5min后加入1 mL组织上清液, 准确反应15min后加入 3 mL 0.4 mol/L的三氯乙酸终止蛋白酶反应, 5000 r/min离心10min。取上清液1 mL, 加入5 mL 0.4 mol/L的碳酸钠溶液和 1 mL福林-酚试剂, 在37℃水浴锅中显色15min, 在680 nm波长处测其吸光值。以标准 L-酪氨酸浓度和吸光值做标准曲线,用于计算蛋白酶活力。蛋白酶活力单位定义: 每分钟内分解出1 μg酪氨酸的酶量称为一个单位。
脂肪酶活力测定采用南京建成化学比浊法测试盒。脂肪酶活力单位定义: 在 37℃条件下, 每克组织蛋白在反应体系中与底物反应 1min, 每消耗1 μmol底物为一个酶活力单位。淀粉酶活力测定采用南京建成碘-淀粉比色法测试盒。淀粉酶活力单位定义: 组织中每毫克蛋白在37℃与底物作用30min,水解10 mg淀粉定义为1个酶活力单位。
试验饲料、粪便、牛蛙全体以及肌肉中水分、粗蛋白、粗脂肪和粗灰分的含量测定参照 AOAC[8]的方法。粗蛋白采用凯氏定氮法, 用 FOSS公司生产的Kjeltec8400型全自动凯氏定氮仪进行测定; 粗脂肪采用索氏抽提法; 粗灰分采用马福炉 550℃灼烧法; 水分采用 105℃恒重法; Cr2O3的测定用SCT1089-2006[9]中的酸消化比色法。
1.4 牛蛙饲料表观消化率测定试验
在养殖试验结束后, 对各缸剩余牛蛙进行饲料表观消化率测定试验。下午投喂2h后, 清洗水族箱内残料和排泄物, 将自制的牛蛙粪便收集装置[10]放于箱底, 于次日早上投喂前取出装置, 收集牛蛙自然排出的粪便, 置–20℃冰箱以备分析。
1.5 计算公式
增重率(Percent weight gain, PWG, %)=(Wf–Wi)/ Wi×100
特定生长率(Specific growth rate, SGR, %/d) = (ln Wf–ln Wi)×100/t
饲料效率(Feed efficiency, FE)=(Wt–W0)/Wd
摄食率(Feeding rate, FR, %)=Wd/(Wt/2+W0/2)/t× 100
蛋白质效率(Protein efficiency ratio, PER)=(Wt–W0)/Wp
氮保留率(Nitrogen retention rate, NRR, %)= 100×(Wt×Pt–W0×P0)/WP
成活率(Survival rate, SR, %)=Nf/Ni×100
肝体指数(Hepatic somatic index, HSI, %)=肝脏重/蛙重×100
脏体指数(Viscerasomatic index, VSI, %)=内脏重/蛙重×100
干物质表观消化率(ADC, %)=100–100×(A1/A2)
营养素表观消化率(ADC, %)=100–100×(A1×B2/ A2×B1)
其中 Wi和 Wf分别表示牛蛙初始均重和末均重(g), Wp为总蛋白摄入量, Wd为摄入饲料总重(干重), Nf为末蛙数, Ni为初蛙数, t为试验天数, Wt为牛蛙终末总重, W0为牛蛙初始总重, Pt为终末牛蛙全体粗蛋白含量(%), P0为初始牛蛙全体粗蛋白含量(%), A1为饲料中Cr2O3的百分含量, A2为蛙粪中Cr2O3的百分含量, B1为饲料中某种营养成分的百分含量, B2为粪便中某种营养成分的百分含量。
1.6 数据统计
数据统计分析采用SPSS 17.0软件进行单因素方差分析(One-way ANOVA), 若差异显著, 则采用Duncan法进行多重比较, 差异显著水平为P<0.05。试验结果采用(平均值±标准误)表示。
2 结果
2.1 在饲料中添加胆汁酸对牛蛙生长性能的影响
胆汁酸为200 mg/kg添加组牛蛙增重率、特定生长率、饲料效率、蛋白质效率和氮保留率最高(表2), 分别为191.28%、1.91%/d、1.19、2.91、57.14%,较对照组分别提高了 10.35%、6.11%、16.67%、17.34%、15.18%(P<0.05), 其他各组间无显著差异(P>0.05)。各处理组牛蛙摄食率和成活率无显著差异(P>0.05)。饲料中添加胆汁酸各组牛蛙的脏体指数显著低于对照组(P<0.05)。各添加组之间牛蛙的肝体指数无显著性差异(P>0.05)。
2.2 在饲料中添加胆汁酸对牛蛙全体和肌肉组成
的影响
由表 3可见, 各组牛蛙全体的水分、粗蛋白和粗灰分含量无显著差异(P>0.05), 但胆汁酸添加组牛蛙全体粗脂肪含量显著低于对照组, 当胆汁酸添加量为100、200和300 mg/kg时, 全体粗脂肪含量较对照组分别降低 13.08%、13.46%和 15.38% (P<0.05); 各试验组牛蛙肌肉中水分、粗蛋白、粗脂肪和粗灰分含量无显著差异(P>0.05)。
2.3 在饲料中添加胆汁酸对血清生化指标的影响
在饲料中添加胆汁酸各组牛蛙血清总胆固醇和甘油三酯水平高于对照组(表4), 但各组间差异未达显著水平(P>0.05)。饲料中添加胆汁酸对牛蛙血清高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量无显著影响(P>0.05)。添加300 mg/kg胆汁酸组, 牛蛙血清尿素氮含量(4.32 mmol/L)显著低于对照组(5.73 mmol/L) (P<0.05), 而各胆汁酸添加组间无显著差异(P>0.05)。添加100 mg/kg胆汁酸时, 血糖浓度(2.98 mmol/L)较对照组(4.21 mmol/L)显著降低(P<0.05), 其他各组间无显著差异(P>0.05)。
2.4 在饲料中添加胆汁酸对肠道蛋白酶、脂肪酶和
淀粉酶活力的影响
与对照组相比(表 5), 添加 100和 200 mg/kg胆汁酸均显著提高了牛蛙肠道蛋白酶活力, 添加100 mg/kg胆汁酸显著提高了肠道脂肪酶活力(P<0.05), 而300 mg/kg胆汁酸添加组与对照组无显著差异(P>0.05)。淀粉酶活力随胆汁酸添加量的增加呈先升高后降低的趋势, 但各组之间差异不显著(P>0.05)。
2.5 在饲料中添加胆汁酸对营养物质表观消化率
的影响
当饲料中添加200 mg/kg胆汁酸时(表6), 牛蛙对饲料干物质的表观消化率显著高于其他添加组(P<0.05)。饲料中添加200 mg/kg胆汁酸组牛蛙对饲料蛋白质和脂肪的表观消化率分别为 73.47%和77.92%, 显著高于对照组 8.8%和 9.85%(P<0.05),而其他各胆汁酸添加组的消化率均高于对照组, 但其差异未达显著水平(P>0.05)。

表2 饲料中添加胆汁酸对牛蛙生长性能的影响Tab. 2 Effects of dietary bile acids on the growth of bullfrog
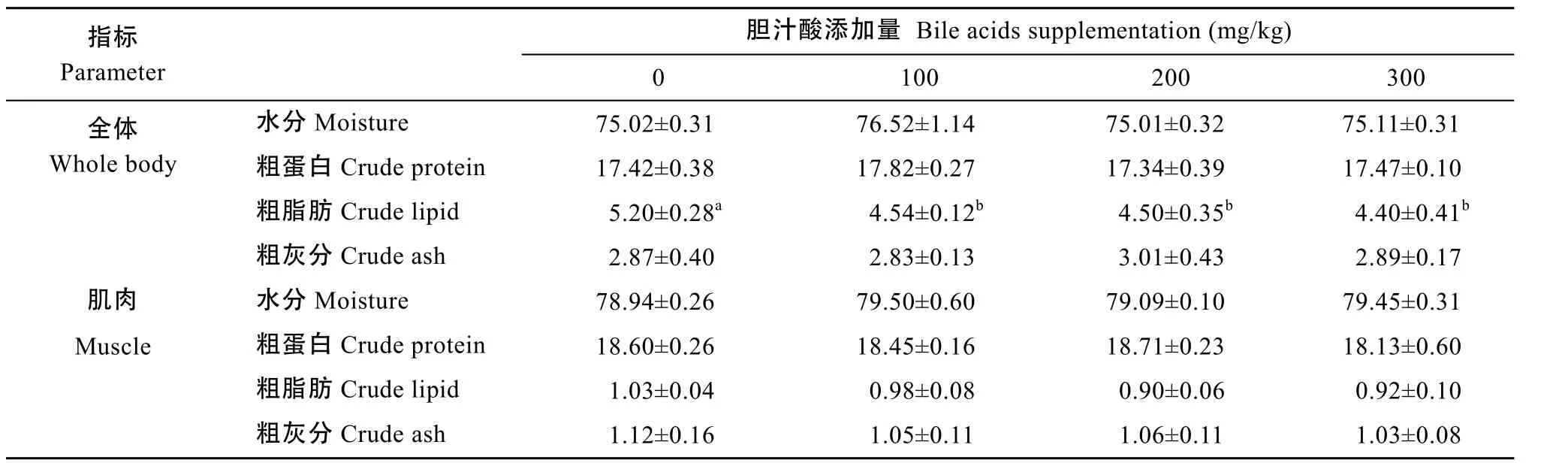
表3 在饲料中添加胆汁酸对牛蛙全体和肌肉成分的影响(%湿重) Tab. 3 Effects of dietary bile acids on whole-body and muscle compositions of bullfrog (% wet weight)

表4 在饲料中添加胆汁酸对牛蛙血清生化指标的影响Tab. 4 Effects of dietary bile acids on biochemical parameters of serum of bullfrog (mmol/L)
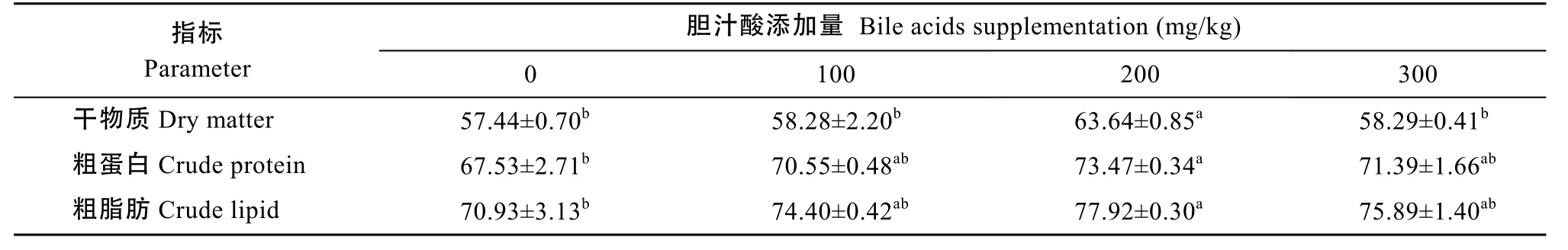
表6 牛蛙对试验饲料中干物质、粗蛋白和粗脂肪的表观消化率Tab. 6 Apparent digestibility coefficients of DM, CP, CL of diet for bullfrog (%)
3 讨论
3.1 在饲料中添加胆汁酸对牛蛙生长性能和体组成的影响
本试验结果表明, 在饲料中添加胆汁酸能提高牛蛙的增重率和饲料效率。Maita等[11]研究证实, 饲料中添加脱氧胆酸可提高日本鳗鲡(Anguilla japonica)的增重率。Deshimaru等[12]研究也发现, 饲料中添加胆汁酸能显著提高黄尾(Seriola quinqueradiata)的生长速度和饲料效率。国内学者研究饲料中添加胆汁酸对虹鳟(Oncorhynchus mykiss)[13]和异育银鲫(Carassius auratus gibelio)[14, 15]生长的影响, 也获得了类似的结果。其促进动物生长的机制可能有以下两方面: 一方面是胆汁酸有利于脂类物质的乳化, 提高了动物对脂肪的消化利用率; 另一方面,胆汁酸在肠道中具有杀菌抑菌[2, 16]的作用, 改善肠道健康, 促进各种营养物质的消化吸收, 提高饲料效率。
脏体比常用来评价养殖动物摄入能量的分配状况, 因脏体比高而导致牛蛙运动能力差、易发病、可食比例低等现象是牛蛙养殖生产亟待解决的问题。在本试验饲料中添加100、200和300 mg/kg的胆汁酸组牛蛙脏体指数较对照组分别降低了14.65%、26.38%和24.34%, 说明饲料中添加胆汁酸可减少内脏能量的沉积, 增加蛙体的可食部分比例,提高其利用价值。王恒等[4]研究报道, 在饲料中添加胆汁酸能够显著降低罗氏沼虾全体和肌肉中粗脂肪含量。周书耘等[5]报道, 在饲料中添加150 mg/kg胆汁酸显著降低了军曹鱼全鱼脂肪含量。胆汁酸降低水产动物体脂肪的机制尚未见研究报道, 而关于小鼠的研究表明, 在饲料中添加胆汁酸可激活褐色脂肪细胞表面G蛋白偶联胆汁酸受体(TGR5), 提高胞内环腺苷酸(cAMP)水平, 进而促进Ⅱ型脱碘酸酶(D2)的表达, 提高甲状腺激素水平, 而甲状腺激素升高可使机体的基础代谢加快, 从而提高脂肪组织的代谢速率[17, 18]。这说明胆汁酸可以通过调节动物体激素水平而影响动物的脂肪代谢。与上述研究相似, 本试验也发现饲料中添加胆汁酸显著降低了牛蛙全体脂肪水平, 显著提高了牛蛙氮保留率, 说明胆汁酸通过促进蛙体脂肪分解代谢而节约饲料蛋白质, 从而提高蛙体的蛋白质沉积, 促进牛蛙生长。
3.2 在饲料中添加胆汁酸对牛蛙血清生化指标的影响
血液与机体代谢、营养状况以及疾病等密切相关, 血液成分变化是重要的生理、病理和毒理学指标[19]。本研究发现, 胆汁酸添加组牛蛙血清尿素氮浓度较对照组显著下降, 而氮保留率显著升高, 说明在饲料中添加胆汁酸可降低牛蛙体蛋白或氨基酸的分解代谢, 促进蛋白质在蛙体的沉积。已有研究表明, 胆汁酸在动物体内存在两种确定的途径影响血糖代谢。一是胆汁酸可以通过激活 TGR5, 诱导cAMP合成, 上调胰高血糖素样肽-1(GLP-1)的表达,提高胰岛素敏感性, 从而降低血糖[20]。二是胆汁酸可以抑制体内胆汁酸合成关键酶(CYP7A1)基因的表达, 反馈性地减少胆汁酸的合成分泌[21], 降低与类法尼醇(FXR)的亲和力, 减弱其对葡萄糖的调控,导致血糖升高[22]。在本试验中, 当胆汁酸添加量为100 mg/kg时, 血糖浓度较对照组显著降低, 而随着饲料中胆汁酸添加量的增加, 血糖水平逐渐升高,当饲料中胆汁酸添加量为 300 mg/kg时, 血糖水平显著高于100 mg/kg胆汁酸添加组。这表明牛蛙血糖浓度的变化与饲料胆汁酸的剂量密切相关, 而胆汁酸的剂量可能是调控两种途径发挥作用的重要因素。
3.3 胆汁酸对牛蛙肠道消化酶和饲料营养物质表观消化率的影响
肠道消化酶的活力是反映肠道对食物营养物质消化能力的重要指标。在本试验中, 在饲料中添加100 mg/kg胆汁酸时, 牛蛙肠道脂肪酶活力较对照组提高了32.62%。胆汁酸具有特殊的生物活性, 可以部分溶解肠道内容物中脂肪的分解产物, 并将其从酶作用位点及时移除, 避免这些产物对脂肪分解系统的抑制作用[23], 从而促进脂肪分解生成脂肪酸,而脂肪酸水平提高可以增强胆囊收缩素(CCK)的释放, 进而刺激胰腺分泌消化酶[24]。Alam等[25]研究也发现胆汁酸能显著提高牙鲆(Paralichthys olivaceus)消化道脂肪酶活力。Bauer等[23]认为, 低浓度的胆汁盐有助于脂肪的消化, 而高浓度胆汁盐对其有抑制作用, 可能是胆汁盐浓度高时, 其形成的某种单分子层结构物质阻碍了底物与脂肪酶的结合。正如试验结果, 在饲料中添加 100 mg/kg胆汁酸提高了牛蛙肠道脂肪酶活力, 而随着饲料中胆汁酸添加量的增加, 肠道脂肪酶活力逐渐降低。在本试验中, 各添加胆汁酸组的肠道淀粉酶活力较对照组无显著差异。Maita等[11]也发现幼鳗饲料中添加胆汁酸对其肠道淀粉酶的活力无显著影响, 这说明胆汁酸不影响水产动物对碳水化合物的消化。本试验结果表明,适宜浓度胆汁酸能显著提高牛蛙肠道蛋白酶活力,但其具体的作用机理尚不清楚, 有待进一步研究。
消化率的测定是水产动物消化生理研究的重要部分。在本试验中, 添加200 mg/kg胆汁酸组牛蛙对饲料干物质、粗蛋白和粗脂肪的表观消化率最高,说明胆汁酸可以提高牛蛙饲料中营养物质的消化利用率。王优军[26]在大菱鲆(Scophalmus maximus)饲料中添加胆汁酸, 发现其饲料粗蛋白消化率提高了1.5%, 粗脂肪消化率提高了3%。对畜禽动物的研究表明, 饲料中添加胆汁酸能提高蛋鸡和肉鸡的脂肪表观消化率[27, 28]。猪日粮中添加胆汁酸, 能提高其对脂肪的摄入量和脂肪表观吸收量, 并显著地提高氮摄入量和氮贮留量[29]。本试验结果表明, 各试验组牛蛙肠道蛋白酶和脂肪酶活力与其对饲料的表观消化率的变化趋势相似, 但该两种消化酶活力最大值出现在 100 mg/kg胆汁酸添加组, 而表观消化率的最大值在 200 mg/kg胆汁酸添加组, 说明在本试验条件下, 饲料表观消化率的差异不仅与胆汁酸影响消化酶的活力变化相关, 还与胆汁酸的其他作用有关。胆汁酸的分子结构使得其具有较强的表面活力, 从而降低油水两相间的表面张力, 促进脂肪乳化。一般而言, 多不饱和脂肪酸自身具有较高的乳化能力, 通常比饱和脂肪酸更容易形成微团[28], 而长链饱和脂肪酸能否有效乳化主要依赖于是否有足够的乳化剂存在[30], 本试验以棕榈油作为饲料的主要脂肪源, 而棕榈酸作为棕榈油的主要成分, 是一种长链饱和脂肪酸。Atteh和 Lesson[31]研究证实外源性胆酸盐可提高肉仔鸡对棕榈酸和硬脂酸的利用率。本试验消化率结果也说明胆汁酸可以提高牛蛙对棕榈油的利用率, 因此胆汁酸对脂肪的乳化作用也是提高牛蛙消化率的重要机制之一。
4 结论
胆汁酸通过其对脂肪的乳化作用和提高消化酶活力来促进牛蛙对营养物质的消化吸收, 从而提高牛蛙对蛋白质和脂肪等营养物质的利用率, 提高饲料效率和蛋白质效率, 促进牛蛙的生长, 同时可促进体内脂肪代谢, 降低机体脂肪沉积, 提高牛蛙可食部分比例。根据本试验的结果, 建议牛蛙饲料中胆汁酸的添加量为200 mg/kg。
[1] Wang J T, Song J Y, Li H T, et al. Effect of emulsifier on growth performance and blood biochemical index in common carp Cyprinus carpio var. Jian [J]. Journal of Dalian Fisheries University, 2009, 24(3): 257—260 [王纪亭,宋憬愚, 李海涛, 等. 乳化剂对建鲤生长及血液生化指标的影响. 大连水产学院学报, 2009, 24(3): 257—260]
[2] Liu Z Y, Wang J P, Liu N. Effect of emulsifier on intestinal flora and immune function of broilers [J]. Chinese Journal of Animal Science and Veterinary Medicine, 2013, 40(8): 60—63 [刘兆阳, 王建平, 刘宁.乳化剂对肉鸡肠道菌群及免疫功能的影响. 中国畜牧兽医, 2013, 40(8): 60—63]
[3] Wang J T. Effect of NaCl, DL-carnitine compound and bile acid on growth, partial physiological enginery and body点叉尾 生长和部分生理机能、体色因子的影响. 硕士学位论文, 苏州大学, 苏州. 2008]
[4] Wang H. Effect of different lipid sources and bile acid on growth performance and fatty acid composition in Macrobrachium rosenbergii [D]. Thesis for Master of Science. Yangzhou University, Yangzhou. 2010 [王恒.不同脂肪源及胆汁酸对罗氏沼虾生长性能及脂肪酸组成的影响. 硕士学位论文, 扬州大学, 扬州. 2010]
[5] Zhou S Y, Liu Y J, Liang H O, et al. Effect of bile acids on growth and body composition of cobia (Rachycentron canadum) [J]. South China Fisheries Science, 2010, 6(4): 20—25 [周书耘, 刘永坚, 梁海鸥, 等.饲料中添加胆汁酸对军曹鱼生长及体组成的影响. 南方水产, 2010, 6(4): 20—25]
[6] Pullen D L, Polin D. Effect of bile acids and diet composition on lipid absorption in chickens with cannulated bile ducts [J]. Poultry Science, 1984, 63(10): 2020—2026
[7] Beijing University Biology Biochemistry Teaching and Research Section. Biochemistry Experiment Instruction [M]. Beijing: People’s Education Press. 1979, 73—74 [北京大学生物系生物化学教研室. 生物化学实验指导. 北京: 人民教育出版社. 1979, 73—74]
[8] AOAC. Official methods of Analysis of AOAC International, 16th edition [M]. Gaithersburg MD: Association of Official Analytical Chemists International. 1995, 1094
[9] Zhu X M, Xie S Q, Lei W, et al. SCT1089—2006 Fish digestion rate method [S]. Agricultural Quality & Standards, 2006 [朱晓鸣, 解绶启, 雷武, 等. SCT1089—2006鱼类消化率测定方法. 农业质量标准, 2006]
[10] Zhang C X, Huang K K, Wang L, et al. Apparent digestibility coefficients and amino acid availability of common protein ingredients in the diets of bullfrog, Rana (Lithobates) catesbeiana [J]. Aquaculture, 2015, 437(1): 38—45
[11] Maita M, Tachikih, Kaibara A, et al. Pharmacological effect of ursodeoxycholic acid in juvenile eel [J]. Nippon Suisan Gakkaishi, 1996, 62(1): 129—130
[12] Deshimaru O. Suitable levels of lipids and ursodesoxycholic acid in diet for yellowtail (Seriola quinqueradiata) [J]. Bulletin of the Japanese Society of Scientific Fisheries, 1982, 48(9): 1265—1270
[13] Xie Z G, Niu C J. Effect of kelikang on growth performance in rainbow trout Oncorhynchus mykiss [J]. Feed Research, 2002, 10(8): 22—25 [颉志刚, 牛翠娟. 可利康对虹鳟生长的影响. 饲料研究, 2002, 10(8): 22—25]
[14] Lin S M, Ye Y T, Luo L. Effect of bile acids growth in Carassius auratus gibelio [J]. Guangdong Feed, 2003, 12(3): 14—15 [林仕梅, 叶元土, 罗莉. 胆汁酸添加剂对异育银鲫生长的影响. 广东饲料, 2003, 12(3): 14—15] color factors of channel catfish Ictalurus punctatus [D]. Thesis for Master of Science. Suzhou University, Suzhou. 2008 [汪军涛. 饲粮中食盐、DL-肉碱复合物、胆汁酸对斑
鮰
[15] Tan Y G, Wei W Z, Zeng D S, et al. Effect of bile acids growth performance in Carassius auratus gibelio [J]. Guangdong Feed, 2008, 17(1): 25—26 [谭永刚, 魏文志,曾党胜, 等.饲料中添加胆汁酸对异育银鲫生长性能的影响. 广东饲料, 2008, 17(1): 25—26]
[16] Acosta Rodriguez E V, Zuñiga E, Montes C L, et al. Interleukin-4 biases differentiation of B cells from Trypanosoma cruzi-infected mice and restrains their fratricide: role of Fas ligand down-regulation and MHC class II-transactivator up-regulation [J]. Leukocyte Biology, 2003, 73(1): 127—136
[17] Watananbe M, Houten S M, Mataki C, et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation [J]. Nature, 2006, 439(7075): 484—489 [18] Kawamata Y, Fujii R, Hosoya M, et al. AG protein-coupled receptor responsive to bile acids [J]. Biological Chemistry, 2003, 278(14): 9435—9440
[19] Qiang J, Yang H, Wang H, et al. Effects of different dietary protein levels on serum biochemical indices and expression of liver HSP70 mRNA in gift tilapia (Oreochromis niloticus) under low temperature stress [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 434—443 [强俊, 杨弘, 王辉, 等. 饲料蛋白水平对低温应激下吉富罗非鱼血清生化指标和HSP70 mRNA表达的影响. 水生生物学报, 2013, 37(3): 434—443]
[20] Katsuma S, Hirasawa A, Tsujimoto G. Bile acids promote glucagon-like peptide-1 secretion through TGR5 in a murine enteroendocrine cell line STC-1 [J]. Biochemical and Biophysical Research Communications, 2005, 329(1): 386—390 [21] Holt J A, Luo G, Billin A N, et al. Definition of a novel growth factor dependent signal cascade for the suppression of bile acid biosynthesis [J]. Genes & Development, 2003, 17(13): 1581—1591
[22] Ma K, Saha P K, Chan L, et al. Famesoid X receptor is essential for normal glucose homeostasis [J]. Journal of Clinical Investigation, 2006, 116(4): 1102—1109
[23] Bauer E, Jakob S, Mosenthin R. Principles of physiology of lipid digestion [J]. Asian-Australasian Journal of Animal Sciences, 2005, 18(2): 282—295
[24] Zhou X C, Tang C W. Nerve-hormonal regulation of pancreatic juice secretion [J]. Chinese Journal of Pancreatology, 2002, 2(2): 113—115 [周旭春, 唐承薇. 胰液分泌的神经-激素调节. 胰腺病学, 2002, 2(2): 113—115]
[25] Alam S, Teshma S, Shikawam. Effects of ursodeoxycholic acid on growth and digestive enzyme activities of Japanese flounder Paralichthys olivaceus (Temminck & Schlegel) [J]. World Aquaculture Society, 2001, 32(1): 235—243
[26] Wang Y J. Effect and mechanism of several non-nutritional and non-pollution additives on trout Scophalmus maximu [D]. Thesis for Master of Science. Graduate School of Chinese Academy of Sciences, Qingdao. 2006 [王优军. 几种非营养无公害添加剂对大菱鲆的效应和机制研究. 硕士学位论文, 中国科学院研究生院, 青岛. 2006]
[27] Gomez M X, Poplin D. The use of bile salts to improve absorption of tallow in chicks, one to three weeks of age [J]. Poultry Science, 1976, 55(6): 2189—2195
[28] Polin D, Wing T L. The effect of bile acids and lipase on absorption of tallow by young chicks [J]. Poultry Science, 1980, 59(12): 2738—2743
[29] Reinhart G A, Mahan D C, Cera K R. Effect of group size and feeding regimen on nutrient digestibility studies with weanling pigs [J]. Journal of Animal Science, 1989, 67(10): 2684—2691
[30] Zhang B K, Li H T, Zhao D Q, et al. Lysophosphatidylcholine increased apparent digestibility of poultry fat in broiler chicken diet [J]. Chinese Journal of Animal Nutrition, 2010, 22(3): 662—669 [张炳坤, 李海涛, 赵冬琴, 等. 溶血卵磷脂提高肉仔鸡对禽脂的表观消化率. 动物营养学报, 2010, 22(3): 662—669]
[31] Atteh J O, Leeson S. Influence of age, dietary cholic acid and calcium levels on performance, utilization of free fatty acids and bone mineralization in broilers [J]. Poultry Science, 1985, 64(10): 1959—1971
HU Tian-En1, WANG Ling1, ZHANG Chun-Xiao1, SONG Kai1and LI Jin-Bao2
(1. Key Laboratory for Feed Quality Testing and Safety Evaluation, Jimei University, Xiamen 361021, China;
2. Shandong Longchang Animal Health Products Co. LTD, Jinan 250062, China)
EFFECTS OF DIETARY BILE ACID SUPPLEMENTATION ON THE GROWTH, WHOLE-BODY COMPOSITION AND APPARENT NUTRIENT
DIGESTIBILITY OF BULLFROG (RANA CATESBEIANA)
To investigate the effects of dietary bile acids (BAs) on growth performance, body composition and apparent digestibility of dry matter, protein and lipid in diets for bullfrog, Rana catesbeiana, one hundred and forty-four bullfrogs were randomized to the same diet supplemented with four different levels of BAs (0, 100, 200, and 300 mg/kg). Compared with the control group, percent weight gain (PWG), specific growth rate (SGR), feed efficiency (FE), protein efficiency ratio (PER) andnitrogen retention rate (NRR) of bullfrog were significantly higher at 200 mg/kg BAs-supplemented diet (P<0.05), whereas feeding rate (FR) and survival rate (SR) had no significant differences cross groups (P>0.05). BAs did not significantly affect the contents of moisture, crude protein, crude ash in muscle and body of bullfrog, but it significantly decreased body lipid content without interfering muscle lipid content. No significant differences were found on the levels of triglycerides (TG), cholesterol (CHO), high density lipoprotein cholesterol (HDL) and low density lipoprotein cholesterol (LDL) in serum cross groups (P>0.05). BAs diminished decreased blood urea nitrogen (BUN) concentration, and 300 mg/kg BAs-supplemented diet has the most dramatic effect. Serum glucose (GLU) concentration lowered significantly with decreasing dietary BAs from 0 mg/kg to 100 mg/kg, and then increased significantly (P<0.05). Compared with the control diet and 300 mg/kg BAs-supplemented diet, intestinal lipase activities and protease activities were higher in the groups fed with the diet supplemented with 100 mg/kg BAs (P<0.05), but it had no significant difference with 200 mg/kg BAs-supplemented diet (P>0.05). Dietary BAs levels had no influence on the intestinal amylase activities. The highest dietary nutrient apparent digestibility coefficients (ADC) was observed in 200 mg/kg BAs-supplemented diet, and the lowest ADC value was in the control group (P<0.05). These results indicate that dietary BAs may improve growth performance, feeding efficiency and dietary apparent nutrient digestibility of bullfrog, and promote the catabolism of body lipid and protein retention, which raise the proportion of the edible part of bullfrog. Based on the results, 200 mg/kg bile acids supplementary level is recommended for bullfrog.
Rana catesbeiana; Bile acids; Body composition; Digestive enzyme; Apparent digestibility
S963
A
1000-3207(2015)04-0677-09
10.7541/2015.90
2014-07-14;
2014-11-21
福建省高校优秀人才支持计划(JA11145); 山东龙昌动物保健品有限公司项目(S513065)资助
胡田恩(1989—), 男, 湖南衡阳人; 硕士研究生; 研究方向为水产动物营养与饲料学。E-mail: 351356166@qq.com
张春晓(1979—), 副教授; 硕士生导师; E-mail: cxzhang@jmu.edu.cn

