二氧化锰的用量对双氧水分解反应的影响初探
严西平+陈学东+钱蕙
摘要:运用压强传感器技术测定了二氧化锰的用量与双氧水催化反应速率的关系。结果表明,能快速催化的二氧化锰与过氧化氢的质量比约为1:3,现行教材用双氧水分解制取氧气的实验中二氧化锰的用量过量太多。实验的结果有助于加深对催化剂和催化作用的理解,同时可以增强节约药品的意识。
关键词:二氧化锰;双氧水分解;压强传感器
文章编号:1005–6629(2015)1–0060–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
在现行的初中教材中,二氧化锰催化分解双氧水是一个非常重要的实验。我们教学中发现,无论是教师的演示还是学生的分组实验,二氧化锰的用量都是不讲究的,似乎越多越好。比如当笔者向有些学生提问,做试管实验时为什么要加一药匙的二氧化锰?得到的回答竟是“多加一点,反应得快,带火星的木条复燃就明显”。很显然,这些学生没有真正理解二氧化锰的催化作用,心理暗示把它当做反应物之一了。这是学生的错吗?翻阅沪教版教材上册P36[1]有“把稀的双氧水从分液漏斗中慢慢加入装有少量二氧化锰粉末的锥形瓶中”的描述,但是这个少量究竟是多少克?没有交代。再仔细阅读装置图2-9(见图1),发现所加的二氧化锰并不少,到底加多少药匙才能达到图示量的效果呢?我们做了空白试验,发现至少要加4药匙的二氧化锰才能盖满250mL锥形瓶的底部。用电子天平称量1药匙的二氧化锰约1.8g,则4药匙的二氧化锰约7.2g!笔者还查阅了大学的无机化学教材[2],也没有找到关于催化剂用量的内容,看来对这个反应中二氧化锰用量的研究还是空白。笔者也问询过其他老师究竟加多少合适?回答都说心里没底,只是凭感觉,一般在锥形瓶中加1药匙的量。
考虑到气体的压强是可以用压强传感器及时测得的,而且压强的变化也能间接地反映出反应的速率和生成气体量的变化。这类探究传统实验无法完成,但是数字化实验系统可以做到。于是笔者设计了如图2所示的装置,测量气体压强的变化,通过压强的变化实时观察反应的速率(不是传统意义上的平均速率),以便更全面地了解催化作用,更深入地理解催化剂的概念,更准确地掌握二氧化锰的用量。
2 仪器与药品
2.1 仪器
抽滤瓶、铁架台(附铁夹)、乳胶管、细铁丝(用于捆扎乳胶管)、10mL量筒、滴管等;电子天平(常熟市金羊砝码仪器有限公司)、江苏正方体数字采集器、压强传感器、电脑等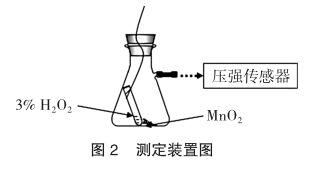
2.2 药品
二氧化锰(AR,上海山浦化工有限公司)、双氧水(AR,无锡市展望化工试剂有限公司)(使用时稀释至3%)
3 实验过程
(1)固定双氧水的用量探究能使其快速催化的二氧化锰的最小用量。每次固定取用双氧水(3%)8mL,在图2的装置中分别和不同质量的二氧化锰混合,当药品就绪后,塞紧橡皮塞,启动传感器,同时平放抽滤瓶并不断振荡,记录容器内压强的变化于图3中。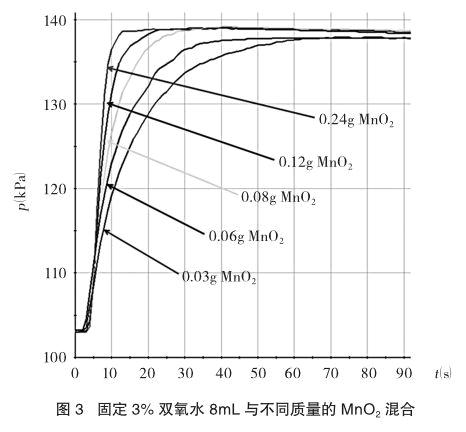
(2)固定二氧化锰的用量探究能快速催化的双氧水的量。每次固定取用0.1g二氧化锰,在图2的装置中分别和不同体积的3%的双氧水混合,当药品就绪后,塞紧橡皮塞,启动传感器,同时平放抽滤瓶并不断振荡,记录容器内压强的变化于图4中。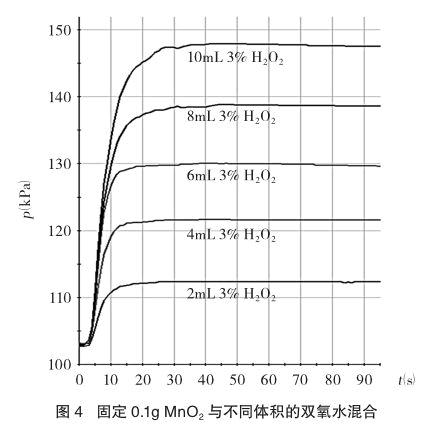
4 结果与讨论
4.1 反应速率与二氧化锰的用量
从图3中可以看出,当二氧化锰的用量增加到0.08g后,曲线的斜率(即表征催化反应的速率)基本上就一致了。因此可以认为在这样的实验条件下,能快速催化的二氧化锰的最小用量与过氧化氢的质量比约为0.08g:(3%×8g)=1:3。(因为溶液较稀,双氧水的密度可以看做1 g/mL)
4.2 二氧化锰能催化的双氧水的量
从图4中可以看出,当双氧水的体积由2mL增加到10mL时,各曲线的斜率基本上一致,这说明0.1g二氧化锰至少能快速催化0.3g的过氧化氢。(需要说明的是超过10mL的双氧水在此条件下没有继续实验下去,因为小试管的容量就是10mL)
4.3 氧气的产量与二氧化锰量的关系
有趣的是,图3、图4还不约而同地验证了一个结论:二氧化锰的量与氧气的产量无关。由于在等温条件下(溶液稀,用量少,反应热可以忽略不计),气体体积与压强呈正比,在实验测量误差的范围内讨论,可以认定图3中,氧气的产量基本上是一致的(转折后平缓线基本上集中在一起);而在图4中,可以清楚地看出,氧气的产量基本上与双氧水的用量呈正比。
4.4 实验结果的定性解释
根据相关文献[3],二氧化锰的催化效率主要由其表面积决定的。以某种晶型的二氧化锰为例,比表面积是48m2/g,0.08g的二氧化锰的表面积就有3.84m2,可以同时吸附的过氧化氢分子的数目相当多,也就是同时可催化很多过氧化氢分子分解,基本上表现出一致的反应速率。只有当二氧化锰用量很小时,才不能同时吸附很多的过氧化氢分子,造成反应速率变慢。
4.5 实验操作误差的讨论
本实验所用的玻璃仪器的精密度有限,二氧化锰的称量和倒入、双氧水的量取和倾倒、塞橡皮塞松与紧的程度、振荡的时间和力度等对压强的变化有一些影响,加上初始压强的校准不能完全一致,实验的精确度有待提高。
5 实验收获
一是无心插柳柳成荫。原本实验设计的初始目的并不是得出“氧气的产量与二氧化锰的量无关”这个结论,可没曾想,图3、4中两条曲线的走势都印证了这份惊喜。这是从催化剂的概念中得出的一个很重要的推论,以前教师都讲过,学生也都做过相应的练习,但是从来没有看到真实的实验图像,心中始终存有些许的遗憾。
二是柳暗花明又一村。从教多年,我们也早就关注过这个教学盲区,虽然“产生氧气的量与催化剂二氧化锰的量无关”这个结论很美丽,但是由于没有实验的支撑,讲授时总是底气不足。数字实验为化学教学打开了一片新天地,重视信息技术的运用是所有化学教师应该担当的职责。如今能通过实验得出确切的结论,这比学生仅从我们讲授中获得知识都开心!因为我们践行了新课改“引领者”的承诺!
三是墙内开花墙外香。我们开发了这个实验,而且运用于教学中并不难,实验的数据都保存在电脑中,再用时可以回放,学生从中能看到老师的用心,能感悟到过去使用二氧化锰的确存在很大的浪费(注:本文开始按照教材插图的示意,假设某演示实验用了7.2g二氧化锰,按照本文实验推论,至少可以快速催化分解21.6g过氧化氢,即6%的双氧水360mL!显然这样的使用量极不合理了),对环境也是一种污染,也会自觉养成节约药品的好习惯。
参考文献:
[1]中学化学国家课程标准研制组.义务教育课程标准实验教科书·化学(九年级上册)[M].上海:上海教育出版社,2012:36.
[2]北京师范大学等无机化学教研室编.无机化学(上册)(第四版)[M].北京:高等教育出版社,2002.
[3]夏熙.二氧化锰的物理、化学性质与其电化学活性的相关(3)[J].电池,2006,36(2):118~120.

