不同偏侧性Rolandic癫痫的同步EEG-fMRI研究
张其锐,张志强,杨昉,许强,胡正,李倩,吴寒,卢光明
Rolandic癫痫(Rolandic epilepsy,RE)又称伴中央颞区棘波的良性儿童癫痫(benign childhood epilepsy with centro-temporal spikes,BECTS)是最常见的儿童癫痫综合征之一,75%在7~10岁发病[1]。RE发作不频繁,发作时可伴有单侧面部感觉运动症状、语言剥夺及唾液分泌过多等[2],脑电图(electroencephalogram,EEG)的特征为在睡眠中频繁出现一侧或双侧中央颞部棘波。RE临床发作和EEG放电具有相对良性的预后,但在神经心理学方面的预后有时并不乐观。心理学测试显示,RE患儿常有语言、认知、行为方面的障碍[3]。认知减退已经被证明与EEG上的棘波活动有关,并发现间期痫样放电(interictal epileptiform discharge,IED)的位置和认知减退具有一致性[4-5],有研究提示左侧放电主要影响语言功能,而右侧放电常伴有视觉空间感觉的异常[6-7]。结合EEG高时间分辨力和fMRI血氧水平依赖(blood oxygenation leveldependent,BOLD)信号高空间分辨力的特性,同步脑电图联合功能磁共振(electroencephalogram and functional MRI,EEG-fMRI)是研究癫痫发病机制的良好途径[8]。且RE患儿频繁的IED为EEG-fMRI的研究带来了良好的机会[9]。本文采用EEG-fMRI技术分析RE患儿IED相关脑功能变化,并探讨其与EEG偏侧性之间的关系。
材料与方法
1.研究对象
纳入标准:①临床诊断符合2010年国际抗癫联盟(ILAE)制定的RE发作标准;②EEG检查为典型Rolandic放电;③MRI结构成像正常;④患儿监护人知情并签署知情同意书。本研究获得南京军区南京总医院医学伦理委员会批准。依照纳入标准,选择2012年12月-2014年8月南京军区南京总医院神经内科及南京儿童医院神经内科门诊的RE患儿19名,平均年龄9.0±2.1岁,男13例,女6例(表1)。
2.数据采集
所有患儿均接受EEG-fMRI检查。EEG数据采集:采用Brain Product公司生产的MRI兼容32导联设备,BrainAmp放大盒置于MRI扫描仪内,数据通过光导纤维传至操作室计算机,采集频率为5000Hz。MRI数据采集:患儿经安慰及训练后仰卧于MRI扫描床,均未服用水合氯醛,呈清醒、安静状态,其父母于MRI检查室内协助监测患儿状况。采用Siemens 3.0T高场强超导MR扫描仪,经单次激发GE-EPI序列采集BOLD-fMRI数据,TR 2000ms,TE 30ms,FA 90°,矩阵64×64,扫描视野240mm×240mm,层厚4.00mm,层间距0.40mm。每次采集500个时间点,每例患者连续采集2次,共2000s。通过MRI扫描仪与脑电图之间的同步导联线进行数据同步处理,仅在BOLD fMRI序列扫描时进行脑电图数据采集。同时行T1WI、T2WI、DWI、T2FLAIR序列扫描。
3.数据处理与分析
EEG数据预处理:采用Brain Product公司提供的Brain Vision Analyzer 2.0(http://www.brainproducts.com)软件进行脑电图离线数据处理,剔除MRI及心电伪影,由一名具有丰富临床经验的脑电图室技师阅片,标记癫痫样放电的导联、波形及起止时间等。BOLD-fMRI数据预处理:采用DPARSF(http://www.restfmri.net)对数据进行预处理,经层间时间校正、头动校正后将第一个采集时间点的数据配准至MNI(Montreal Neurological Institute提供)标准坐标空间,再采样成3mm×3mm×3mm,最终采用全宽半高均为8mm各向同性的高斯核进行平滑[10]。为了数据更加严格,首先剔除4例行EEG-fMRI过程中无IED出现的病例(13、17、18、19号患儿)。评估其余15个患儿数据,选取出250个发放集中的连续时间点,同时剔除头动过大(平动>1mm、转动>1°)的数据(3、7、8号患儿),最后获得12名患儿的数据进行分析。
IED激活分析:采用SPM8软件(http://www. fil.ion.ucl.ac.uk/spm)的广义线性模型(general liner model,GLM)的方法对IED事件相关脑功能改变进行分析,采用SPM8提供的经典血流动力响应函数(hemodynamic response function,HRF)模型[11]对IED相关的脑fMRI激活区进行检测,个例分析结果采用P<0.05,未校正的阈值门控。根据脑电偏侧性分组(全部纳入患者、双侧放电、左侧放电及右侧放电),采用SPM软件基于随机效应分析的单样本t检验进行组分析统计,结果采用P<0.05,未校正的阈值门控。激活区域位置信息来自于MNI提供的自动解剖标记(anatomical automatic labeling,AAL)脑图谱[12]。
兴趣区(region of interest,ROI)选取及脑区激活偏侧系数(encephalic regionactivelateralizationcoefficient,ERALC)计算。IED激活脑区定位:结合单侧组IED发放关联脑区激活结果,并排除所有被试组的平均激活的共有区域,挑选4对AAL图谱脑区作为IED激活脑区的ROI。双侧对应脑区激活体素数目计数:结合AAL图谱脑区的对应脑区及患者被试的IED激活结果,分别统计左右侧对应脑区内激活体素数目。ERALC计算:
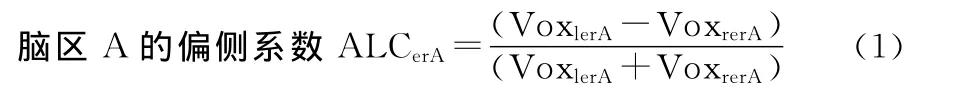
其中VoxlerA为左侧A脑区激活体素数目,VoxrerA为右侧A脑区激活体素数目。ALC的取值范围为-1到1,当ALC大于0时A脑区偏左侧激活,当ALC小于0时A脑区偏右侧激活,绝对值越接近1,偏侧性越强。
EEG信号偏侧性系数计算:分别计数患者A同步采集的EEG左侧大脑半球及右侧大脑半球所有导联IED的次数。计算同步采集的EEG的IED的偏侧系数,计算方式与前述类似:
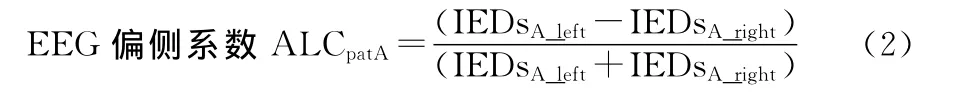
IEDsA_left为患者A左侧大脑半球IED放电次数,IEDsA_right为患者A右侧大脑半球IED放电次数。
脑区偏侧系数与EEG信号偏侧性系数相关性分析:采用Spearman等级相关分析对脑区偏侧系数与EEG信号偏侧性系数相关性进行分析,以P<0.01为差异具有统计学意义。
结 果
1.纳入分析患者的临床及EEG特征
本研究最终纳入12例RE患者的数据进行分析。其中男8例,女4例;年龄6~9岁,平均8岁;首次癫痫发作年龄4~9岁,平均6岁。纳入时4例患者未曾服药,4例患者服用过奥卡西平和左乙拉西坦,2例患者服用过丙戊酸,1例患者服用过丙戊酸和左乙拉西坦,1例患者服用过拉莫三嗪。在所供分析的EEG-fMRI数据时间段内,4例患者IED表现为双侧发放,5例为右侧发放为主,3例为左侧发放为主,IED次数1~75次,平均18.3次(表1)。
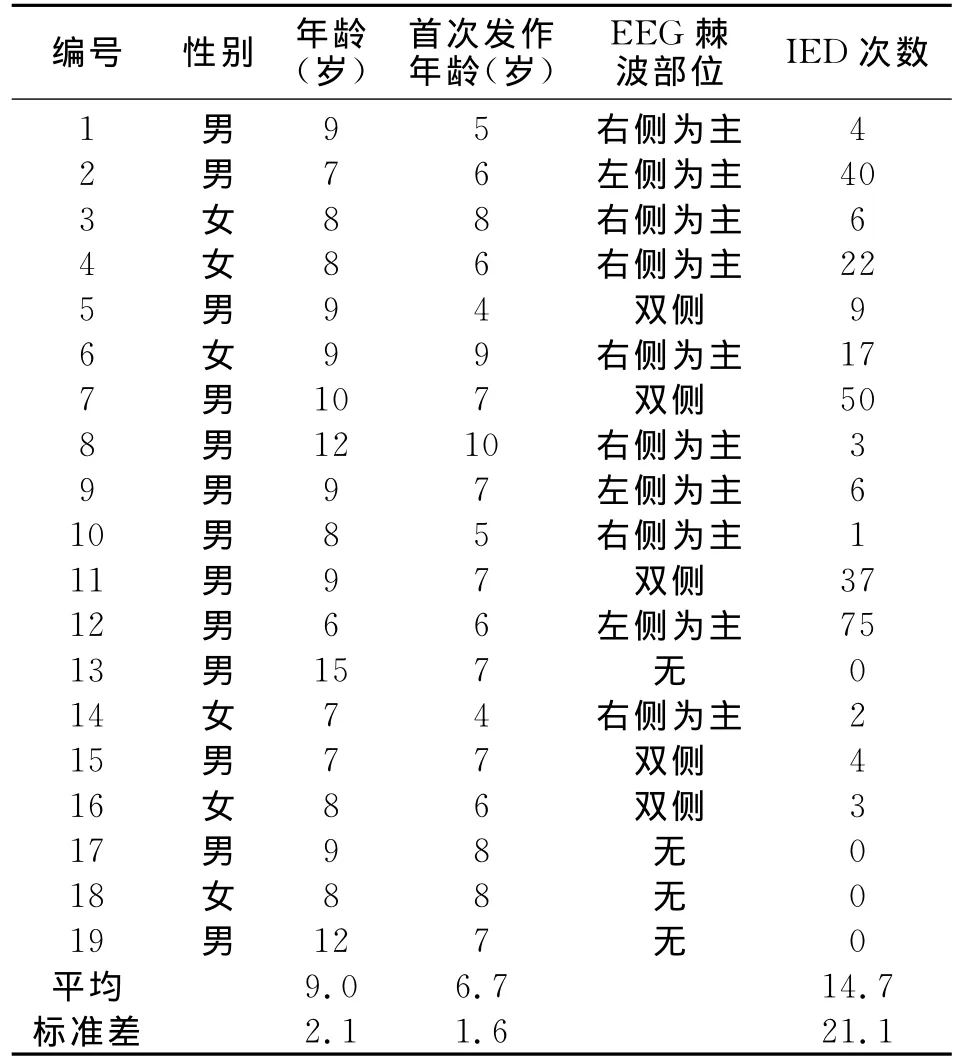
表1 RE患儿临床特征
2.EEG-fMRI结果
EEG-fMRI组分析结果:所有纳入分析患儿、双侧IED患儿、左侧为主IED患儿及右侧IED患儿的EEG-fMRI组分析结果可以显示不同分组IED相关脑功能激活区域的区别。所有病例组分析最大激活点位于左侧辅助运动区(t=5.0),激活主要出现在辅助运动区、基底节区、前中扣带回及颞上回。双侧IED病例组分析最大激活点位于右侧前扣带回(t=93.0),激活主要位于前中扣带回、中央前回、辅助运动区和额下回。左侧IED为主病例组分析最大激活点位于中央后回(t=65.7),激活主要位于中央后回、中央沟盖、缘上回及岛盖。右侧IED为主病例组分析最大激活点位于中央后回(t=11.88),主要激活区域为中央沟盖、中央后回、中央前回和岛盖。左侧组及右侧组激活主要集中于外侧裂-中央区(图1,表2)。
EEG-fMRI个体偏侧系数:选取双侧、左侧为主及右侧为主IED分组激活较集中的脑区,然后排除全部患儿组分区激活较为集中的脑区,并考虑到中央岛盖区体素较少,选择中央后回和中央沟盖、中央前回、岛盖、缘上回4个脑区分别计算偏侧系数(图1,表2)。分别有92%、83%、50%和75%的患者可以依据上述脑区判断偏侧性,在EEG偏侧系数不为0的病例中分别有100%、100%、50%和66.7%的病例与EEG偏侧性相同。中央后回和中央沟盖、中央前回、岛盖、缘上回4个脑区偏侧系数绝对值分别为0.47±0.32,0.55±0.44,0.11±0.17,0.53±0.41,0.62±0.47;与EEG偏侧性显著相关的为中央后回和中央沟盖、中央前回,相关系数分别为0.745和0.715(P<0.01),回归系数分别为0.421和0.264(图2,表3)。
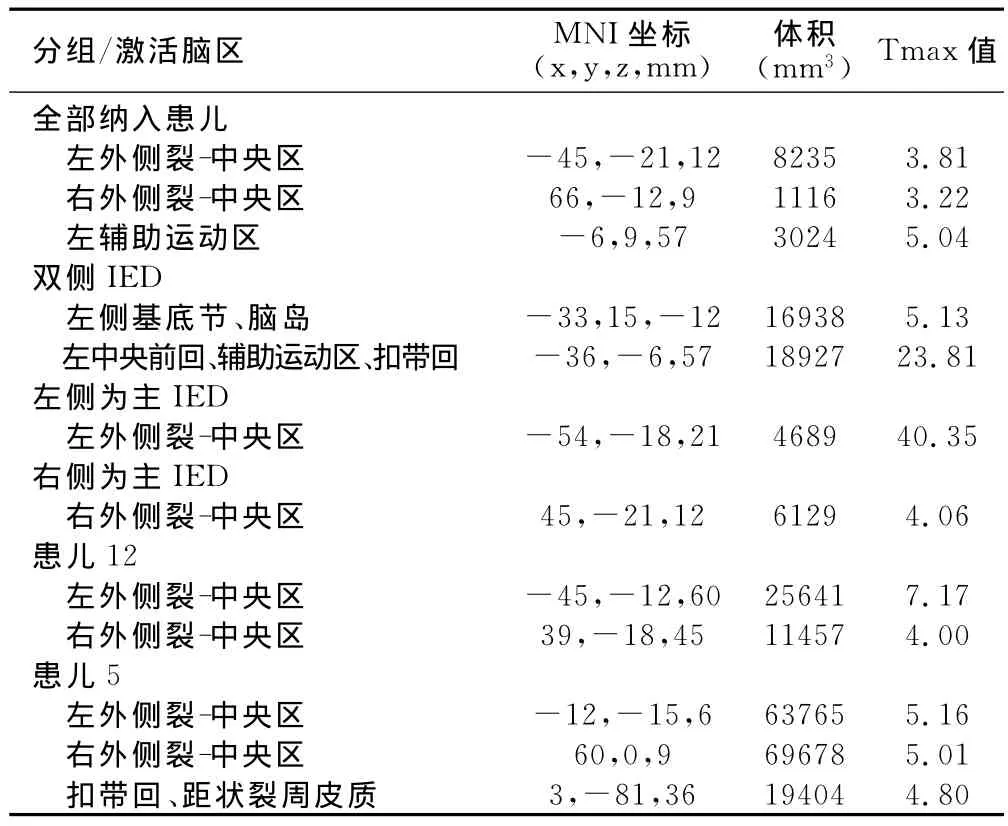
表2 不同分组及典型病例EEG-fMRI激活脑区分布表
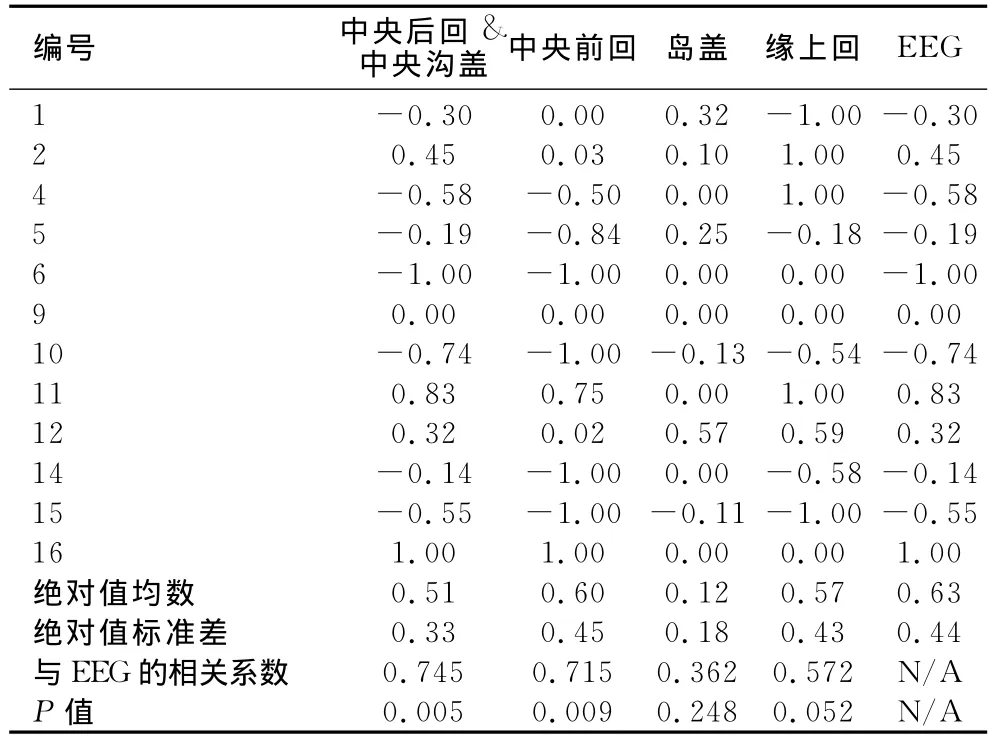
表3 不同脑区偏侧系数与EEG偏侧系数的关系
3.典型病例资料
患者12,7岁男性患者,右利手。6个月前开始出现入睡后牙关紧咬、四肢抽搐,共发作4次,常规EEG发现左侧颞中、颞后区尖慢波发放,目前尚未服用药物。EEG-fMRI显示最大激活点位于左侧颞上回近外侧裂处(t=7.1),主要激活区域为左外侧裂附近的颞上回、中央岛盖、中央后回和缘上回;最大负激活点位于右侧中央后回(t=7.59),主要负激活区域为右侧中央后回、缘上回、中央岛盖(图1e)。
患者5,7岁女性患者,右利手。3年前开始出现面部抽搐、流涎,5个月共发作4次,常规EEG发现左中央颞区高波幅棘慢波发放,服用奥卡西平及左乙拉西坦后未见临床发作,EEG仍有异常。EEG-fMRI示最大激活点位于右侧中央岛盖(t=4.7),主要激活区域为右侧中央前回、右侧中央后回、左侧中央前回、左侧中央后回和右侧中央岛盖(图1f)。

图1 不同分组及典型病例EEG-fMRI激活脑区。a)所有纳入患儿组分析结果;b)双侧IED患儿组分析结果;c)左侧为主IED患儿组分析结果;d)右侧为主IED患儿组分析结果;e)患儿12激活分布图;f)患儿5激活分布图。(暖色为正激活,冷色为负激活。蓝色圆圈代表外侧裂-中央区。)
讨 论
本研究发现RE的IED事件相关激活信号偏侧性明显,在全部纳入患者的组分析中,主要激活区域并不包括典型RE的IED区域,但是在EEG左侧为主及右侧为主分别进行的组分析中,可以看到激活区域主要分布于同侧的外侧裂周围皮质,包括中央后回、中央沟盖、中央前回、岛盖、缘上回。这种一致性有利于从空间角度探讨RE的起源。Kellaway等[13]以往基于EEG的研究推测RE的IED来源于中央沟深部,包括中央前回、中央后回和外侧裂周围的广泛的神经元池,本研究结果支持这个理论。
从个体水平上观察,83%出现外侧裂-中央区范围内的显著激活,和以往的功能磁共振研究相似[14-15]。与Boor等[14]的研究,本研究的敏感度有所提高(43%vs 83%),这可能和EEG的离线处理去除梯度伪影和心电伪影有关,这能帮助识别更多的IED。除了组分析的主要激活区域外,很多患者还有部位不具有一致性的远隔脑区激活,这可能和癫痫样活动的扩散有关,也可能由于个体水平的噪声引起。有11例患者具有明显负激活,部分患者负激活主要分布于fMRI偏侧性对侧的外侧裂周围皮质,64%患者对侧中央后回、中央沟盖、中央前回、岛盖、缘上回范围有明显高于同侧的负激活,负激活的意义尚不明确,一个可能的解释是负激活阻止放电扩散[16]。研究表明部分患者典型默认网络脑区[17]可见负激活。55%双侧距状裂周围皮质、楔叶、舌回、后扣带回可见明显负激活区域,这可能和IED引起的默认网络挂起有关[16]。
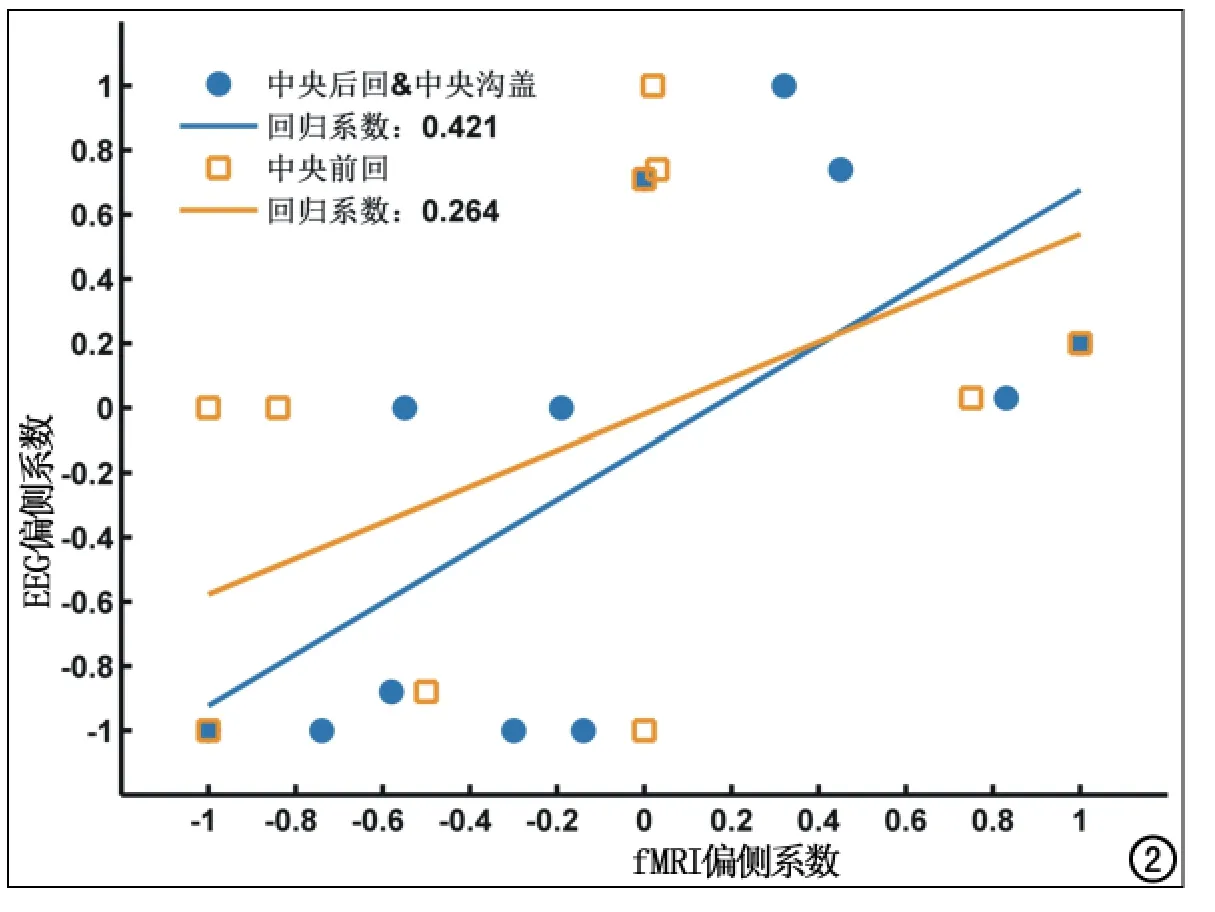
图2 部分脑区fMRI偏侧系数和EEG偏侧系数相关性散点图。
从组分析结果中选取激活明显的脑区行个体脑区偏侧性分析可以减少癫痫样电活动的传播和患者运动造成的噪声对癫痫灶的掩盖,分析后发现中央后回-中央沟盖区域和中央前回区域与EEG的偏侧性显著相关,这也支持了Kellaway等[13]的推测,而其他不具有相关性的脑区可能与癫痫样活动的传播有关。相比之下中央后回-中央沟盖区域最适合作为描述RE偏侧性的目标脑区,与EEG偏侧性的相关系数最强(0.745),92%的病例可通过该脑区判断癫痫偏侧性;但偏侧系数与神经精神病学量表、用药及预后的关系还需要进一步研究。本研究的病例数较少以至于不能做更为细致的分析,患者的病程、年龄、用药对于结果的影响也没有排除。
鉴于RE的IED位置与患者的认知损伤有关,本研究首次从RE偏侧性的角度进行EEG-fMRI研究,建立了以脑区激活偏侧系数为中心的fMRI偏侧性评估体系,发现EEG偏侧性与fMRI偏侧性指标显著相关。EEG-fMRI有望为临床确定患儿偏侧,指导治疗提供帮助。
[1] Panayiotopoulos CP,Michael M,Sanders S,et al.Benign childhood focal epilepsies:assessment of established and newly recognized syndromes[J].Brain,2008,131(Pt 9):2264-2286.
[2] Beaussart M.Benign epilepsy of children with Rolandic(centrotemporal)paroxysmal foci.A clinical entity.Study of 221cases[J].Epilepsia,1972,13(6):795-811.
[3] Giordani B,Caveney AF,Laughrin D,et al.Cognition and behavior in children with benign epilepsy with centrotemporal spikes(BECTS)[J].Epilepsy Res,2006,70(1):89-94.
[4] Baglietto MG,Battaglia FM,Nobili L,et al.Neuropsychological disorders related to interictal epileptic discharges during sleep in benign epilepsy of childhood with centrotemporal or Rolandic spikes[J].Dev Med Child Neurol,2001,43(6):407-412.
[5] Nicolai J,Aldenkamp AP,Arends J,et al.Cognitive and behavioral effects of nocturnal epileptiform discharges in children with benign childhood epilepsy with centrotemporal spikes[J].Epilepsy Behav:E&B,2006,8(1):56-70.
[6] Kramer U.Atypical presentations of benign childhood epilepsy with centrotemporal spikes:a review[J].J Child Neurol,2008,23(7):785-790.
[7] Wolff M,Weiskopf N,Serra E,et al.Benign partial epilepsy in childhood:selective cognitive deficits are related to the location of focal spikes determined by combined EEG/MEG[J].Epilepsia,2005,46(10):1661-1667.
[8] Moeller F,Stephani U,Siniatchkin M.Simultaneous EEG and fMRI recordings(EEG-fMRI)in children with epilepsy[J].Epilepsia,2013,54(6):971-982.
[9] Lengler U,Kafadar I,Neubauer BA,et al.fMRI correlates of interictal epileptic activity in patients with idiopathic benign focal epilepsy of childhood.A simultaneous EEG-functional MRI study[J].Epilepsy Res,2007,75(1):29-38.
[10] Zhang ZQ,Liao W,Chen HF,et al.Altered functional-structural coupling of large-scale brain networks in idiopathic generalized epilepsy[J].Brain,2011,134(Pt 10):2912-1928.
[11] Gotman J,Grova C,Bagshaw A,et al.Generalized epileptic discharges show thalamocortical activation and suspension of the default state of the brain[J].Proc Nati Acad Sci USA,2005,102(42):15236-15240.
[12] Tzourio-Mazoyer N,Landeau B,Papathanassiou D,et al.Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J].Neuroimage,2002,15(1):273-289.
[13] Kellaway P.The electroencephalographic features of benign centrotemporal(rolandic)epilepsy of childhood[J].Epilepsia,2000,41(8):1053-1056.
[14] Boor S,Vucurevic G,Pfleiderer C,et al.EEG-related functional MRI in benign childhood epilepsy with centrotemporal spikes[J].Epilepsia,2003,44(5):688-692.
[15] 李其富,罗程,周东,等.伴有中央颞区棘波的儿童良性癫痫同步脑电图-功能磁共振研究[J].中华神经医学杂志,2013,12(9):896-899.
[16] Kobayashi E,Bagshaw AP,Grova C,et al.Negative BOLD responses to epileptic spikes[J].Human Brain Mapping,2006,27(6):488-497.
[17] Raichle ME,Macleod AM,Snyder AZ,et al.A default mode of brain function[J].Proc Nati Acad Sci USA,2001,98(2):676-682.