华支睾吸虫硫氧还蛋白跨膜蛋白基因的生物信息学分析
周晨慧,徐道华,汪肖云,陈文君,李 珊
(广东医学院护理学院,广东东莞523808)
华支睾吸虫硫氧还蛋白跨膜蛋白基因的生物信息学分析
周晨慧,徐道华,汪肖云,陈文君,李 珊
(广东医学院护理学院,广东东莞523808)
目的对华支睾吸虫硫氧还蛋白跨膜蛋白(Cs TMX)基因进行生物信息学分析。方法利用生物信息学方法(InterProScan、SignalP、TMHMM和SWISS-MODEL等相关软件)对Cs TMX基因及相应氨基酸序列的同源性、理化性质、保守结构域、信号肽、亲水性/疏水性、三级结构进行预测分析。结果Cs TMX基因的开放阅读框(ORF)包含414 bp,编码137个氨基酸,理论分子质量为16.04×103,等电点为5.16。TMHMM和SignalP3.0分析结果显示Cs TMX含信号肽,其在第19~20位氨基酸之间有1个切割位点;InterProScan和SWISS-MODEL分析结果显示,TMX特征性结构域位于第21~ 27位氨基酸之间,并且具有高度保守的CPAC基因序列。结论利用生物信息学知识和各种分析软件对Cs TMX所编码的cDNA序列及理论蛋白质的理化性质、结构和功能域等进行预测和分析,能够为开展Cs TMX的表达及其功能研究提供理论依据。
华支睾吸虫病; 硫氧还蛋白质类; 膜蛋白质类; 基因; 计算生物学
华支睾吸虫病是由华支睾吸虫感染引起的一种食源性人兽共患寄生虫病,是当前我国最严重的食源性寄生虫病之一。华支睾吸虫囊蚴在十二指肠脱囊移入人或动物肝胆管中寄生,虫体摄食和迁移产生的机械损伤及其分泌代谢产物引起的化学损伤,均可引起宿主一系列肝胆管组织的病理改变。患者在急性期可表现为胆囊炎、胆管炎、黄疸型肝炎等,慢性感染易导致胆结石、肝纤维化,晚期可发生肝硬化,甚至原发性胆管癌和肝癌[1-3]。在全球范围内有近3 500万人感染华支睾吸虫,给人们的健康带来巨大威胁[4-5]。因此,有必要通过对华支睾吸虫基因组和功能基因组的研究,寻找合适的疫苗候选分子并深入研究其保护机制。
硫氧还蛋白跨膜蛋白(TMX)属于硫氧还蛋白超家族的成员之一,具有还原酶的特性,且广泛分布于多细胞生物。有研究报道,TMX可阻断主要组织相容性复合体Ⅰ类重链,从而在炎症或感染等病理状态下发挥免疫保护作用[6-8]。本研究主要运用生物信息学方法对华支睾吸虫TMX(Cs TMX)基因及相应氨基酸序列的同源性、理化性质、保守结构域、信号肽、跨膜结构域、亲水性/疏水性、三级结构及活性位点进行预测分析,为研究Cs TMX的功能提供理论参考。
1 材料与方法
1.1 材料 从华支睾吸虫全基因组数据库中搜索CsTMX基因同源序列。
1.2 方法
1.2.1 Cs TMX基因的识别 将目的基因序列在美国国立生物技术信息中心(NCBI)网站(http://www.ncbi.nlm. nih.gov/BLAST/)和基因数据库(GenBank)中的同源序列进行比对,判断该基因是否是全长基因。从中选取编码Cs TMX(GAA50073.1)的全长基因,应用NCBI网站open reading frame(ORF)finder确定其完整的编码序列(coding sequence,CDS)。
1.2.2 生物信息学分析
1.2.2.1 通过ExPASy(http://ca.expasy.org/)所提供的Prot Param、SignalP、InterProScan、TMHMM及SWISS-MODEL等在线工具预测蛋白质的理化性质、分泌信号肽、理论蛋白质一级结构中包含的结构和功能域特征序列、氨基酸序列跨膜区、理论蛋白功能位点,预测并模拟蛋白质的空间构象。
1.2.2.2 B细胞表位分析 利用B细胞表位在线分析软件(http://tools.immuneepitope.org/tools)预测蛋白质的B细胞表位。
2 结 果
2.1 CsTMX基因BlASTx的分析结果 BLASTx结果分析显示,该基因cDNA全长456 bp,编码区在1~414 bp,起始密码子为ATG,终止密码子为TAA,编码137个氨基酸。Cs TMX属于硫氧还蛋白超家族同源基因,与GenBank中的曼氏血吸虫蛋白质二硫键异构酶(PDI)的氨基酸序列的相似性为92%,一致性达51%,见图1。

图1 用NCBI的BLASTx程序进行Cs TMX同源性分析结果
2.2 蛋白质的理化性质 通过ProtParam程序(http:// web.expasy.org/protparam/)对Cs TMX进行理化性质预测,Cs TMX编码序列一级结构分析显示,该序列编码137个氨基酸,理论相对分子质量为16.04×103,等电点为5.16,偏酸性。该蛋白序列的N末端为甲硫氨酸,其在哺乳动物网状红细胞体外表达的半衰期为30 h,在酵母体内表达的半衰期大于20 h,在大肠杆菌中表达的半衰期大于10 h。在溶液中的不稳定指数为55.56,高于域值40。疏水指数为82.47,总亲水性0.135,蛋白质总体疏水性较低。
2.3 信号肽序列分析 SignalP3.0分析结果显示Cs TMX可能含信号肽,其切割位点在第19~20位氨基酸之间,见图2。
2.4 InterProScan 扫描一级结构中包含的结构和功能域特征序列,分析结果显示,Cs TMX属于硫氧还蛋白超家族,硫氧还蛋白特征性结构域位于第21~27位氨基酸之间,见图3。
2.5 TMHMM预测Cs TMX氨基酸序列的跨膜区 结果显示,ans体疏水性较低,TMHMM预测氨基酸序列的跨膜区,Cs TMX有1个跨膜结构,位于第1~20位氨基酸之间,见图4。

图2 Cs TMX信号肽SignalP3.0分析结果
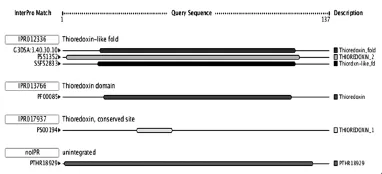
图3 InterProScan分析Cs TMX一级结构中的功能域

图4 TMHMM预测C s TMX氨基酸序列的跨膜区
2.6 B细胞线性表位分析 利用http://tools.immuneepitope.org/tools的BepiPred分析工具预测Cs TMX的B细胞线性表位,分值较高的线性表位区域位于第27~32位氨基酸、第58~65位氨基酸、第74~77位氨基酸、第121~124位氨基酸之间(图5),相应表位的氨基酸序列见表1。

图5 C s TMXB细胞线性表位预测
2.7 SWISS-MODEL分析Cs TMX的三维结构 SWISSMODEL将Cs TMX与蛋白结构数据库中的蛋白质三维结构进行匹配,得到模拟的华支睾吸虫Cs TMX三维结构图,左上角圆圈部分为其高度保守CPAC基因序列,见图6。

表1 C s TMX组成B细胞表位氨基酸序列

图6 SWI SS-MODEL分析华支睾吸虫Cs TMX的三维结构
3 讨 论
随着分子寄生虫学的不断发展,从分子水平认识寄生虫及其致病机制已成为寄生虫研究领域的热点之一。作者旨在研究Cs TMX及其编码蛋白质的结构与功能,为解决华支睾吸虫病的防治问题提供基础理论性研究。
生物信息学是涵盖生命科学、计算机科学及数学等学科,包含生物信息的获取、处理、储存、分发、分析和解释的一门学科,目的在于了解大量的生物学意义[9]。本研究通过利用美国NCBI和欧洲ExPASy网站所提供的大量在线分析程序[10-11],对华支睾吸虫成虫cDNA文库硫氧还蛋白超家族同源序列与NCBI网站进行多序列比对,从中选取编码Cs TMX全长cDNA序列并对其编码的氨基酸序列进行全面的生物信息学分析,包括其理化性质、功能域、跨膜结构、信号肽和三级结构等,为Cs TMX基因的后续研究提供线索和依据。
将Cs TMX与NCBI网站中的同源序列进行多序列比对,发现Cs TMX编码序列理论蛋白相对分子质量为16.04×103,等电点为5.16,偏酸性,重组蛋白在溶液中性质较不稳定。TMHMM预测Cs TMX氨基酸序列的跨膜结构提示,Cs TMX含有1个跨膜区,跨膜结构位于第1~ 20位氨基酸之间。SignalP3.0分析结果显示,Cs TMX含信号肽,其在第19~20位氨基酸之间有1个切割位点。TMHMM和SignalP3.0分析结果提示,在对Cs TMX进行原核系统表达时,应将Cs TMX氨基酸序列中编码信号肽的部分取出,以有利于r Cs TMX在原核系统中的表达。目前已有研究证实,与Cs TMX同属于硫氧还蛋白家族的PDI是日本血吸虫、曼氏血吸虫、肝片吸虫和牛血吸虫等的分泌排泄抗原[12]。Blastx结果显示Cs TMX与曼氏血吸虫PDI高度同源,那么Cs TMX是否可以分泌到细胞外成为华支睾吸虫的分泌排泄抗原(Cs ESAs)组成之一,还有待于进一步研究。Cs TMX的B细胞线性表位预测发现有4个分值较高的线性表位区域。
总之,利用生物信息学知识和各种分析软件对Cs TMX所编码的cDNA序列及理论蛋白质的理化性质、结构和功能域等进行预测和分析,有利于了解Cs TMX潜在的生物学功能,并为选择和设计实验方案提供一定的理论依据和策略。
[1]Yang GJ,Liu L,Zhu HR,etal.China′s sustained drive to eliminate neglected tropicaldiseases[J].Lancet InfectDis,2014,14(9):881-892.
[2]Fried B,Reddy A,Mayer D.Helminths in human carcinogenesis[J].Cancer Lett,2011 305(2):239-249.
[3]Chen T,Ning D,Sun H,etal.Sequence analysis andmolecular characterization of Clonorchis sinensis hexokinase,an unusual trimeric 50-kDa glucose-6-phosphate-sensitive allosteric enzyme[J].PLoS One,2014,9(9):e107940.
[4]Xu LL,Jiang B,Duan JH,etal.Efficacy and safety of praziquantel,tribendimidine andmebendazole in patientswith co-infection of Clonorchis sinensisand other helminths[J].PLoSNegl Trop Dis,2014,8(8):e3046.
[5]Qian MB,Chen YD,Fang YY,etal.EpidemiologicalprofileofClonorchis sinensis infection in one community,Guangdong,People′s Republic of China[J].ParasitVectors,2013,6:194.
[6]Matsuo Y,Irie K,KiyonariH,etal.The protective role of the transmembrane thioredoxin-related protein TMX in inflammatory liver injury[J]. Antioxid Redox Signal,2013,18(11):1263-1272.
[7]PasettoM,Barison E,CastagnaM,etal.Reductiveactivation of type2 ribosome-inactivating proteins is by promoted transmembrane thioredoxinrelated protein[J].JBiolChem,2012,287(10):7367-7373..
[8]IshiiT,Funato Y,MikiH.Thioredoxin-related protein 32(TRP32)specifically reducesoxidized phosphatase of regenerating liver(PRL)[J].JBiol Chem,2013,288(10):7263-7270.
[9]尹一兵.分子诊断学[M].北京:高等教育出版社,2007:182.
[10]Bao Y,Federhen S,Leipe D,et al.National center for biotechnology information viralgenomesproject[J].JVirol,2004,78(14):7291-7298.
[11]WilkinsMR,Gasteiger E,Bairoch A,etal.PProtein identification and analysis tools in the ExPASy server[J].MethodsMol Biol,1999,112:531-552.
[12]Hu Y,Huang L,Huang Y,et al.Molecular cloning,expression,and immunolocalization of protein disulfide isomerase in excretory-secretoryproducts from Clonorchissinensis[J].Parasitol Res,2012,111(3):983-989.
Bioinformaticsanalysisof thioredoxin transmembrane-related protein from clonorchis sinensis
Zhou Chenhui,Xu Daohua,Wang Xiaoyun,ChenWenjun,LiShan(SchoolofNursing,GuangdongMedicalCollege,Dongguan,Guangdong523808,China)
ObjectiveTo analyze protein characteristicsof thioredoxin-related transmembrane protein gene of clonorchis sinensis(Cs TMX)by bioinformation.MethodsThe homology,physicochemicalproperty,conserved domain,signal peptide,hydrophilcity,hydrophobicity and the tertiary structure of Cs TMX and amino acid sequencewere predicted by bioinformatic analysis software such as InterProScan,SignalP,TMHMM and SWISS-MODEL.ResultsThe open reading frame of Cs TMX cDNA included 414 bp,coded 137 amino acidswith theoreticalmolecularweightbeing16.04×103and isoelectric pointbeing 5.16.TMHMM and SignalP3.0 analysis showed that Cs TMX contained signal peptide,having a cleavage site between 19th and 20th aminoacids.InterproScan and SWISS-MODEL analysis indicated the characterized TMX domainwas found in the position of21st-27th amino acidsbeing possesswith highly conserved CPAC gene sequence.ConclusionThe bioinformatics analysis and various softwaremay predictand analyze cDNA sequences coded by Cs TMX and physicochemicalproperty,structure and function domain of theoreticalprotein,which isavailable forproviding theoreticalbasisofexpression of Cs TMX.
Clonorchiasis; Thioredoxin; Membrane protein; Gene; Computationalbiology
10.3969/j.issn.1009-5519.2015.07.005
:A
:1009-5519(2015)07-0969-03
2014-10-13
2014-12-08)
广东医学院科研基金面上项目(M2011022)。
周晨慧(1974-),女,山西太原人,博士研究生,讲师,主要从事病原生物学研究;E-mail:chenhuizh6@126.com。

