粒毛盘菌DP5胞外多酚的提取及抗氧化活性研究
曹焕英,孙丹宇,杨 柳,钱 潇,牛兆众
(合肥工业大学生物与食品工程学院,安徽合肥 230009)
粒毛盘菌DP5胞外多酚的提取及抗氧化活性研究
曹焕英,孙丹宇,杨 柳*,钱 潇,牛兆众
(合肥工业大学生物与食品工程学院,安徽合肥 230009)
[目的]使用树脂对粒毛盘菌DP5胞外多酚进行提取,并且对其体外抗氧化活性进行评价。[方法]以多酚得率为指标,优化粒毛盘菌DP5胞外多酚的提取工艺。[结果]以大孔树脂X-5为填充料,进样浓度为0.64 mg/ml,进样流速为1 ml/min,洗脱溶剂为浓度80%的乙醇,洗脱流速为1 ml/min,粒毛盘菌胞外多酚含量为815.7 mg GAE/g。体外抗氧化试验表明,粒毛盘菌DP5胞外多酚具有还原力和清除DPPH自由基、羟自由基(·OH)、亚硝酸盐(NO2-)的效果,且随着多酚浓度的升高其活性增强。[结论]该研究结果为粒毛盘菌多酚的开发利用提供理论依据。
粒毛盘菌;胞外多酚;提取;抗氧化活性
多酚是苯环上联有多个羟基的化合物的总称。多酚特有的化学结构赋予其良好的抗氧化活性。多酚是植物体内的重要次生代谢产物,广泛存在于植物的皮、根、叶、果。多酚也可由桦褐孔菌、盘龙参内生真菌等发酵获得。真菌多酚具有较强的自由基清除能力[1-3]。
粒毛盘菌属(Lachnum)是一类具有重要应用价值的真菌,在深层发酵条件下可以产生多糖、黑色素、多酚等生物活性物质[4-6]。目前,关于粒毛盘菌胞外多酚的纯化与活性的研究报道较少。笔者将粒毛盘菌DP5胞外多酚进行纯化,并对纯化后的多酚进行抗氧化活性的测定,为粒毛盘菌胞外多酚的研究提供一定的科学基础。
1 材料与方法
1.1 试验材料 供试菌种为粒毛盘菌DP5菌株。子实体采集自中国云南省,由合肥工业大学微生物资源与应用研究室分离、保藏。
1.2 试验方法
1.2.1 多酚粗提液的制备。取粒毛盘菌发酵液,醇沉,离心除多糖、蛋白,有机溶剂脱曲酸,离子交换树脂脱氨基酸,浓缩得多酚粗提液。
取发酵液,按体积比1∶1加入无水乙醇,4 ℃静置过夜,进行醇沉脱蛋白、多糖等杂质,离心,取上清液进行浓缩,将浓缩液置于冰箱,4 ℃静置24 h,脱掉部分曲酸,用乙酸乙酯萃取,除掉剩余曲酸,过通用性阳离子交换树脂脱掉氨基酸和部分还原糖,收集滤液,得多酚粗提液。
1.2.2 多酚的测定(普鲁士蓝法)。采取Martin L.的方法进行适当修改[7]。取适当稀释的待测液l ml于25 ml比色管中,加入1 ml 0.1 mol/L 氯化铁溶液、1 ml 0.008 mol/L铁氰化钾溶液,混匀,30 ℃保温15 min,定容至25 ml,摇匀,用紫外分光光度计在700 nm下测定OD值。以没食子酸为标准品,测定标准曲线。
1.2.3 柱层析试验。分别选用不同型号的大孔树脂和硅胶作为柱层析填充料,进行静态吸附与解吸试验,选择合适的树脂或硅胶作为柱层析的填充料。通过动态吸附与解吸试验,确认最佳上样浓度、上样流速、洗脱溶剂、洗脱流速。
1.2.4 多酚的体外抗氧化活性分析。
1.2.4.1 还原力的测定。参考Lillian等[8]方法,取2.5 ml样液于试管中,加入2.5 ml 0.2 mol/L磷酸缓冲溶液(pH 6.6)和2.5 ml浓度1%铁氰化钾溶液,50 ℃水浴20 min,取出后冷却,再加入浓度10%三氯乙酸2.5 ml,摇匀,终止反应。取该溶液5 ml,加入4 ml蒸馏水和1 ml浓度0.1% FeCl3溶液,混匀,静置15 min,在700 nm处测吸光值。吸光值越大,说明溶液的还原能力越强。
1.2.4.2 多酚提取样对NO2-的清除效果。取2 ml亚硝酸钠溶液(5 mg/L)于25 ml比色管中,加入3 ml样品溶液,混匀,常温下反应30 min,加入0.5 ml浓度0.2%盐酸萘乙二胺溶液,加水定容至25 ml,摇匀,静置15 min,在538 nm处测定吸光值。多酚对亚硝酸盐(NO2-)的清除率公式为:
NO2-清除率(%)=100%×[A0-(A2-A1)]/A0
式中,A0为空白对照的吸光度;A1为样品溶液的吸光度;A2为样品溶液加入亚硝酸钠反应后的吸光度。
1.2.4.3 多酚提取样对羟自由基(·OH)的清除效果。参考Wang等[9]的方法,并略作修改,取2 ml样液于试管中,加入2 ml 9 mmol/L FeSO4溶液和2 ml 9 mmol/L水杨酸-乙醇溶液,充分混匀后,加入2 ml 8.8 mmol/LH2O2溶液,混匀,37 ℃下反应30 min,510 nm处测定吸光值。空白对照组以相同体积的蒸馏水代替样品溶液及8.8 mmol/L H2O2溶液。多酚对·OH的消除率公式为:
·OH消除率(%)=100%×[A0-(A2-A1)]/A0
式中,A0为空白对照的吸光度;A1为样品溶液的吸光度;A2为样品溶液加入H2O2溶液反应后吸光度。
1.2.4.4 多酚提取样对DPPH自由基的清除效果。取一定浓度的多酚溶液4 ml于试管中,加入1 ml 1 mmol/L无水乙醇配制的DPPH自由基溶液,振荡混匀后避光静置30 min,于517 nm处测定吸光值,计算多酚对DPPH的清除率,以VC为阳性对照。
DPPH清除率(%)=100%×[A0-(A2-A1)]/A0
式中,A0为DPPH和水的吸光度;A1为样品溶液的吸光度;A2为样品溶液加入DPPH反应后吸光度。
2 结果与分析
2.1 柱层析试验
2.1.1 不同树脂对粒毛盘菌胞外多酚(LEP)吸附与解析的影响。分别选用大孔树脂D1300、D101、X-5、AB-8、D201、D70和硅胶,进行静态吸附与解吸试验。由表1可知,大孔树脂X-5的吸附与解吸效果最佳。选择大孔树脂X-5作为柱层析的填充料进行后续研究。
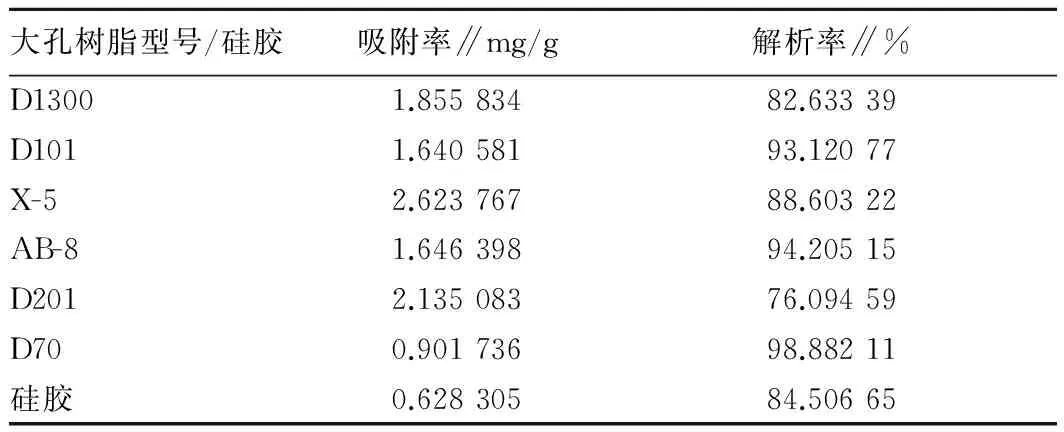
表1 不同大孔树脂与硅胶树脂对粒毛盘菌胞外多酚吸附与解析的影响
2.1.2 动态吸附与解吸试验。
2.1.2.1 进样浓度与进样流速的选择。进样浓度设为0.16、0.32、0.48、0.64、0.80 mg/ml,上样流速设为0.5、1.0、1.5、2.0和3.0 ml/min,收集流出液,测定粒毛盘菌胞外多酚含量,计算树脂的动态吸附量。
由图1和图2可知,以不同浓度多酚溶液进样,当多酚浓度低于0.64 mg/ml时,随着多酚浓度的提高,多酚吸附率随之增大,而当继续增加多酚浓度时,多酚吸附率基本达到平衡,吸附率不再增加。因此,选择进样浓度为0.64 mg/ml。随着进样流速的增大,多酚的吸附率呈下降趋势,在进样液流速为0.5 ml/min时多酚的吸附率最高,但是进样时间较长。经综合考虑,选择进样流速为1 ml/min。
2.1.2.2 洗脱剂种类的选择。洗脱剂分别为乙醚、乙酸乙酯、甲醇以及浓度50%、80%、100%乙醇。由图3可知,浓度50%乙醇对多酚的解吸效果最佳,但是由于其水含量较高,洗脱的杂质也较多。经综合考虑,选择浓度80%乙醇进行洗脱。
2.1.2.3 洗脱流速的选择。分别以0.5、1.0、1.5和2.0 ml/min的流速洗脱,以1 BV为1单位收集流出液,测定多酚含量,绘制洗脱曲线。由图4可知,当洗脱剂的流速较小时,洗脱峰较早出现,且较集中,峰也越高,拖尾现象越不明显,所以洗脱流速越小,洗脱效果越好。经综合考虑,选择洗脱速率为1 ml/min。
2.1.3 验证试验。将多酚提取液用大孔树脂X-5进行吸附,进样浓度为0.64 mg/ml,进样流速为1 ml/min,洗脱溶剂为浓度80%乙醇,洗脱流速为1 ml/min,收集解吸液,浓缩后冷冻、干燥,得固体。经测定,粒毛盘菌胞外多酚的含量由432.7 mg GAE/g提高到815.7 mg GAE/g。
2.2 粒毛盘菌的生物活性试验 生物活性物质的抗氧化性与其还原力有一定的关系。还原力越强,其抗氧化活性越高[10-11]。由图5可知,粒毛盘菌DP5胞外多酚的还原力随着多酚浓度的提高,其还原力增强,与VC的还原力相差不大。粒毛盘菌胞外多酚具有一定的抗氧化能力。
由图6可知,粒毛盘菌DP5胞外多酚对DPPH自由基的清除效果高于VC,且随着多酚浓度的升高,其清除率增加。当多酚浓度为0.15 mg GAE/ml,VC浓度为0.15 mg/ml时,多酚对DPPH自由基的清除率是VC的2倍。由此可知,粒毛盘菌DP5胞外多酚具有较强的DPPH自由基清除效果。
NO2-是亚硝胺的前体物质。亚硝胺是人体内的强致癌物。通过消除体内的NO2-,可以降低癌症发病率[12]。由图7可知,粒毛盘菌DP5胞外多酚对NO2-的清除效果明显,当多酚浓度达到0.2 mg GAE/ml时对NO2-的清除率达到50%。
羟基自由基是目前所知活性氧自由基中对生物体毒性最强、危害最大的一种自由基。它可以通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,造成糖类、氨基酸、蛋白质、核酸和脂类等物质的氧化损伤,使得细胞坏死或突变[13]。由图8可知,粒毛盘菌DP5胞外多酚对·OH自由基具有一定的清除效果。
3 结论
采用柱层析的方法,对粒毛盘菌DP5胞外多酚进行纯化。选用X-5大孔树脂作为柱层析的填充料,并且对其上样浓度、上样流速、洗脱溶剂和洗脱流速进行研究,得出最合适的条件,使得粒毛盘菌胞外多酚含量由432.7 mg GAE/g提高到815.7 mg GAE/g,并且对其生物活性进行研究。研究表明,粒毛盘菌DP5胞外多酚对DPPH、NO2-和·OH均有消除效果,且均有还原力。
[1] 高宁,毕珊珊,胡凤,等.盘龙参内生真菌抑菌活性的初步研究[J].广东药学院学报,2011,27(4):367-370.
[2] 朱金卫,徐向群.桦褐孔菌多酚的液体深层制备及抗氧化活性研究[J].浙江理工大学学报,2011,28(5):616-620.
[3] 高雪丽,高愿军,李建光,等.桦褐孔菌多酚对食用油脂的抗氧化效果[J].食品工业科技,2008,29(1):135-137.
[4] YE M,QIU T,PENG W,et al.Purification,characterization and hypoglycemic activity of extracellular polysaccharides fromLachnumcalyculiforme[J].Carbohydrate Polymers,2011,86(1):285-290.
[5] YE M,WANG Y,GUO G Y,et al.Physicochemical characteristics and antioxidant activity of arginine-modified melanin fromLachnumYM-346[J].Food Chemistry,2012,135(4):2490-2497.
[6] 叶明,朱立.辛格粒毛盘菌胞内多酚提取及其抗氧化性研究[J].食品科学,2008,29(8):249-252.
[7] PRICE M L,BUTLER L G.Rapid visual estimation and spectrophotometric determination of tannin content of sorghum Grain[J].Agric Food Chem,1977,25(6):1268-1273.
[8] LILLIAN B,SORAIA F,PAULA B,et al.Antioxidant activity ofAgaricussp.mushrooms by chemical,biochemical and electrochemical assays[J].Food Chemistry,2008,111(1):61-66.
[9] WANG H Y,JIANG X L,MU H J,et al.Structure and protective effect of exopolysaccharide fromP.Agglomeransstrain KFS-9 against UV radiation[J].Microbiological Research,2007,162(2):124-129.
[10] SHON M Y,KIM T H,SUNG N J.Antioxidants and free radical scavenging activity ofPhellinusbaumii(PhellinusofHymenoehaetaceae) extracts[J].Food Chemistry,2003,82(4):593-597.
[11] DORMAN H J D,KOSAR M,KAHLOS K,et al.Antioxidant properties and composition of aqueous extracts fromMenthaspecies,hybrids,varieties,and cultivars[J].Journal of Agricultural Food Chemistry,2003,51(6):4563-4569.
[12] 于淑池,侯金鑫.龙井茶多糖对自由基和NO2-清除作用研究[J].食品研究与开发,2012,3(4):28-31.
[13] 回晶,李其久,边媛媛,等.桑黄总黄酮超声提取工艺及其生物活性研究[J].食品科学,2010,31(24):195-198.
ExtractionandAntioxidant Activity of Extracellular Polyphenols fromLachnumDP5
CAO Huan-ying, SUN Dan-yu, YANG Liu*et al
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei, Anhui 230009)
[Objective] The study was to optimize the extraction process of the extracellular polyphenols fromLachnumDP5 (LEP) using resin, and investigate its antioxidant activitiesinvitro.[Method] LEP were extracted and optimal conditions were investigated using single factor experiments. [Result] Macroporous resin X-5 was selected and the extraction conditions were as following: sample concentration of 0.64 mg/ml, the injection flow rate of 1 ml/min, elution solvent of 80% ethanol, the elution flow rate of 1 ml/min. The contend of LEP reached 815.7 mgGAE/g under the optimal conditions. Antioxidant activity analysisin vitro for LEP extraction indicated that the LEP have the ability to scavengingfree radical of DPPH,hydroxyl, NO2-and restoring and the activity was related to its concentrations. [Conclusion]This study was aimed to provide theoretical basis for the development and utilization of LEP.
Lachnum;Extracellular polyphenol; Extraction;Antioxidant activities
合肥工业大学大学生创新创业训练计划项目(2014CX-CYZ041)。
曹焕英(1989-),女,山东潍坊人,硕士研究生,研究方向:真菌活性物质。*通讯作者,副教授,博士,从事应用微生物方面的研究。
2015-04-20
S 509.9
A
0517-6611(2015)17-012-03

