污白干酪菌核糖核酸酶的分离纯化和理化性质*
耿雪冉,柳万石,王贺祥**
(1.中国农业大学生物学院农业生物技术国家重点实验室,北京 100193;2.金亨稷师范大学,朝鲜 平壤 999093)
污白干酪菌核糖核酸酶的分离纯化和理化性质*
耿雪冉1,柳万石2,王贺祥1**
(1.中国农业大学生物学院农业生物技术国家重点实验室,北京 100193;2.金亨稷师范大学,朝鲜 平壤 999093)
采用DEAE-cellulose阴离子交换层析、CM-cellulose阳离子交换层析和FPLC-Superdex-75凝胶过滤层析,从污白干酪菌(Tyromyces amygdalinus)干子实体纯化得到一种核糖核酸酶,SDS-PAGE电泳检测其为单一蛋白,分子量为25 kDa。最适反应条件为60℃,pH4.4。该酶对几种寡聚核糖核苷酸的水解活性低于对t-RNA的水解活性。
污白干酪菌;核糖核酸酶;分离纯化;理化性质
核糖核酸酶(ribonuclease,RNase),是一类广泛存在于动物、植物以及微生物体内的核酸水解酶,其全名为聚核苷-α-寡核苷转移酶。核糖核酸酶的主要生理功能是降解生物体内的RNA,控制RNA的种类以及数量,参与核糖核酸转录后的剪切、修饰和降解等过程;还与某些植物的自交不亲和性、器官发生、控制肿瘤血管生成[1]、杀灭肿瘤细胞以及抑制病毒(包括HIV-1)的复制等有关[2]。
迄今为止,已经从多种大型真菌中分离纯化得到的核糖核酸酶有20多种,比如香菇(Lentinus edodes)[3]、刺芹侧耳 (Pleurotus eryngii)[4]、凤尾菇(Pleurotus sajor-caju)[5]等。这些大型真菌来源的核糖核酸酶的分子量、理化性质以及氨基酸序列都存在较大差异,生物学功能也各不相同。
污白干酪菌(Tyromyces amygdalinus)隶属于担子菌门(Basidiomycota) 层菌纲(Hymenomycetes)非褶菌目(Polyporales)多孔菌科(Polyporaceae)干酪菌属(Tyromyces)。污白干酪菌分布于河北、安徽、浙江、湖南、海南、四川、贵州、云南、福建等地,夏秋季生树木上,可导致木材腐朽。目前对该菌的研究较少,尤其是生理活性物质的研究更少。本文从污白干酪菌的子实体中分离纯化出一种核糖核酸酶,并对其部分性质进行研究,拟为污白干酪菌核糖核酸酶进一步的研究应用提供参考。
1 材料和方法
1.1 试验材料
污白干酪菌干子实体。
1.2 试验方法
1.2.1 核糖核酸酶活性测定方法
将5 μL酶液加到135 μL,0.1 mol·L-1pH4.4 NaAc-HAc缓冲液中,然后加入10 μL底物tRNA(10 mg·mL-1);空白对照以5 μL去离子水代替酶样品,其他同样品管。将其充分混匀后,37℃水浴反应15 min,迅速加入350 μL 3.8%高氯酸终止反应,12 000 r·min-1离心5 min后取上清于260 nm处测定吸光度。
酶活性定义:以260 nm处每分钟、每毫升反应液产生1个吸光值所需要的酶量作为一个酶活力单位。
1.2.2 核糖核酸酶粗样品的制备
称量污白干酪菌干子实体10 g,加入200 mL的去离子水组织匀浆破碎,4℃抽提过夜。匀浆液9 000 r·min-1离心10 min,取上清液,得到粗样品。
1.2.3 DEAE-cellulose阴离子交换层析
粗提取物通过DEAE-cellulose阴离子交换层析,层析柱预先用10 mmol·L-1Tris-HCl(pH 8.4) 缓冲液平衡,上样后以同一缓冲液将不吸附的组分洗脱,再分别用含150 mmol·L-1NaCl、500 mmol·L-1NaCl和1 mol·L-1NaCl的缓冲液进行分段洗脱,得到活性组分。
1.2.4 CM-cellulose阳离子交换层析
将DEAE-cellulose阴离子交换层析所得活性组分充分透析后,通过预先用10 mmol·L-1pH 4.4 NaAc-HAc-缓冲液平衡好的CM-cellulose阳离子交换层析柱,上样之后以同一缓冲液将不吸附的组分洗脱下来,再分别用含150 mmol·L-1NaCl、300 mmol·L-1NaCl和1 mol·L-1NaCl的缓冲液进行分段洗脱,得到活性组分。
1.2.5 FPLC-Superdex-75HR 10/300凝胶过滤层析
将CM-cellulose阳离子交换层析所得活性组分充分透析,冷冻干燥,进行FPLC-Superdex-75凝胶过滤层析,层析柱预先用150 mmol NH4HCO3(pH 8.4)缓冲液平衡,即得到活性组分。
1.2.6 SDS-PAGE电泳检测
纯化所得的核糖核酸酶通过SDS-PAGE检验纯度及分子量。取20 μL核糖核酸酶样品,加入5 μL上样缓冲液,混合后煮沸5 min,12 000 r·min-1离心1 min,取上清,加样,电泳检测。电泳条件:浓缩胶(5%)和分离胶(15%)采用恒压180 V。电泳完毕后,加入考马斯亮蓝G-250染色1 h~2 h,脱色液脱色至本底无色,对比标准蛋白分子量并且结合FPLC结果计算分离得到的核糖核酸酶分子量。
1.2.7 RNase氨基酸序列的质谱分析
RNase氨基酸序列的质谱分析由广州辉骏生物科技公司完成,所用仪器为纳升级高效液相色谱仪-线性离子肼-静电场轨道肼质谱联用仪(nano-flow HPLC-LTQ-Orbitrap mass spectrometer)。
1.2.8 RNase的理化性质
最适反应pH:配制0.1 mol·L-1不同pH的缓冲液,将纯化所得的RNase加入到上述缓冲液中,按照标准方法测定酶活力,活力最高值为100%,以相对活力为纵坐标,相应的pH值为横坐标作图。
最适反应温度:将纯化所得的RNase在最适pH条件下,分别在4℃、15℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃的温度下反应15 min,按照标准方法测定酶活力,活力最高值为100%,以相对活力为纵坐标,相应的温度值为横坐标作图。
热稳定性:将纯化所得的RNase在不同温度条件下作用1 h后,按照标准方法测定酶活力,未孵育的初始活力值为100%,以相对活力为纵坐标,相应的温度值为横坐标作图。
RNase对寡聚核糖核苷酸的水解作用:以10 mg·mL-1的poly(A)和poly(C)为反应底物,将5 μL的酶样品加入到 135 μL,0.1 mol·L-1pH4.4 NaAc-HAc缓冲液中,然后加入10 μL底物;空白对照以5 μL去离子水代替酶样品,其余都相同。充分混匀后,置于37℃水浴反应15 min,迅速加入350 μL 3.8%高氯酸终止反应,12 000 r·min-1离心5 min,poly(A)上清在260 nm处测定吸光值,poly(C)上清在280 nm处测定吸光值。
2 结果与分析
2.1 污白干酪菌RNase的分离纯化结果
污白干酪菌RNase洗脱曲线见图1。
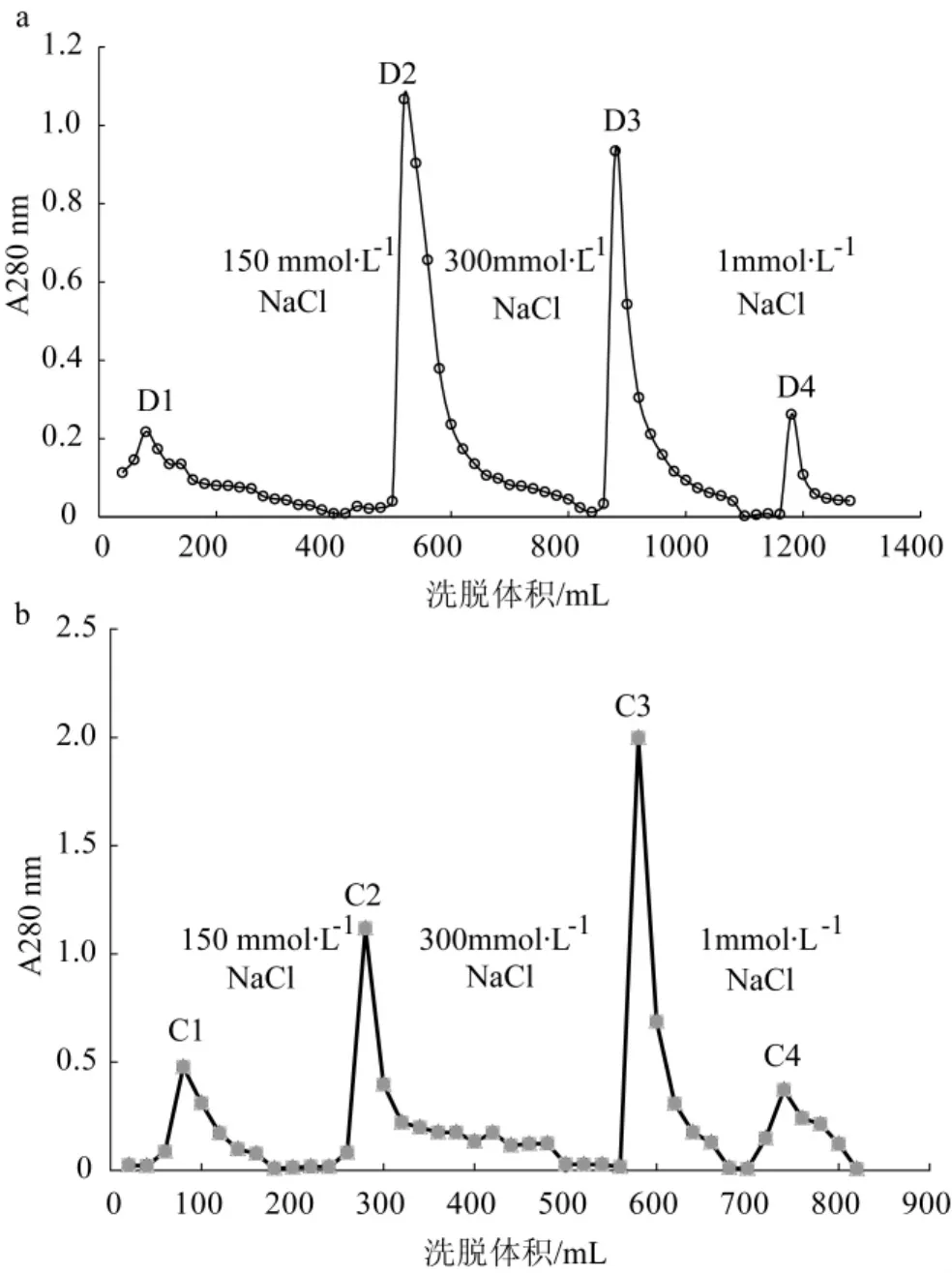
图1 RNase在DEAE-cellulose和CM-cellulose的洗脱曲线Fig.1 Elution profiles of RNase on DEAE-cellulose column and CM-celllulose column
污白干酪菌子实体经过组织匀浆、抽提后得到的粗样品通过DEAE-cellulose阴离子交换层析分段洗脱,其洗脱曲线如图1a所示,得到了4个组分的洗脱峰D1、D2、D3和D4。经过测定各洗脱峰的RNase酶活性,发现酶活性主要集中在D3组分。收集D3组分,充分透析,通过CM-cellulose阳离子交换层析,得到了4个峰,洗脱曲线如图1b所示。通过检测RNase活性,发现RNase活性集中在C2组分。污白干酪菌RNase在Superdex 75的洗脱曲线及SDS-PAGE电泳图见图2。
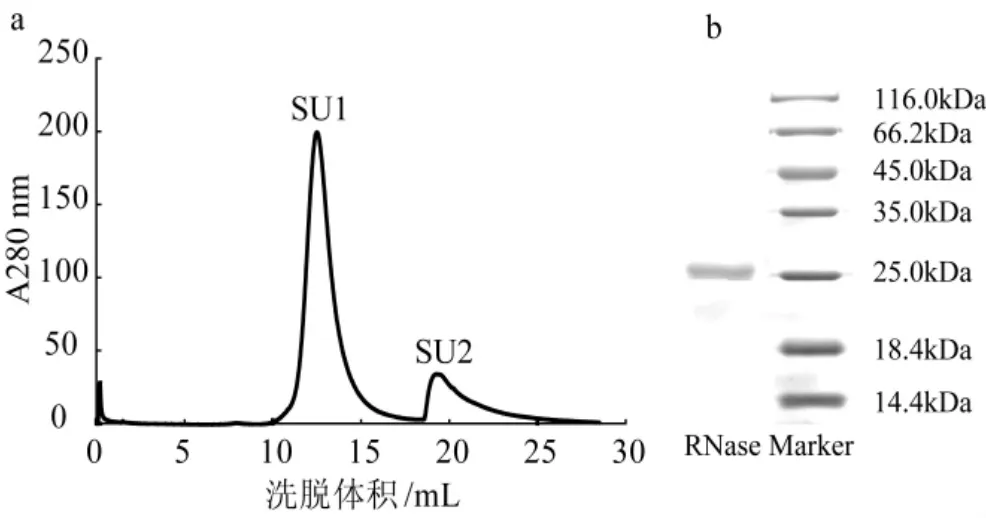
图2 RNase在Superdex-75洗脱曲线及SDS-PAGE电泳图Fig.2 FPLC-gel filtration of RNase on Superdex-75 HR 10/300column and SDS-PAGE of fraction SU1
收集C2组分,透析冻干后,进行FPLC-Su perdex-75 HR10/300凝胶过滤层析,其洗脱曲线见图2a,得到2个洗脱峰SU1和SU2,活性主要集中在SU1。SU1峰呈现的是一个单一且对称的峰,所以初步判断得到的核糖核酸酶是单一组分。收集SU1活性峰的组分,冻干后电泳检查纯度。污白干酪菌RNase的分子量是25 kDa。
2.2SDS-PAGE电泳检测结果
SU1组分电泳结果为一条带(图2b),结合在Superdex-75 HR10/300凝胶过滤的结果,该酶的分子量为25 kDa。
2.3 污白干酪菌RNase的质谱结果分析
通过质谱分析,得到的短肽序列用Mascot匹配NCBInr数据库,污白干酪菌RNase蛋白条带匹配上8个肽段,分别为:LAAELALR、EVTEISEMDIK、LEINNDKK、SFSQMALLLATWKPMR、QEEVSIPK、NFRNNIDNQLNQGMR、MTYEIGDRLK、NNKDFVCVLMSEIFPSR。
2.4 污白干酪菌RNase的理化性质
污白干酪菌RNase的最适pH、温度,以及在不同pH缓冲液和不同温度中测定的酶活性见图3。
从图3可以看出,该酶的最适pH及温度分别为pH 4.4和60℃(图3a)。pH大于6.0,酶的活性非常低,仅为最高活性的20%及以下,然而在pH 3.0到pH 5.0范围内活性比较高,由此可见该酶是一种酸性核糖核酸酶(acid RNase,ACR)。从温度对污白干酪菌RNase活性的影响来看(图3b),与其他大部分已纯化出的核糖核酸酶差不多,在温度50℃~60℃范围内活性非常高,最适温度为60℃。温度高于70℃酶迅速失活。污白干酪菌RNase在不同温度条件下处理1 h后,酶活性如图3c所示。温度低于60℃,酶的活性比较稳定,在60℃处理1 h后仍保持有80%的酶活性时,但温度高于60℃时,酶迅速失活。
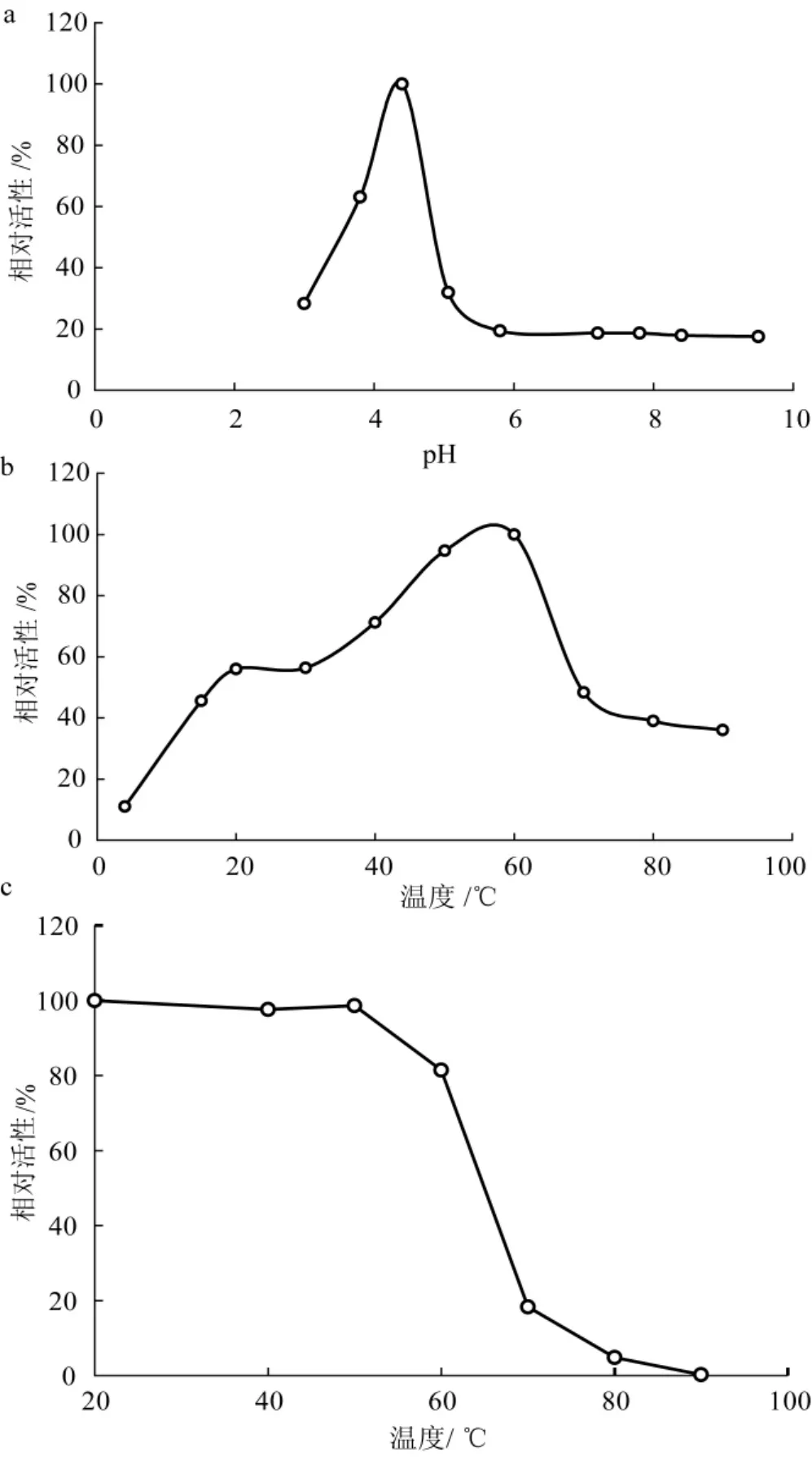
图3 污白干酪菌RNase的理化性质Fig.3 Characteristics of Tyromyces amygdalinus RNase
RNase对寡聚核糖核苷酸的水解活性远远低于对t-RNA的水解活性,该RNase对poly(A)、poly(C)均有一定的水解能力,其活性分别为(4.46± 0.4) U·mg-1和(5.33±0.3) U·mg-1,然而对t-RNA的活性为(40.0±1.9)U·mg-1。
3 结论
通过各种层析从污白干酪菌中分离纯化得到一种核糖核酸酶,其分子量为25 kDa。该酶最适作用温度和pH分别为60℃和pH 4.4。该酶对poly(A)和poly(C)均有一定的水解作用。
[1]聂明建,王国槐.植物核糖核酸酶与转基因工程雄性不育系研究进展[J].中国农学通报,2006(3):122-127.
[2]Dewi DL,Ishii H,Haraguchi N,et al.Dicer 1,ribonuclease type III modulates a reprogramming effect in colorectal cancer cells[J].Int J Mol Med,2012,29(6):1060-1064.
[3]Kobayashi H,Itagaki T,Inokuchi N,et al.A new type of RNase T2 ribonuclease in two Basidiomycetes fungi,Lentinus edodes and Irpex lacteus[J].Biosci Biotechnol Biochem,2003, 67(10):2307-2310.
[4]Ng TB,Wang HX.A novel ribonuclease from fruiting bodies of the common edible mushroom Pleurotus eryngii[J].Peptides,2004,25(8):1365-1368.
[5]Ngai PH,Ng TB.A ribonuclease with antimicrobial,antimitogenic and antiproliferative activities from the edible mushroom Pleurotus sajor-caju[J].Peptides,2004,25(1):11-17.
全球食用菌市场将迎来新发展阶段
据美国最新报道称,由于全球消费者对有机产品的需求不断增加,2018年全球食用菌市场将迎来新的发展阶段。全世界的农民已经开始着手发展蘑菇种植,并把它作为更有利可图的产业之一。
当下,一些因素扩大了蘑菇市场高收益系统的发展,增加了需求饱和,提高了客户对产品的增值接受度和改变了超市丰富的产品种类。然而,也有一些制约全球蘑菇市场增长的因素,比如蘑菇食品的短期保质期,添加使用不安全的成分或是防腐剂等。
蘑菇是有营养的,应对全世界人民进行普及。同时,增加蘑菇更深层次的研究、开发更多趣味活动,打造更全面的蘑菇创新理念,将进一步加速全球蘑菇的市场发展。
中国食用菌商务网 2015.10.30
Purification and Characterization of Ribonuclease from Tyromyces amygdalinus
GENG Xue-ran1,Ryu Mansok2,WANG He-xiang1
(1.State Key Laboratory for Agrobiotechnology and Department of Microbiology,College of Biologial Sciences,China Agricultural University,Beijing 100193,China; 2.Pyongyang KimHyongJik University of Education,Pyongyang 999093,D.P.R.Korea)
A novel ribonuclease (RNase)was purified from dry fruit bodies of Tyromyces amygdalinus using a purification procedure which involved ion exchange chromatography on DEAE-cellulose,CM-cellulose and gel filteration chromatography by FPLC on superdex 75HR 10/300 column.Combine with the result from FPLC and SDS-PAGE,it was estimated that this ribonuclease was a monomeric protein with a molecular weight of 25 kD.The optimum temperature of this RNase is 60℃,and optimum pH of it is 4.4.The activity of this enzyme toward poly A and poly C was lower than that of t-RNA.
Tyromyces amygdalinus;ribonuclease;purification;characterization
S646.9
A
1003-8310(2015)06-0063-04
10.13629/j.cnki.53-1054.2015.06.016
现代农业产业技术体系建设专项基金(CARS-24)。
耿雪冉(1988-),女,在读博士研究生,主要研究方向为药用与食用真菌。E-mail:gengxueran2007@163.com
**通信作者:王贺祥(1957-),男,博士,教授,主要从事药用与食用真菌研究。E-mail:hxwang@cau.edu.cn
2015-09-09

