《铝的氢氧化物》教学设计及反思
孙丽梅
(泉州师院附属鹏峰中学)
一、教学设计思路
本节课是苏教版化学1 第三专题第一单元的内容,教学设计以氢氧化铝的制备实验探究为主线,先探究用AlCl3制取氢氧化铝的方法,得出了氢氧化铝可以溶于过量的强碱,自然过渡到氢氧化铝两性的学习,再探究用NaAlO2制取氢氧化铝的方法,在实验过程中,不仅学习了偏铝酸钠的性质,而且进一步巩固了Al(OH)3的两性,而后归纳氢氧化铝的制备方法,使学生明确为什么制备时只用弱酸、弱碱,不用强酸与强碱的真正原因,也为《从铝土矿中提取铝》的学习埋下伏笔。
二、教学设计过程
(一)教学目标
1.掌握氢氧化铝的制备方法,会写出相关的化学方程式。
2.理解出两性氢氧化物的概念;知道氢氧化铝为两性氢氧化物;会写出相关的化学方程式。
(二)知识链接
Al 与盐酸反应方程式:2Al+6HCl=2AlCl3+3H2↑
Al 与NaOH 溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(三)教学新课
[情景设置]胃舒平又名复方氢氧化铝,是由能中和胃酸(盐酸)的氢氧化铝和三硅酸镁两药合成。
[设问]氢氧化铝有什么用途?实验室如何制备呢?
活动探究一:氢氧化铝的制备
提供试剂:AlCl3、NaOH 溶液、氨水
[设问]如何制备少量氢氧化铝?你选用的是什么试剂?为什么呢?
[实验1]将2~3 mL 2mol·L-1氯化铝溶液分别注入两支洁净的试管中,向一支试管中逐滴滴加氨水,另一支试管中逐滴滴加NaOH 溶液,观察现象,写出实验室制备氢氧化铝的化学方程式。
活动探究二:验证氢氧化铝的两性
[实验2]将实验1 制取的氢氧化铝分在两支试管中,向一支试管中加入6 mol·L-1盐酸;向另一支试管中加入6 mol·L-1氢氧化钠,观察实验现象。写出相关的化学方程式和离子方程式。
[投影]两性氢氧化物的定义:两性氢氧化物既能与酸反应,又能与碱反应生成盐和水的氢氧化物。
[板书]一、氢氧化铝的性质
1.物理性质:白色胶状物质,难溶于水。
2.化学性质:
(1)与强酸反应Al(OH)3+3HCl=AlCl3+3H2O
(2)与强碱反应Al(OH)3+NaOH=NaAlO2+2H2O
问题探究1:于AlCl3溶液中逐滴滴加NaOH 溶液时,为什么会先形成沉淀后消失?请用化学方程式与离子方程式表示并写出总的离子方程式。
活动探究三:用NaAlO2溶液制备氢氧化铝
[实验3](1)偏铝酸钠溶液中通入二氧化碳;(2)偏铝酸钠溶液中滴加盐酸比较两种制备方法的优劣。
问题探究2:于NaAlO2溶液中逐滴滴加盐酸会有什么现象?能否用化学方程式与离子方程式表示?试写出总离子方程式。
问题探究3:于NaAlO2溶液中通入过量二氧化碳气体有什么现象?写出化学方程式。
[板书]二、氢氧化铝的制备
制取Al(OH)3通常采用的方法
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
[归纳总结]Al3+、AlO-2、Al(OH)3之间的转换关系
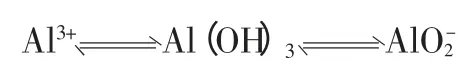
当堂训练:
1.氢氧化铝可以作为治疗某种胃病的内服药,这是利用了氢氧化铝的 ( )
A.酸性 B.碱性 C.两性 D.氧化性
2.要使AlCl3溶液中的Al3+完全转化为Al(OH)3沉淀,应选用的试剂是 ( )
A.NaOH 溶液 B.稀盐酸 C.氨水 D.AgNO3溶液
3.向下列溶液中滴加稀硫酸,一开始生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是 ( )
A.AlCl3溶液 B.NaAlO2溶液 C.MgCl2溶液 D.BaCl2溶液
三、教学反思
教学过程以活动探究和问题探究的形式贯穿整节课,实验与问题的设计循序渐进,在合作探究过程中逐步深入,游刃而解,不断激发学生的学习兴趣与探究欲望,学生在动手探究的过程中,认识了氢氧化铝的两性,并真正理解与掌握了氢氧化铝的制备方法。整节课教师只进行引导、解析和归纳,课堂上将大部分时间留给学生,实验操作及化学方程式的书写都由学生完成,存在的问题也在学生交流讨论中解决,并设计当堂训练题以巩固所学知识。课堂的学习氛围非常活跃,他们积极交流、踊跃回答,学生的合作探究能力和自主学习能力也在学习中得到提高。

