葡萄糖及胰岛素对血管平滑肌凋亡的影响
梁新剑,董少红,罗林杰,李 军
(深圳市人民医院心内科,广东 深圳 518020)
葡萄糖及胰岛素对血管平滑肌凋亡的影响
梁新剑,董少红,罗林杰,李 军
(深圳市人民医院心内科,广东 深圳 518020)
目的 观察不同浓度葡萄糖及胰岛素对血管平滑肌细胞(VSMC)凋亡现象的抑制作用。方法采用酶消化法结合组织贴块法培养胎儿主动脉VSMC,以3%H2O2诱导VSMC凋亡(H2O2组)。葡萄糖组以加入DMEM培养基中葡萄糖的浓度不同分为对照组(1.5 g/L)和高糖组(4.5 g/L);胰岛素组根据加入的低糖DMEM培养基中胰岛素的浓度不同,分为四组:0(对照组)、4×10-5IU/L组、4×10-4IU/L组、4×10-3IU/L组。每组均设置三个复孔,观察6 h、12 h、24 h三个时间点上的SMC细胞的凋亡状况。通过倒置相差显微镜CKX31及电镜观察细胞凋亡现象,同时利用Annexin-Ⅴ结合PI,流式细胞仪技术检测细胞凋亡率。结果加入H2O2后VSMC出现凋亡现象。与对照组比较,H2O2组细胞凋亡率在各时间段明显增加(P<0.05),24 h时凋亡率为(46.3±0.4)%,增加最为显著(P<0.05);高糖组在6 h、12 h、24 h时凋亡率分别为(16.20±0.53)%、(23.47±0.55)%、(35.87±0.35)%,对照组分别为(20.50± 0.70)%、(30.23±0.51)%、(46.3±0.46)%,高糖组比较对照组显著下降,差异均有统计学意义(P<0.05);在四个浓度组的不同时间段,胰岛素组与对照组相比凋亡率均显著减少(P<0.01)。随着胰岛素浓度的增加,细胞凋亡率有明显降低的趋势(P<0.05)。结论高浓度葡萄糖和胰岛素都可以抑制VSMC凋亡,且这一作用呈浓度依赖性。
葡萄糖;胰岛素;血管平滑肌细胞;细胞培养;凋亡
目前在狭窄血管中血运重建特别是冠心病治疗方法中经皮冠状动脉腔内成形术(Percutaneous transluminal coronary angioplasty,PTCA)和冠状动脉旁路移植术(Coronary artery bypass grafting,CABG)是其中两种主要的手术方法。自20世纪70年代,Grüntzig等[1-2]首先将PTCA应用于冠心病的治疗。随着技术的进步和经验积累,PTCA的适应证在不断扩大,成功率也在不断提高。经过多年的临床观察和实践证明:与CABG相比,PTCA在预后和治疗费用上区别并不太大,但因PTAC无须开胸手术、对患者的损伤较小、安全性高、疗效好等优点,在临床中尤其有独特优势[3]。PTCA手术治疗中的术后再狭窄(Restenosis,RS)一直是困扰医护人员的一个重要问题,虽然经过几十年的发展,大量的药理学和机械方法被用来减少再狭窄的发生率,但PTCA术后再狭窄问题依然很重要,尤其是对于高危患者,很大的限制了PTCA的使用。
再狭窄一般被定义为与参照血管相比管内直径缩小大于50%,这种情况的出现取决于患者自身的遗传背景和相关疾病,并影响到循环系统,包括糖尿病、高血压和高胆固醇血症。PTCA术后再狭窄的典型表现就是血小板凝集、生长因子的释放、炎性细胞浸润、内膜平滑肌细胞的增殖和迁移及细胞外基质的重塑。深入了解血管生理愈合的反应和术后再狭窄反应的分子机理,有助于研究发展出新的方法来控制病理性的新生内膜的形成。2014年10~12月,我们利用体外培养获得细胞,并通过流式细胞仪技术研究探讨了葡萄糖和胰岛素对胎儿主动脉平滑肌细胞(Vascular smooth muscle cell,VSMC)凋亡的诱导作用。
1 材料与方法
1.1 主要试剂及仪器 低糖(1.5 g/L)DMEM培养基、高糖(4.5 g/L)DMEM培养基、小牛血清(HYCLONE,US)、胰岛素(购自诺和诺德公司,批号:RVG0228)、鼠抗人单克隆抗体α-actin(Neumark,US);流式细胞仪(Beckman Coulter Altra);Annexin-V Fitc标记联合PI凋亡检测试剂盒(Imunotech)。
1.2 方法
1.2.1 细胞培养 培养的血管平滑肌细胞(VSMC)来自于3个月龄水囊引产的胎儿。细胞的原代培养参考Campbell的贴块法进行[4]。在组织培养一周后从边缘取出细胞,继续培养2~3周,当培养的细胞在镜下可见典型的“峰-谷”样生长时,使用鼠抗人α-actin免疫组化SABC法进行鉴定,证实所培养细胞为平滑肌细胞(SMC),并无内皮细胞及成纤维细胞污染。
1.2.2 培养细胞分组 选取对数生长期SMC细胞,加入到含1%小牛血清的低糖DMEM的培养基中,静置培养48 h,细胞进入增殖静止阶段。其后,加入20%小牛血清+低糖DMEM培养基,SMC培养细胞重新进入增殖生长周期。随后加入含终浓度为3%H2O2诱导SMC的凋亡。葡萄糖组以加入DMEM培养基中葡萄糖浓度不同分为对照组(1.5 g/L)和高糖组(4.5 g/L);胰岛素组根据加入的低糖DMEM培养基中胰岛素浓度的不同,分为四组:0(对照组)、4×10-5IU/L组、4×10-4IU/L组、4×10-3IU/L组。每组均设置三个复孔,观察6 h、12 h、24 h三个时间点上的SMC细胞的凋亡状况。
1.2.3 SMC培养细胞的形态学观察 通过倒置相差显微镜CKX31及电镜对各组凋亡细胞形态学的变化情况进行观察。
1.2.4 流式细胞仪细胞凋亡率的检测 收集消化各组不同时间段细胞,加入带有绿色荧光的荧光探针FITC标记的Annexin V 5µl,避光染色10 min,磷酸盐缓冲液(PBS)清洗,加碘化丙啶(Propidium Iodide,PI)染色液10µl后使用流式细胞仪进行细胞凋亡情况检测。Annexin-V+/PI-为凋亡细胞。
1.3 统计学方法 应用SPSS18.0统计软件对本研究所采集数据进行统计学分析,计量数据以均数±标准差(±s)表示。采用单因素方差分析不同时间H2O2对VSMC凋亡的影响、葡萄糖对VSMC凋亡的影响,组间比较采用配对t检验。不同时间不同浓度胰岛素对VSMC凋亡的影响采用析因分析,并用F检验进行组间比较。以P<0.05为差异具有统计学意义。
2 结 果
2.1 形态学 在倒置相差显微镜下可见有SMC培养细胞原有的贴壁延展的生长形态已不存在,而伴随出现了体积变小、变圆,出现胞膜气泡等明显的凋亡现象,在高分辨率电镜下可观察到凋亡小体的存在,见图1。

图1 电镜下可见凋亡小体等凋亡现象
2.2 流式细胞仪凋亡检测结果
2.2.1 H2O2诱导凋亡 对照组与H2O2组随着时间的延长,细胞凋亡率均逐渐增加。与对照组相比,H2O2组细胞凋亡率在各时间段明显增加(P<0.05),24 h时凋亡率增加最为显著(t=153.868,P<0.0001),见表1。
表1 不同时间H2O2对VSMC凋亡的影响(%,±s)
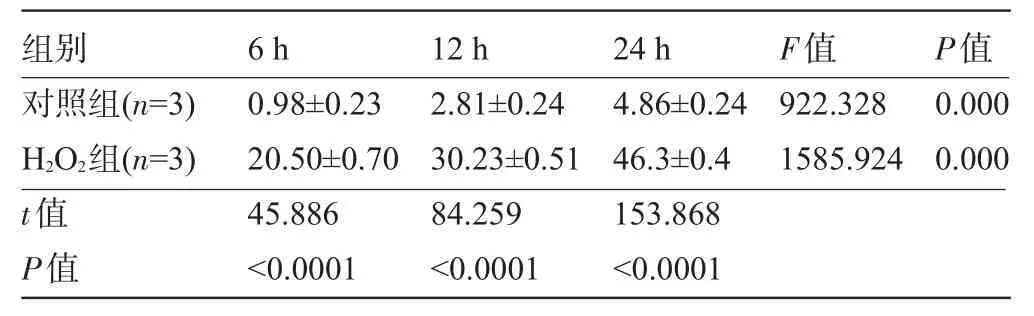
表1 不同时间H2O2对VSMC凋亡的影响(%,±s)
P值0.000 0.000F值922.328 1585.924组别对照组(n=3) H2O2组(n=3)t值P值6 h 0.98±0.23 20.50±0.70 45.886<0.0001 12 h 2.81±0.24 30.23±0.51 84.259<0.0001 24 h 4.86±0.24 46.3±0.4 153.868<0.0001
2.2.2 葡萄糖组 从表2可看出,高糖组与对照组细胞凋亡率均随着时间的延长而增加。在同一时间段,高糖组与对照组相比凋亡率明显减少(P<0.05),24 h时下降最多(t=31.254,P<0.000 1)。高糖组细胞凋亡率较对照组凋亡率有明显的下降趋势,见图2。
表2 葡萄糖对VSMC凋亡的影响(%,±s)
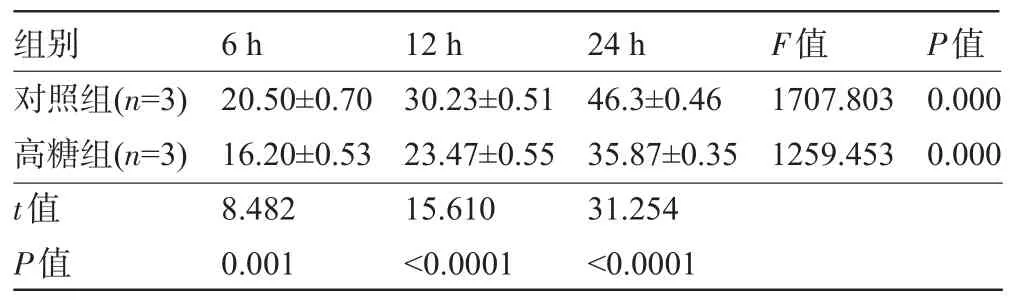
表2 葡萄糖对VSMC凋亡的影响(%,±s)
组别对照组(n=3)高糖组(n=3)t值P值6 h 20.50±0.70 16.20±0.53 8.482 0.001 12 h 30.23±0.51 23.47±0.55 15.610<0.0001 24 h 46.3±0.46 35.87±0.35 31.254<0.0001F值1707.803 1259.453P值0.000 0.000
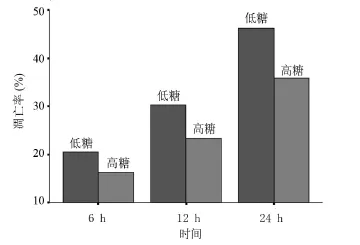
图2 不同浓度葡萄糖对细胞凋亡的影响
2.2.3 胰岛素组 从表3胰岛素对VSMC凋亡的影响可见,对照组随着时间的延长,细胞凋亡率明显增加(P<0.05),各不同浓度组的细胞凋亡率随着时间的延长也有增加,各组之间比较均有统计学意义(P<0.05)。在各不同浓度组的不同时间段,胰岛素组与对照组相比凋亡率均明显减少(P<0.05)。在同一时间段,随着胰岛素在4×10-5IU/L、4×10-4IU/L、4×10-3IU/L三个不同浓度组的凋亡率都呈现降低的趋势,各浓度组之间凋亡率比较均有统计学意义(P<0.05)。3×4析因分析结果显示随着胰岛素浓度的增加,凋亡率的降低差异具有统计学意义(F=3 205.971,P<0.001);随着胰岛素浓度的增加,培养SMC凋亡率有降低的趋势,见图3。
表3 胰岛素对VSMC凋亡的影响(%,±s)

表3 胰岛素对VSMC凋亡的影响(%,±s)
注:FA=3738.311,PA<0.001;FB=3205.971,PB<0.001;FA×B=158.383,PA×B<0.001。
浓度(B)时间(A)24 h 6 h 12 h 46.30±0.46 29.63±0.67 25.27±0.50 16.07±0.64对照组(0,n=3) 4×10-5IU/L(n=3) 4×10-4IU/L(n=3) 4×10-3IU/L(n=3) 20.50±0.70 14.07±0.23 10.2±0.40 6.27±0.32 30.23±0.51 18.37±0.15 15.27±0.50 10.97±0.21

图3 不同浓度胰岛素对细胞凋亡的影响
3 讨 论
冠脉支架术后再狭窄严重影响着冠心病尤其合并有糖尿病患者的预后,引起再狭窄的增殖细胞主要是平滑肌细胞。有研究指出血管平滑肌细胞在支架术后24 h开始增殖,在3~4 d内处于增殖状态的平滑肌细胞(SMC)开始部分向内膜迁移,这一过程会持续数周至数月[5]。楚海荣等[6]发现高糖促进平滑肌细胞的迁移,在高糖环境下,平滑肌细胞由收缩表型向合成表型转变。有研究也表明糖尿病患者的高血糖能促使血管平滑肌细胞表型转变、增殖及迁移能力增强[7]。平滑肌细胞的增殖启动的同时,细胞凋亡也加速[8]。细胞凋亡受阻是许多慢性非肿瘤性增殖性疾病的主要发病原因[8]。还有研究发现高糖血症可以促进血管平滑肌增殖,但其对SMC凋亡的影响尚不得而知[9]。而胰岛素抵抗时,血管平滑肌细胞的增殖迁移受丝裂原活化蛋白激酶(MAPK)信号通路调节[10]。最近有研究发现,高浓度胰岛素(100 nmol/L)诱导的血管平滑肌细胞增殖迁移伴有NADPH氧化酶活性增加及ROS的生成增多[11]。
本研究中,我们在离体培养条件下获得了合成表型的平滑肌细胞。已有研究表明H2O2浓度超过225 pmol/L以后对细胞具有一定的毒性,抑制VSMC的增殖[12],本研究与之相同,加入含终浓度为3%的H2O2后与对照组相比,H2O2组细胞凋亡率在各时间段明显增加,确证了3%的H2O2可诱导SMC的凋亡。我们进一步检测了高糖及胰岛素对血管平滑肌细胞凋亡的影响。研究发现随着时间的延长细胞凋亡率都在增加(凋亡率是一个累加的过程),而高糖组与对照组相比凋亡率明显减少(P<0.05),从趋势图也可看出随着时间的延长高糖组细胞凋亡率较对照组凋亡率有明显的下降趋势。说明高糖对H2O2诱导的VSMC凋亡有一定的抑制作用。与此同时,我们通过3个时间段、4个不同浓度胰岛素对H2O2诱导的VSMC凋亡进行了分析,结果表明随着胰岛素浓度的增加,凋亡率具有降低的趋势,差异具有统计学意义(F=3 205.971,P<0.001)。说明高浓度胰岛素对H2O2诱导的VSMC也有一定的抑制作用,而且这一作用随着胰岛素浓度的增加而增加。目前已有的研究也显示葡萄糖可能通过影响激酶的磷酸化来影响SMC的细胞增殖和凋亡[13],而胰岛素可能是通过激活蛋白激酶B(PKB或者Akt)途径来调控SMC的细胞增殖和凋亡[14]。因此糖尿病患者高血糖及胰岛素抵抗继发的高胰岛素血症对VSMC凋亡的抑制作用有可能是再狭窄发生的一个重要环节。
[1]Grüntzig A,Kuhlmann U,Vettwe W,et al.Treatment of renovascular hypertension with percutaneous transluminal dilatation of a renal-artery stenosis[J].Lancet,1978,311(8068):801-802.
[2]Grüntzig AR,Senning Å,Siegenthaler WE.Nonoperative dilatation of coronary-artery stenosis:percutaneous transluminal coronary angioplasty[J].N Engl J Med,1979,301(2):61-68.
[3]王 慧,饶 莉.冠心病患者经皮冠状动脉介入治疗与冠状动脉旁路搭桥术治疗优劣对比[J].心血管病学进展,2010,31(4): 524-526.
[4]Campbell JH,Campbell GR.Culture techniques and their applications to studies of vascular smooth muscle[J].Clin Sci(Lond), 1993,85(5):501-513.
[5]O'brien E.Proliferation in primary and restenotic coronary atherectomy tissue.Implications for antiproliferative therapy[J].Circulation Research,1993,73(2):223-231.
[6]楚海荣,李 宏,吴海燕,等.高糖对大鼠血管平滑肌细胞迁移的影响及其机制[J].中国动脉硬化杂志,2014,21(11):1097-1100.
[7]赵志波,刘江华.血管平滑肌细胞表型转变与糖尿病血管病变[J]. 2014,34(5):616-621.
[8]Isner JM.Apoptosis in human atherosclerosis and restenosis[J].Circulation,1995,91(11):2703-2711.
[9]赵占胜,王 绵,梁江燕,等.罗格列酮对高糖诱导大鼠血管平滑肌细胞炎症和增殖的影响[J].中国老年学杂志,2010,30(10): 1371-1374.
[10]Cersosimo E,Xu X,Musi N.Potential role of insulin signaling on vascular smooth muscle cell migration,proliferation,and inflammation pathways[J].Am J Physiol Cell Physiol,2012,302(4): C652-C657.
[11]Abhijit S,Bhaskaran R,Narayanasamy A,et al.Hyperinsulinemia-induced vascular smooth muscle cell(VSMC)migration and proliferation is mediated by converging mechanisms of mitochondrial dysfunction and oxidative stress[J].Mol Cell Biochem,2013,373 (1-2):95-105.
[12]张秀萍.丹参对血管平滑肌细胞增殖、凋亡的影响[D].武汉:湖北中医药大学,2012.
[13]张佼佼.高糖对血管平滑肌细胞凋亡和增殖影响的研究[J].医学分子生物学杂志,2013,10(2):100-104.
[14]王宝玉,孙曼怡,林静娜.胰岛素对大鼠结肠平滑肌细胞凋亡及MAPK通路的影响[J].基础医学与临床,2013,33(6):726-730.
Influence of glucose and insulin on apoptosis of vascular smooth muscle cell.
LIANG Xin-jian,DONG Shao-hong, LUO Lin-jie,LI Jun.Department of Cardiology,Shenzhen People's Hospital,Shenzhen 518020,Guangdong,CHINA
ObjectiveTo observe the influence of glucose and insulin on apoptosis of vascular smooth muscle cell(VSMCs)cultured from the thoracic aortas of the aborted fetusin vitro.MethodsVSMCs from the thoracic aortas of the aborted fetus were culturedin vitro,and 3%H2O2was applied to induce apoptosis(H2O2group).Different concentrations of glucose and insulin for the different incubation time was applied for intervention of apoptosis.According to the concentration of glucose in DMEM medium,glucose group were divided into the glucose control group (1.5 g/L)and the high sugar group(4.5 g/L).According to the concentration of insulin in DMEM medium,insulin group were divided into four groups:0(insulin control group),4×10-5IU/L group,4×10-4IU/L group,4×10-3IU/L group.Each group have three holes.The apoptosis of SMC cells was observed on three time points:6 h,12 h,24 h. The apoptosis rate was detected by Annexin-V combined with PI,flow cytometry.ResultsApoptosis was observed after induction by 3%H2O2.Compared with the control group,the apoptosis rates of H2O2group was significantlyhigher at each time point(P<0.05),with the apoptosis rate at 24 h of(46.3±0.4)%,which was increased most significantly.At the same time point,the apoptosis rate was descended in high glucose group[(16.20±0.53)%,(23.47±0.55)%, (35.87±0.35)%at 6 h,12 h,24 h,respectively),compared with the glucose control group[(20.50±0.70)%,(30.23± 0.51)%,(46.3±0.46)%],P<0.05.For insulin group,the apoptosis rate of 4×10-5IU/L group,4×10-4IU/L group,4×10-3IU/L group was significantly lower than that in insulin control group(P<0.01).With the increase of the concentration of insulin,the apoptosis rate reduced significantly(P<0.05).ConclusionHigh levels of glucose and insulin may inhibit apoptosis of VSMC,with concentration-dependent effect.
Glucose;Insulin;Vascular smooth muscle cell(VSMC);Cell culture;Apoptosis
R977.1+5
A
1003—6350(2015)23—3436—04
10.3969/j.issn.1003-6350.2015.23.1247
2015-05-18)
梁新剑。E-mail:13430783949@139.com

