NNK联合LPS孵育对小鼠巨噬细胞增殖及相关基因表达影响
陈琛,卞晶晶,刘晓萍,张静,于忠杰,杨童茜
(青岛大学医学院组织胚胎学教研室,山东 青岛 266021)
越来越多的研究结果表明,炎性反应与肿瘤的发生发展密切相关。4-(甲基亚硝氨基)-3-吡啶-1-丁酮(NNK)是7种烟草烟雾中最强的致癌剂,经口腔、注射、气管支气管灌注等途径给予NNK,可成功建立肺癌模型[1]。脂多糖(LPS)是革兰阴性杆菌外膜的重要组成部分,是研究中广泛应用的致炎因子。近年来,有学者通过给予NNK和LPS联合刺激来制备肺癌动物模型。既往研究结果显示,LPS单独应用并不能诱发小鼠肺癌发生,当与NNK联合刺激时,NNK的致瘤效果明显增强[1],但其机制尚不清楚。肺内的巨噬细胞是重要的免疫细胞,其在LPS和NNK联合刺激诱发肺癌过程中的变化报道甚少。活化的巨噬细胞至少包括M1、M2两种类型:M1型巨噬细胞可分泌肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1α以及IL-6等,并可使诱生型一氧化氮合酶(iNOS)表达升高;M2型巨噬细胞是一种抑制型细胞,可分泌IL-10、IL-4等抗炎因子,精氨酸酶(Arginase)高表达为其特征[2-3]。C-myc和核转录因子-κB(NF-κB)是重要的转录因子,其基因编码的转录产物与细胞凋亡、细胞分化、细胞增殖及细胞周期进程密切相关[4]。C-myc基因在肺癌、宫颈癌、结肠癌、乳癌和胃癌等多种肿瘤组织过度表达[5]。本实验在体外研究LPS、NNK以及两者联合应用对小鼠巨噬细胞增殖及相关基因表达的影响,以探讨炎症促发癌症的机制。
1 材料与方法
1.1 主要材料
Raw264.7细胞购自美国ATCC公司,LPS购自美国Sigma公司,NNK购自美国Toronto Research Chemicals公司,RNA抽提试剂盒、cDNA逆转录试剂盒及RT-PCR试剂盒均购自美国Applied biosystems公司,TNF-α与IL-6酶联免疫试剂盒均购自美国eBioscience公司。细胞计数仪(Nexcelom Bioscience,Lawrence,MA)购自美国 Nexcelom Bioscience公司,7900HT快速实时定量PCR反应设备购自美国Applied biosystems公司。
1.2 引物合成
根据NCBI中的基因序列,应用Primer 5.0软件设计引物,引物由美国Operon公司合成,引物序列见表1。
1.3 实验方法
1.3.1 巨噬细胞培养及LPS、NNK浓度选择 将RAW264.7细胞置于含有体积分数0.1胎牛血清的DMEM培养液中,并添加105U/L青霉素和链霉素,置于37℃、含体积分数0.05CO2的培养箱中培养、扩增。取对数生长期细胞培养5h贴壁后,随机分为对照组、NNK组和LPS组。LPS组和NNK组分别加入10μg/L、250μg/L、1mg/L、4mg/L的LPS和5、10、25、100μmol/L的NNK,对照组加入等体积的无血清DMEM培养液,然后孵育Raw264.7细胞24h,每组设3个平行孔,实验重复2次。应用氯仿-异戊醇法抽提总RNA,逆转录为cDNA后进行实时定量PCR反应,结果以2△△Ct表示。

表1 PCR所用引物名称及其序列
1.3.2 巨噬细胞增殖能力检测 取指数生长期的Raw264.7细胞,以32×106/L接种于12孔板,培养5h后,随机分为对照组(A组)、NNK组(B组)、LPS组(C组)和LPS+NNK组(D组),每组设3个平行孔。所用NNK浓度为10μmol/L,LPS浓度为1mg/L,对照组加入等体积的无血清DMEM培养液。培养24h后用细胞计数仪计数单位体积内细胞,判定细胞增殖状态。
1.3.3 巨噬细胞相关基因表达的检测 取对数生长期的Raw264.7细胞,培养5h贴壁后随机分组,分组及用药方法同1.3.2。孵育24h抽提RNA,进行实时定量 PCR 反应,检测 C-myc、NF-κB、Arginase、iNOS、IL-6和IL-1αmRNA 表达。每组设3个平行孔,实验重复2次。
1.3.4 巨噬细胞IL-6和TNF-α蛋白表达检测 取8×104个对数生长期的Raw264.7细胞接种于6孔板,培养5h,分组及用药同1.3.2。于培养24h收集细胞,提取样品蛋白,使用TNF-α与IL-6酶联免疫试剂盒定量检测IL-6和TNF-α蛋白含量。
1.4 统计学处理
采用Graphpad Prism 6.0统计软件进行分析。计量数据均以表示,应用析因设计的方差分析观察组间是否存在交互作用,析因结果存在交互作用时使用One way ANOVA检验进一步分析各因素的单独效应。以P<0.05为差异有显著性。
2 结 果
2.1 LPS和NNK实验浓度选择
以浓度为10μg/L、250μg/L、1mg/L、4mg/L的LPS孵育Raw264.7细胞24h,细胞C-myc mRNA相对表达量分别为22.89±1.71、41.73±2.22、61.35±11.24、41.80±5.71;对照组细胞C-myc mRNA相对表达量为1.00±0.16。LPS可上调 Raw264.7细胞C-myc mRNA的相对表达量,其中浓度为1mg/L的LPS作用最显著(F=605.6,P<0.01)。5、10、25、100μmol/L的NNK孵育Raw264.7细胞24h,细胞C-myc mRNA的相对表达量分别为0.71±0.23、0.99±0.17、0.83±0.14、0.70±0.16,呈 下 降 趋势,但与对照组(1.00±0.16)相比差异无统计学意义。故选择1mg/L的LPS和10μmol/L的NNK用于下一步实验。
2.2 各组细胞增殖能力比较
C组Raw264.7细胞的增殖与A组相比差异有显著性(F=5.28,q=3.18,P<0.05),而B组与 A组比较、D组与C组相比较差异均无显著性(P>0.05)。见表2。
2.3 各组细胞相关基因表达比较
B组Raw264.7细胞各基因表达与A组比较,差异均无统计学意义。C、D组Raw264.7细胞各基因表达均较 A组显著升高(F=19.4~5 895.0,t=4.04~97.53,P<0.05)。D组 C-myc mRNA 的表达显著低于C组(t=4.80,P<0.01),而 NF-κB和IL-1αmRNA的表达则均显著高于C组(t=3.76、2.81,P<0.05)。见表2。
2.4 各组细胞IL-6和TNF-α蛋白表达比较
B组细胞IL-6和TNF-α蛋白表达与A组比较差异无显著意义。C、D组细胞IL-6和TNF-α蛋白表达较 A组显著升高(F=1 213.0、110.2,t=29.40~44.76,P<0.01);D 组 TNF-α蛋白表达显著低于 C组(t=3.74,P<0.01)。见表3。
表2 各组小鼠巨噬细胞增殖及相关基因mRNA表达比较(n=6,)
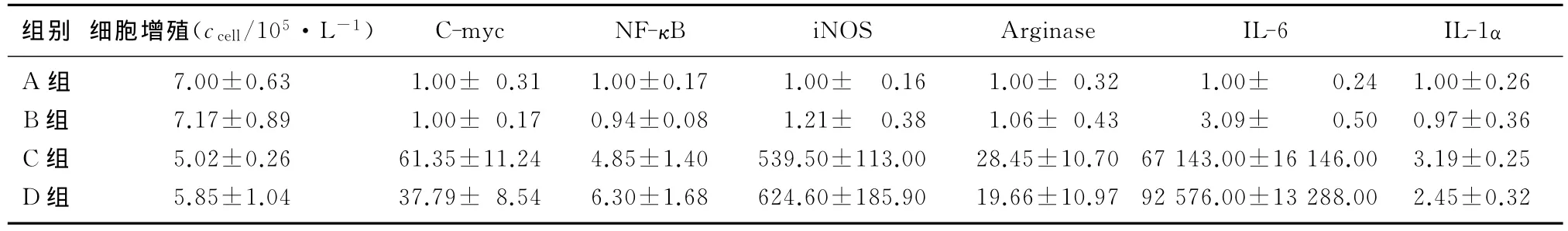
表2 各组小鼠巨噬细胞增殖及相关基因mRNA表达比较(n=6,)
组别 细胞增殖(ccell/105·L-1) C-myc NF-κB iNOS Arginase IL-6 IL-1α A 组 7.00±0.63 1.00± 0.31 1.00±0.17 1.00± 0.16 1.00± 0.32 1.00± 0.24 1.00±0.26 B 组 7.17±0.89 1.00± 0.17 0.94±0.08 1.21± 0.38 1.06± 0.43 3.09± 0.50 0.97±0.36 C 组 5.02±0.26 61.35±11.24 4.85±1.40 539.50±113.00 28.45±10.70 67 143.00±16 146.00 3.19±0.25 D 组 5.85±1.04 37.79± 8.54 6.30±1.68 624.60±185.90 19.66±10.97 92 576.00±13 288.00 2.45±0.32
表3 各组细胞IL-6和TNF-α蛋白表达比较(n=6,ρ/μg·L-1,)

表3 各组细胞IL-6和TNF-α蛋白表达比较(n=6,ρ/μg·L-1,)
组别 IL-6 TNF-a A 组 1.512±0.239 3.368±0.142 B 组 1.613±0.364 3.392±0.500 C 组 38.510±2.290 42.770±6.211 D 组 34.920±3.430 33.110±4.670
3 讨 论
在癌症发展过程中炎症有两个方面的作用。一方面是杀灭肿瘤,在这种情况下,炎症诱导各种免疫细胞到达肿瘤位点,诱导肿瘤细胞及正常细胞凋亡。如果肿瘤细胞在此阶段被完全消除,炎症减弱且组织重塑,仅引发特定区域的急性炎症。另一方面可以刺激癌变,炎症可导致基因组的不稳定,造成基因突变。已有研究结果表明,炎症可以增加至少3个靶基因(Cmyc、Aurka和Pim1)的基因组不稳定和突变;肿瘤细胞可以在炎症环境下生存,慢性炎症通常可以提供有利于肿瘤发展的微环境,促进肿瘤生长或恶变[6]。
C-myc基因是myc基因家族的成员之一,属核内转录因子,其编码蛋白介导细胞外传入细胞内的生物信号向细胞核内传递,参与细胞增殖和细胞凋亡的调控[7-8]。C-myc在细胞静止期不表达,而在有丝分裂原作用下迅速表达,促使细胞增殖、浸润,最终细胞增殖异常而癌变[9-10]。已有研究证实,C-myc基因在肝细胞癌(HCC)组织中高表达,在癌旁组织中的表达明显下降,而在正常肝组织中则不表达,提示C-myc基因过度表达可能是诱发HCC的原因之一[11]。有研究表明,C-myc控制着45%的表型转化相关基因,参与巨噬细胞表型的转化,调控促癌基因的表达和细胞形态改变[8]。本文结果显示,浓度为5~100μmol/L的 NNK 对 Raw264.7细胞 C-myc mRNA表达和增殖无显著影响;LPS在10μg/L~4mg/L的浓度范围则可以显著上调Raw264.7细胞C-myc mRNA的相对表达量,以浓度为1mg/L的LPS作用最强。当LPS与NNK联合刺激时,小鼠Raw264.7细胞C-myc mRNA也呈高表达,但较单独LPS刺激的作用弱。同时,细胞的形态发生改变,胞核变大,细胞变大并伸出伪足状突起,呈现出活化状态。提示LPS与NNK联合刺激可能进一步促进了巨噬细胞的活化。
我们前期研究结果显示,应用不同浓度的炎性启动因子LPS体外孵育可以明显促进人肺腺癌上皮A549细胞的增殖,进一步提示LPS有激活肺癌细胞增殖的作用[12]。为进一步验证LPS和NNK联合孵育对巨噬细胞的作用,本实验分析了LPS和NNK对巨噬细胞 NF-κB、Arginase、iNOS、IL-1α、IL-6mRNA 和TNF-α、IL-6蛋白表达的影响。研究结果显示,单独NNK孵育对巨噬细胞相关基因和蛋白的表达无明显影响,而LPS孵育可显著刺激巨噬细胞高表达C-myc等相关基因和蛋白,提示LPS主要激活M1型巨噬细胞。当LPS+NNK联合孵育Raw264.7细胞时,NNK 强化了 LPS激活 NF-κB、IL-1α基因的作用;促进了M1型巨噬细胞的激活,进而刺激M1型细胞产生和分泌IL-1α。这些炎性递质进一步刺激巨噬细胞过表达iNOS等,从而导致NO合成大大增加,导致正常细胞DNA的损伤,阻碍DNA修复,诱导基因突变,刺激肺癌形成。如果改变LPS或NNK的反应时间,是否还会发生同样的变化尚需进一步研究。
[1]KEOHAVONG P,KAHKONEN B,KINCHINGTON E,et al.K-ras mutations in lung tumors from NNK-treated mice with lipopolysaccharide-elicited lung inflammation[J].Anticancer Res,2011,31(9):2877-2882.
[2]周宪宾,姚成芳.巨噬细胞 M1/M2极化分型的研究进展[J].中国免疫学杂志,2012,22(10):957-960.
[3]STUEHR D J,NATHAN C F,NITRIC O.A macrophage product responsible for catastasis and respiratory inhibition in tumor target cells[J].Exp Med,1989,16(9):1543-1555.
[4]杨志寅.诊断学大辞典[M].北京:华夏出版社,1993:245-254.
[5]KANAZAWA S,SOUCEK L,EVAN G,et al.c-Myc recruits P-TEFb for transcription,cellular proliferation and apoptosis[J].Oncogene,2003,22(36):5707-5711.
[6]杨蕊旭,邓炯.慢性炎症对肺癌发生的促进作用[J].国际肿瘤学杂志,2014,41(12):906-909.
[7]VAKKALA M,KAHLOS K,LAKARI E,et al.Inducible nitric oxide synthase expression,apoptosis,and angiogenesis in in situ and invasive breast carcinomas[J].Clin Cancer Res,2000,6(6):2408-2416.
[8]FELLEY-BOSCO E.Role of nitric oxide in genotoxicity:implication for carcinogenesis[J].Cancer Metastasis Rev,1998,17(1):25-37.
[9]王建军,万志红,赵平,等.Tat融合蛋白表达载体TAT-c-Myc的克隆化及蛋白表达研究[J].中华临床医师杂志:电子版,2015,9(5):788-792.
[10]项锋钢,党受琴,冉雯雯,等.非小细胞肺癌组织Bmi-1与C-myc蛋白表达及其相关性[J].青岛大学医学院学报,2011,47(3):204-206,209.
[11]郭晓林,姜雅秋,迟宝荣.C-myc基因和P16基因在肝细胞癌中的表达及其临床意义[J].临床肝胆病杂志,2007,23(6):440-441.
[12]任姸,曹留霞,张静,等.iNOS在EGCG促A549细胞凋亡中的作用[J].齐鲁医学杂志,2014,29(4):286-288,292.

